Презентация "Общая характеристика элементов главной подгруппы VI группы (подгруппы кислорода)" по химии – проект, доклад
Презентацию на тему "Общая характеристика элементов главной подгруппы VI группы (подгруппы кислорода)" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 17 слайд(ов).
Слайды презентации
Список похожих презентаций
Общая характеристика элементов подгруппы кислорода
ПАМЯТКА К ИЗУЧЕНИЮ ПОДГРУППЫ ЭЛЕМЕНТОВ. 1.Пользуясь Периодической системой, выпишите символы и названия химических элементов, относящихся к данной ...Характеристика элементов VII группы главной подгруппы. Хлор
. . . . Нахождение в природе.В земной коре хлор - самый распространённый галоген. Поскольку хлор очень активен, в природе он встречается только ...
Соединения Ca и Mg, представителей элементов II группы главной подгруппы
План урока. Проверка домашнего задания. 2. Знакомство с соединениями металлов главной подгруппы второй группы. 3. Л/р «Изучение коллекции соединений ...Общая характеристика подгруппы углерода
Сравнительная характеристика элементов IV группы главной подгруппы. 2s22p2 3s23p2 4s24p2 5s25p2 6s26p2 C Si Ge Sn Pb 73 119 )) ))))) ))) )))))) ))))))) ...Элементы главной подгруппы V группы
Фосфор и здоровье человека. Содержание фосфора в организме человека (масса тела 70 кг) составляет 780 г. Суточная доза для взрослых 1 г. Бирюза(минерал ...Щелочные металлы - элементы I группы главной подгруппы
Li Na K Rb Cs Fr. Физические свойства щелочных металлов:. Серебристого цвета Мягкие, легко режутся ножом Твердость от Li → Na → K → Rb → Cs → Fr уменьшается: ...Общая характеристика элементов VA-группы. Азот
Элементы VA-группы. Элементы VА-группы. Общая электронная формула: […] ns 2 (n–1)d 10np 3. Степени окисления: –III, 0, +III, +V. Валентные возможности: ...Железо элемент побочной подгруппы
Цель:. 1. Вводная тема для формирования и развития познавательного интереса к материалу. 2. Осознания учащимися исторического значения освоения железа ...Железо – элемент побочной подгруппы
Общая характеристика железа. Нахождение в природе. Fe ХАЛЬКОПИРИТ ПИРИТ ЧЁРНЫЙ ПИРИТ ГЕМАТИТ. 1s2 2s2 2p6 3s2 3p6. Краткая электронная формула. Валентные ...Водород, его общая характеристика, нахождение в природе и его свойства
Цели. сформировать знания учащихся о водороде как о атоме и простом веществе, его способах получении, свойствах и применении научить учащихся работать ...Общая характеристика реакций органических соединений
Классификация органических реакций. I. По результату реакции делят на 1) реакции замещения , S , (substitution замещение). CH4 + Cl2 CH3Cl + HCl ...Общая характеристика оксидов
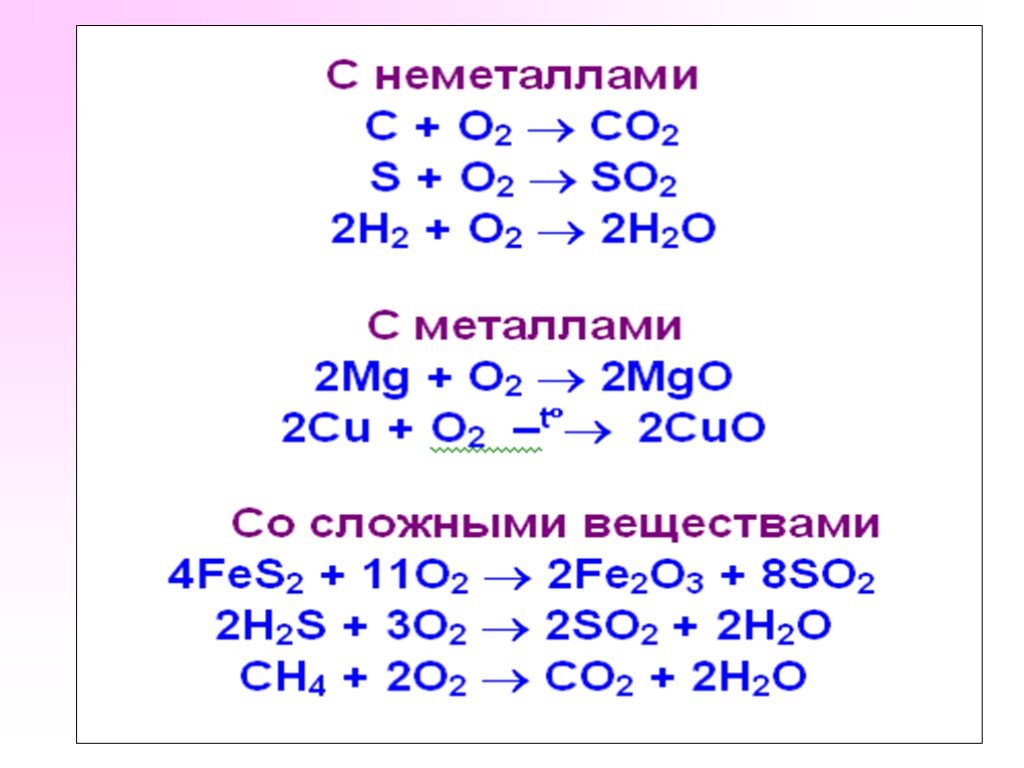
Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород. Например: CaO, SO2, Al2O3, CO. Оксиды. Оксиды – соединения элементов ...Азот. Общая характеристика
Азот – это вечный источник танталовых мук человечества, это вечные терзания голода среди океана изобилия. М.Камен (американский биохимик). Источник ...Общая характеристика металлов главных подгрупп I-III
Характеристика металлов главной подгруппы I группы. Щелочны́е мета́ллы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Эти металлы ...Общая характеристика неметаллов
Из 109 химических элементов 22 неметаллы, расположены в правом верхнем углу ПСХЭ. Неметаллы характеризуются маленькими радиусами атомов и большим ...Общая характеристика галогенов
Цели урока:. 1.Систематизировать знания учащихся о галогенах. 2.Ознакомить учащихся с окислительными свойствами галогенов. 3.Повторить, обобщить и ...Периодический закон. Периоды Периодическая система химических элементов Д.И. Менделеева. Группы
Периодический закон. Свойства химических элементов, а также образуемых ими простых и сложных веществ находится в периодической зависимости от относительных ...Общая характеристика галогенов
Цель урока:. Повторить свойства металлов и неметаллов Изучить строениеатомов, свойства галогенов на основании их сравнительной характеристики. Ответы ...Общая характеристика галогенов.
Цели: Охарактеризовать положение галогенов в Периодической системе Д.И.Менделеева. Охарактеризовать особенности строения атомов галогенов. Охарактеризовать ...Металы. Общая характеристика металлов. Физические свойства и применение металлов
Цели урока: повторить и обобщить сведения о металлической химической связи и кристаллической металлической решетке. Изучить общие физические свойства ...Конспекты
Общая характеристика элементов 1 группы, главной подгруппы
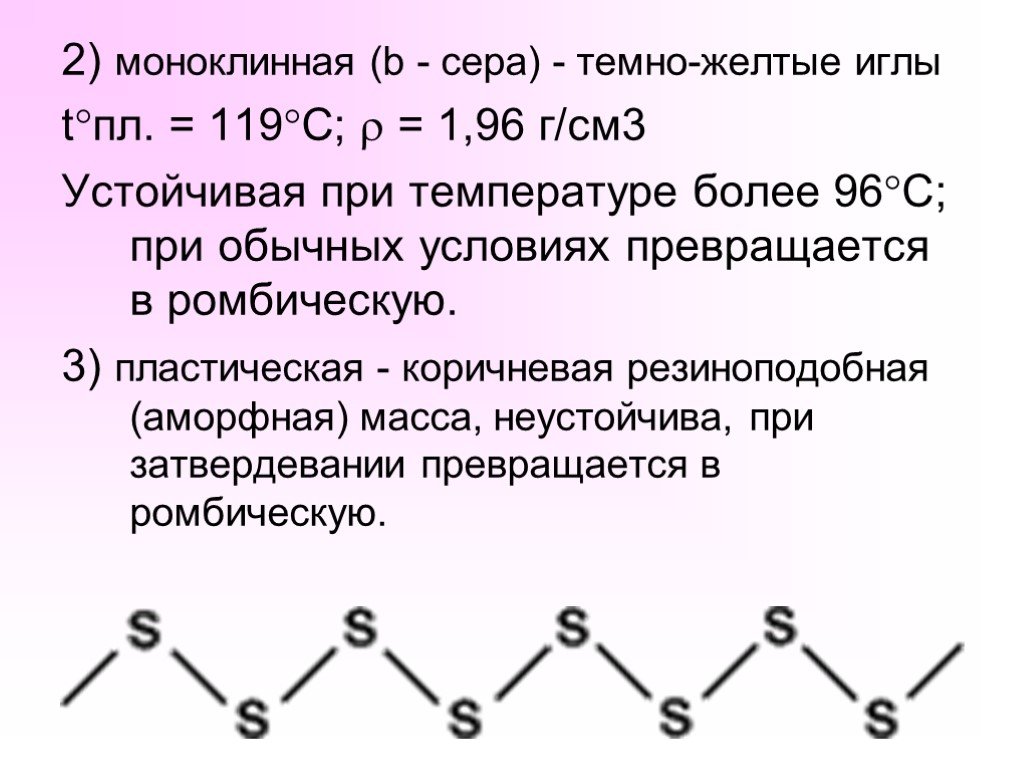
№. п/п. . Структурные элементы. . . . . Дата. . . 08.10.2014г. . . . Класс. . 9. . . . . Тема урока. . ...Общая характеристика элементов главной подгруппы VI группы. Кислород и сера.Важнейшие соединения: оксиды, кислоты и их соли
Класс: 10 , учитель: Султанова Е.А. СШ № 17 , г. Балхаш, химия. Тип урока:. комбинированный,. язык обучения. : русский. Оборудование:. флипчарт, ...Характеристика металлов II группы главной подгруппы
Тема урока:. . Характеристика металлов. II. группы главной подгруппы. Цель урока: дать характеристику металлов II. группы главной подгруппы. ...Общая характеристика кислорода
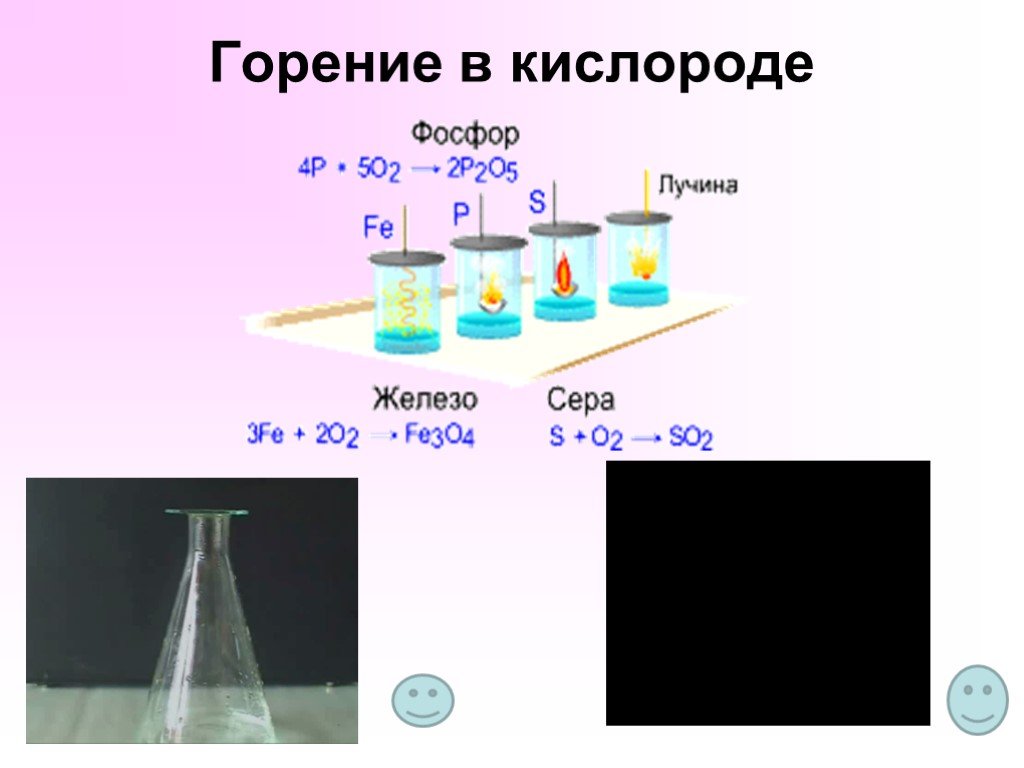
Конспект урока по химии в 8 классе. Раздел « Кислород. Оксиды. Горение». Тема урока: «Общая характеристика кислорода». Цель урока: Формировать ...Общая характеристика неметаллов. Элементы IV А группы. Углерод, кремний и их соединения
План учебного занятия № 13. Дата Предмет. химия. группа. Ф.И.О. преподавателя: Кайырбекова И.А. . І. Тема занятия:. Общая характеристика неметаллов. ...Общая характеристика неметаллов. Элементы V А группы. Важнейщие соединения азота. Фосфор и его соединения
План учебного занятия № 14. Дата Предмет. химия. группа. Ф.И.О. преподавателя: Кайырбекова И.А. . І. Тема занятия:. Общая характеристика неметаллов. ...Кислород, его общая характеристика. Нахождение в природе.Получение и свойства кислорода
Урок химии в 8 классе «Кислород, его общая характеристика. Нахождение в природе.Получение и свойства кислорода». Цель: . изучение и первичное осознание ...Галогены. Общая характристика неметаллов. Элементы VII А группы. Неорганические вещества и охрана окружающей среды
План учебного занятия № 16. Дата Предмет. химия. группа. Ф.И.О. преподавателя:. Кайырбекова И.А. . І. Тема занятия:. Галогены. Общая характристика ...Водород. Его общая характеристика, нахождение в природе и получение
14 октября 2014 года. Открытый урок химии в 9 классе разработан на основе УМК Н.С.Новошинской по технологии критического мышления. Учитель: Королева ...Общая характеристика предельных углеводородов
Министерство образования Республики Карелия. ГАПОУ РК «Сортавальский колледж». МЕТОДИЧЕСКАЯ РАЗРАБОТКА УРОКА. Общая характеристика ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:12 декабря 2018
Категория:Химия
Содержит:17 слайд(ов)
Поделись с друзьями:
Скачать презентацию