Презентация "Простые и сложные вещества" по химии – проект, доклад
Презентацию на тему "Простые и сложные вещества" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 19 слайд(ов).
Слайды презентации
Список похожих презентаций
Химические элементы. Простые и сложные вещества
Другого ничего в природе нет, Ни здесь, ни там, в космически глубинах Все – от песчинок малых до планет Из элементов состоит единых. С.Щипачев. Химический ...Простые и сложные вещества
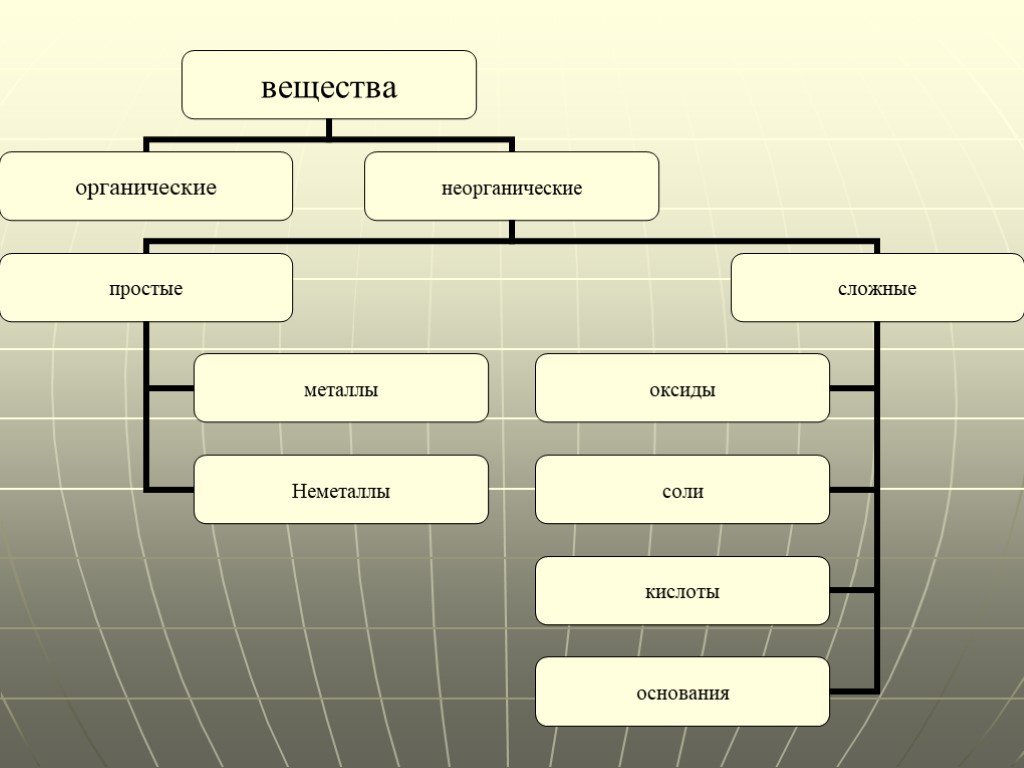
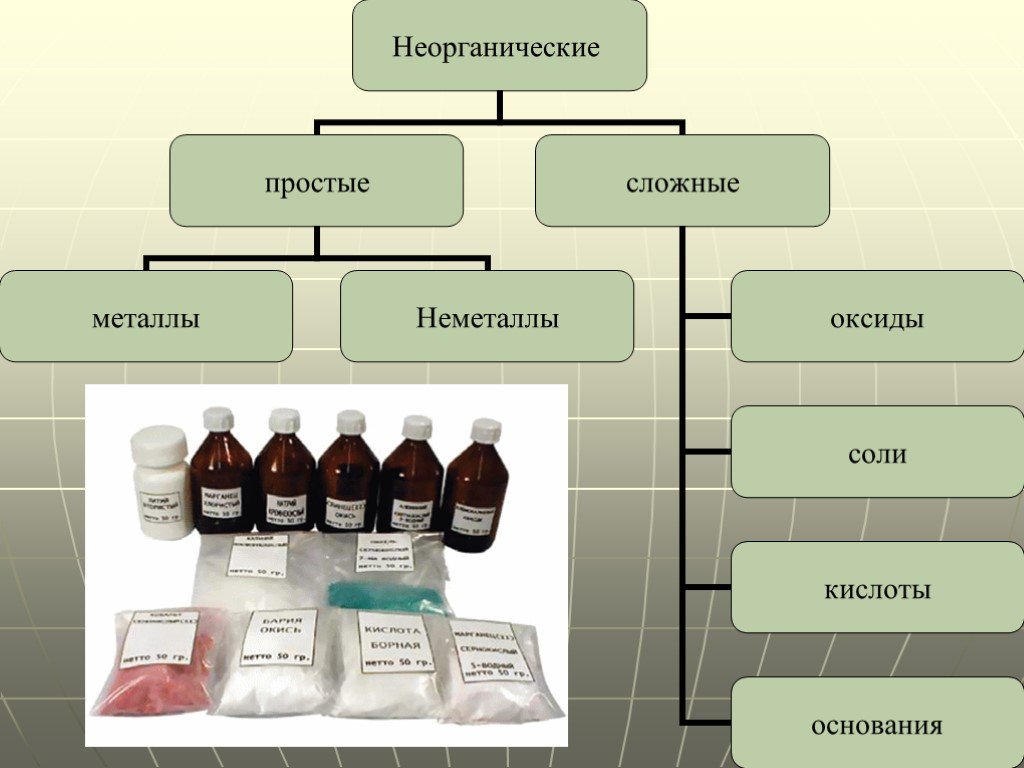
Тема урока: Простые и сложные вещества. Химические элементы существуют в виде химических соединений. химические соединения простые сложные вещества ...Вещества простые и сложные
Химический элемент- это определенный вид атома. Что понимается под символами ? Название химического элемента Один атом элемента Относительная атомная ...Сложные и простые вещества
Простые вещества можно разделить по свойствам на металлы и неметаллы. Сера, хлор, алмаз и многие другие являются представителями неметаллов. К металлам ...Металлы – простые вещества
Напишите химические знаки металлов. Свойства металлов. электропроводность. теплопроводность пластичность. Металлический блеск. ковкость. Классификация ...Простые вещества металлы
медь. серебро. ртуть. Металлы, простые вещества, обладающие в обычных условиях, характерными физическими и химическими свойствами. 1. Характерные ...Простые вещества-металлы
Задачи урока. 1.Научить определять положение металлов в периодической системе 2.Показать зависимость свойств веществ от строения атомов 3.Познакомить ...Простые вещества металлы
Цель урока:. Рассмотреть свойства металлов во взаимосвязи с областью их применения Продолжить работу по формированию интереса к предмету, расширению ...Простые вещества - неметаллы
Периодическая система химических элементов Д.И. Менделеева. Неметаллы – химические элементы, которые образуют в свободном виде простые вещества, не ...Простые вещества - неметаллы
Цели урока:. 1)Познакомить учащихся с простыми веществами – неметаллами; 2)изучить практическое значение неметаллов; 3)продолжить формирование знаний ...Простые вещества
Вопрос №1. Число твердых при обычных условиях неметаллов среди перечисленных веществ: Ne, S, Cl2, O2, I2, H2 равно: 1) 2 2) 3 3) 4 4) 6. Вопрос №2. ...Простые вещества - металлы и неметаллы
Цель урока:. Повторение основных сведений о простых веществах – металлах и неметаллах, путём выполнения различных заданий. Вопросы для обсуждения:. ...Простые вещества
Три формы существования химических элементов. В виде одиночных атомов; В составе простых веществ; В составе сложных веществ. ВЕЩЕСТВА. ПРОСТЫЕ- Состоят ...Простые вещества
Задачи урока: Развитие навыков решения задач с использованием понятия «количество вещества» Систематизация знаний по теме: «Простые вещества». Запишите ...Простые вещества: металлы и неметаллы
I Стадия «Вызова». Верите ли вы в то, что: Среди известных химических элементов большая часть – металлы? (да) Металлы бывают жидкие (да) «Оловянная ...Простые вещества
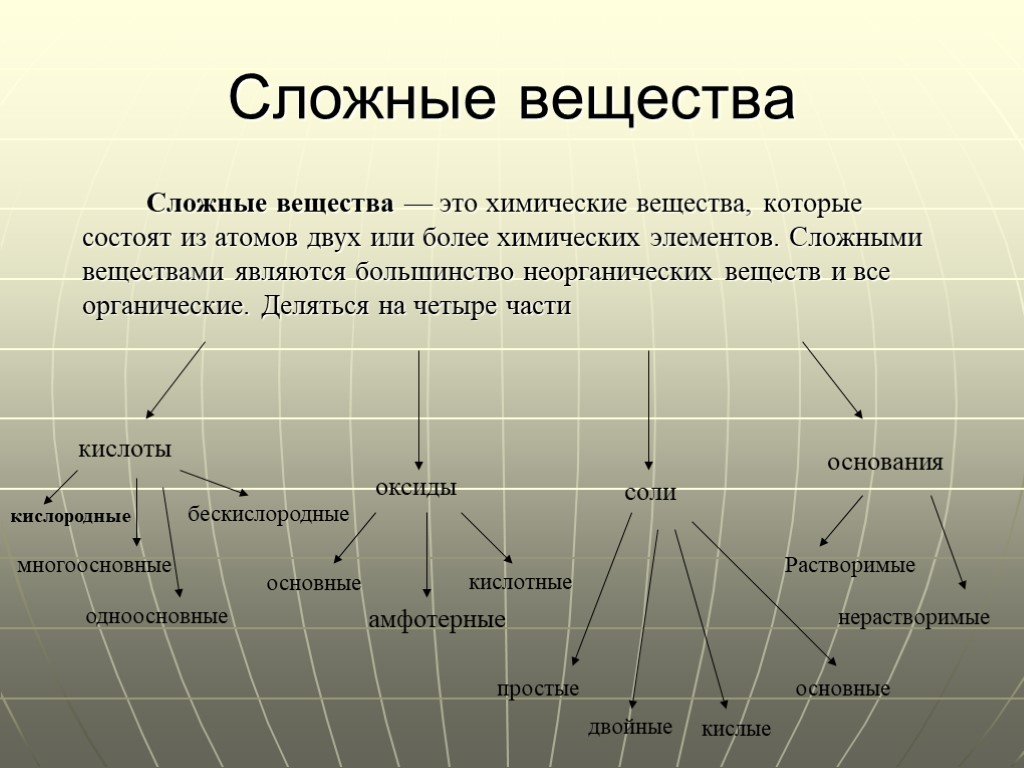
Сложные вещества Простые. Состоят из атомов одного вида. Состоят из атомов разного вида. Н2О. . Na Mg O2 Cl2. Сравните свойства простых веществ: металлов ...Сложные вещества
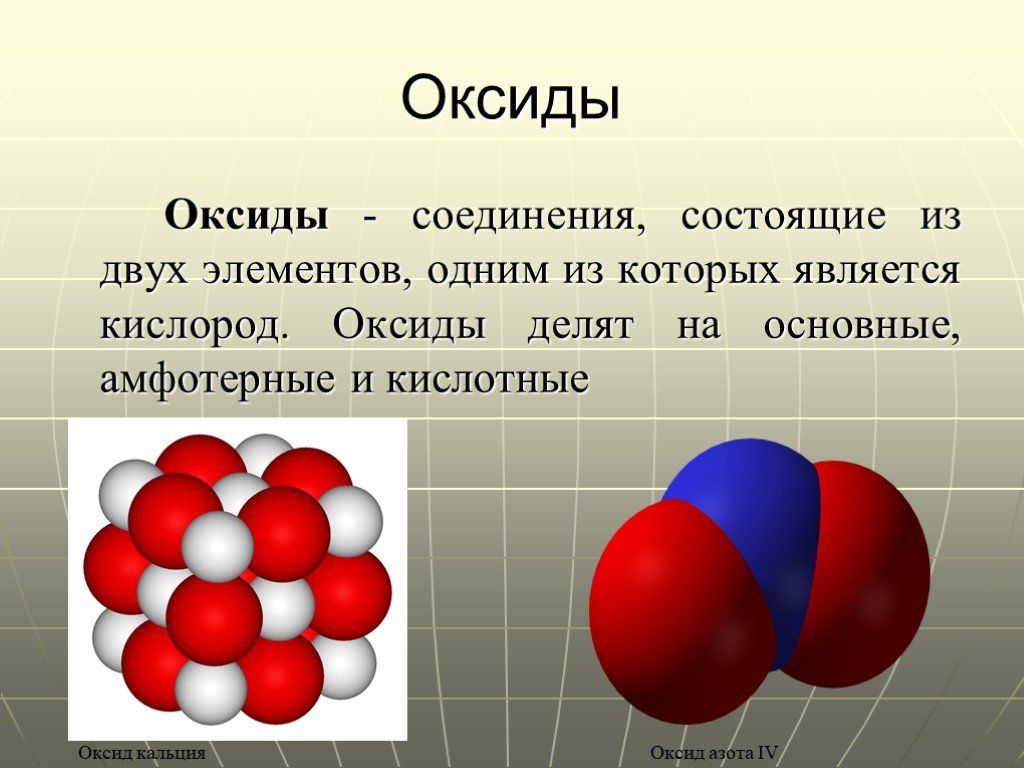
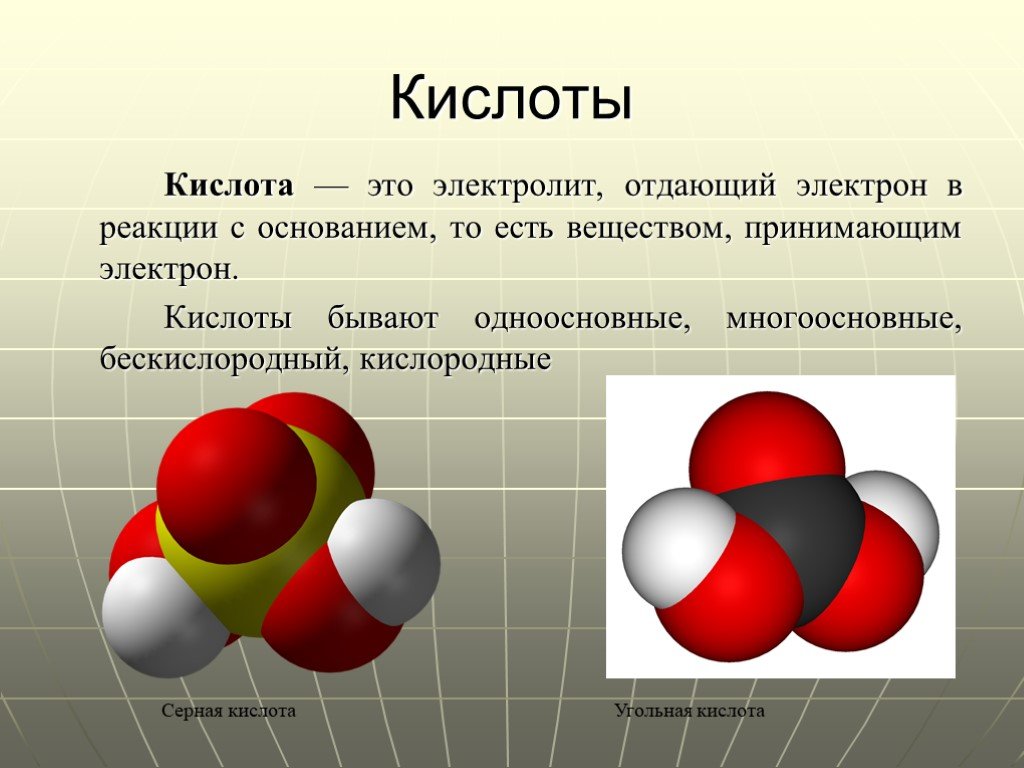
Классы неорганических соединений. Оксиды. Оксиды металлов CuO – оксид меди Fe2O3 – оксид железа Na2O – оксид натрия. Оксиды неметаллов SO3 - оксид ...«Химические вещества в повседневной жизни человека»
Цель урока. Обобщить знания о химических веществах, применяемых в повседневной жизни человека; Акцентировать внимание на экологических проблемах чистой ...Чистые вещества и смеси
ВОПРОСЫ:. Какие соединения называют оксидами? Какие соединения называют кислотами? Какие соединения называют основаниями? Какие соединения называют ...Чистые вещества и смеси
В природе практически нет чистых веществ. Чистая вода кипит при температуре 1000C и температуру замерзает при 00C. Морская вода замерзает при более ...Конспекты
Простые и сложные вещества
Отдел по управлению образованием. . Свободненского района Амурской области. МОУ Рогачёвская ООШ. Тема:. . « Простые и сложные вещества». ...Простые вещества – неметаллы
МБОУ «Клюквинская средняя общеобразовательная школа». Открытый урок. по химии в 8 классе. на тему. «Простые вещества – неметаллы». ...Простые вещества – металлы. Общие физические свойства
Простые вещества – металлы. Общие физические свойства. Кто никогда не совершал ошибок, тот никогда не пробовал что-то новое. Альберт Эйнштейн. ...Простые вещества – неметаллы
Предмет. : химия. Класс. : 8. Тема. : Простые вещества - неметаллы. Тип урока. : комбинированный. Цели урока:. I. . Образовательная. :. ...Простые вещества - неметаллы
Технологическая карта урока изучения нового материала в 8 классе по теме «. Простые вещества - неметаллы». Автор: Соловьева Е.А. Этот урок является ...Простые вещества – металлы
Нижнекамский муниципальный район. г. Нижнекамск. Муниципальное бюджетное образовательное учреждение. «Средняя общеобразовательная школа №10. ...Металлы – простые вещества с использованием ИКТ на уроке
Конспект урока химии (по программе О.С. Габриеляна) в 8 классе на тему «Металлы – простые вещества с использованием ИКТ на уроке». Автор: Карачева ...Простые вещества - металлы
7. . Методическая разработка урока по химии в 8 классе на тему. «Простые вещества - металлы». Учитель химии МБОУ “Средняя общеобразовательная ...Простые вещества - металлы
Муниципальное казенное образовательное учреждение. . «Куйбышевская средняя общеобразовательная школа». . Среднеахтубинского района Волгоградской ...Металлы – простые вещества
Урок химии в 8 классе по теме. «Металлы – простые вещества». Задачи:. . Образовательные:. Сформировать у учащихся знания о том, что металлам ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:21 ноября 2018
Категория:Химия
Содержит:19 слайд(ов)
Поделись с друзьями:
Скачать презентацию