Презентация "Сложные вещества" (9 класс) по химии – проект, доклад
Презентацию на тему "Сложные вещества" (9 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 12 слайд(ов).
Слайды презентации
Список похожих презентаций
Простые и сложные вещества
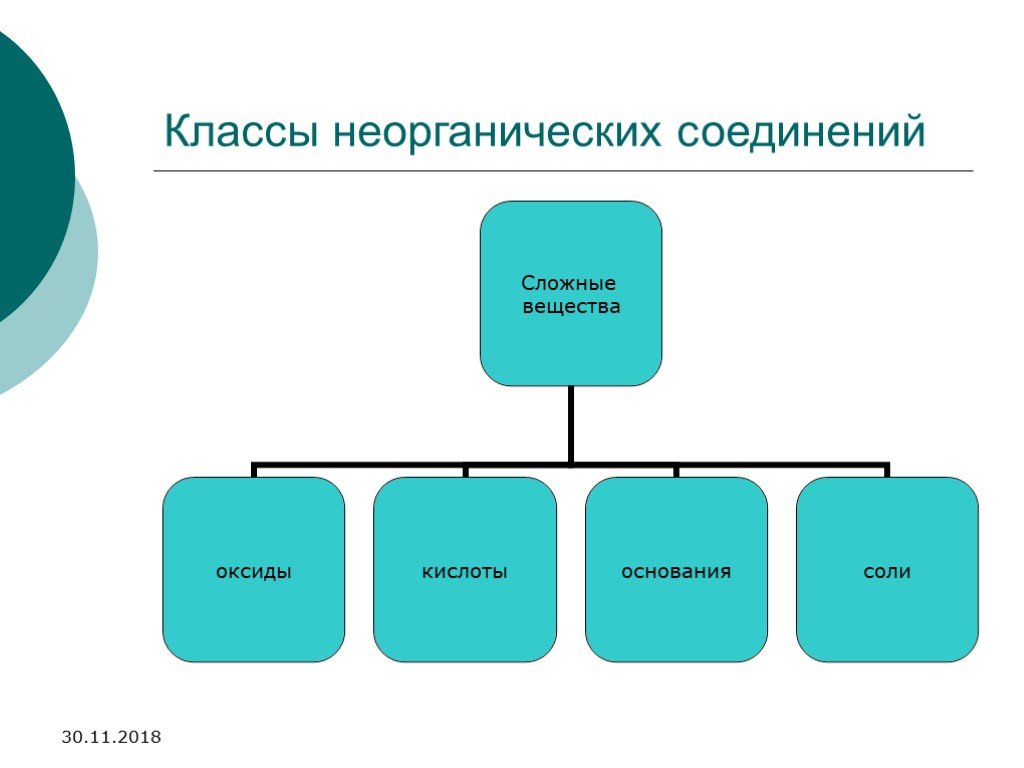
Содержание. Вещества Неорганические соединения Классификация неорганических соединений Простые вещества Металлы Неметаллы Аллотропия Агрегатное состояние ...Сложные и простые вещества
Простые вещества можно разделить по свойствам на металлы и неметаллы. Сера, хлор, алмаз и многие другие являются представителями неметаллов. К металлам ...Химические элементы. Простые и сложные вещества
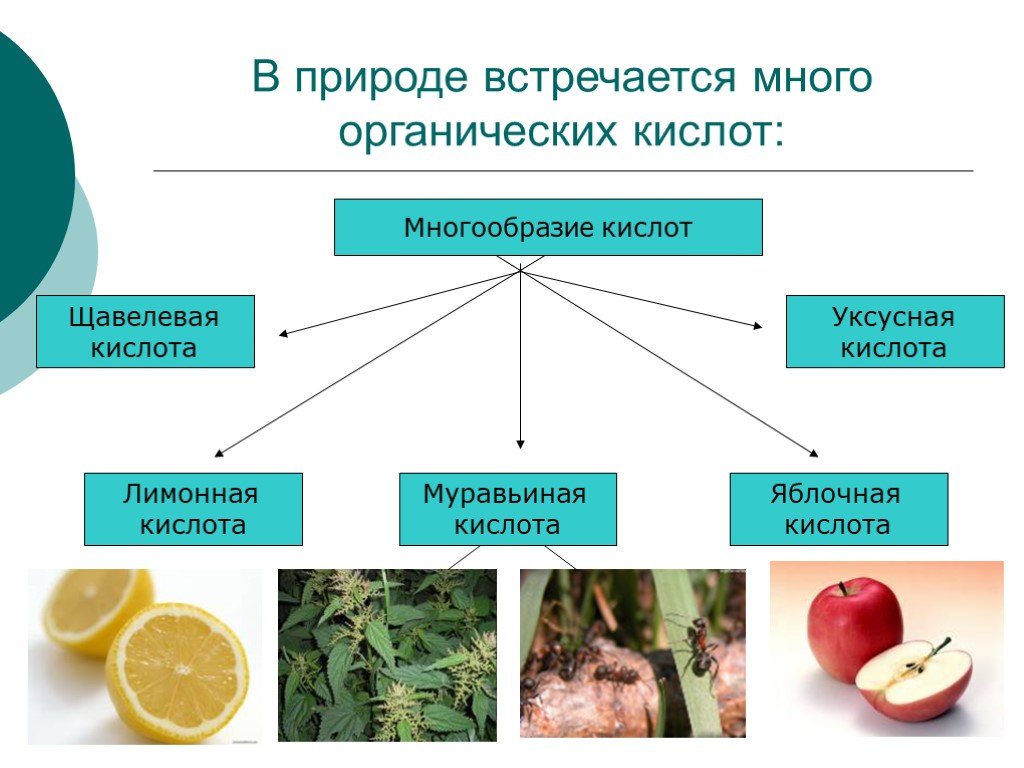
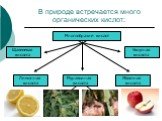
Другого ничего в природе нет, Ни здесь, ни там, в космически глубинах Все – от песчинок малых до планет Из элементов состоит единых. С.Щипачев. Химический ...Простые и сложные вещества
Тема урока: Простые и сложные вещества. Химические элементы существуют в виде химических соединений. химические соединения простые сложные вещества ...Создание и использование комплекса моделей атомов и молекул для изучения строения вещества в курсе химии средней школы
Обзор содержания курса химии 8-11 классов. . . . Классификация моделей. Материальные Идеальные Статические Динамические Раздаточные Демонстрационные ...Сложные эфиры
Номенклатура спиртов. Название предельного углеводорода, содержащего столько же атомов углерода, что и молекула спирта + окончание «ОЛ» с указанием ...Сложные эфиры. Жиры
План урока. Реакция этерификации. Сложные эфиры. Жиры. Роль жиров в жизнедеятельности. Д/З: с.219 – 220; § 37, В.1. 1. Реакция этерификации. Для карбоновых ...Простые вещества металлы
медь. серебро. ртуть. Металлы, простые вещества, обладающие в обычных условиях, характерными физическими и химическими свойствами. 1. Характерные ...Агрегатное состояние вещества
Общие понятия. Агрегатное состояние вещества- состояние вещества, характеризующееся определенными качественными свойствами. Строение твердых тел. ...Химические вещества в архитектуре города Минусинска
Цели:. показать влияние развития науки химии на архитектуру городов на примере г. Минусинска исследовать химический состав материалов, применяемых ...Агрегатное состояние вещества
Твердое тело. Состояние, характеризующееся способностью сохранять объём и форму. Атомы твёрдого тела совершают лишь небольшие колебания вокруг состояния ...Где прячутся взрывчатые вещества
Последнее время в мире всё чаще происходят взрывы и пожары. Причин этому несколько. Одна из них связана с растущим числом химических веществ, используемых ...Движение частиц вещества
Солнечная система Солнце Атмосфера Метеорит Вещество Деформация Упругость Пластичность. Понятийная разминка. Тело, вещество, состояние, превращение, ...Газообразное состояние вещества
Цели урока:. Рассмотреть особенности газообразных веществ. Выделить важнейшие природные смеси газов. Обозначить основные экологические проблемы атмосферы. ...Газообразные вещества
Рис.1. Агрегатные состояния воды: а – твёрдое; б – жидкое; в - газообразное. Большинство веществ в зависимости от условий могут находиться в одном ...Вычисления массовой доли растворенного вещества
. Задачи ЕГЭ.1. Массовая доля серной кислоты в растворе, полученном при смешивании 120г 20 %-го и 40г 50 %-го растворов кислоты, равна ……...% (Запишите ...
Агрегатные состояния вещества
План урока. Определение целей урока Выполнение лабораторного исследования Определение основных следствий эксперимента Решение качественных задач Решение ...Агрегатные состояния вещества
1. Учение об агрегатных состояниях 1.3. Жидкое состояние вещества. 1.3.1. Основные понятия Жидкое агрегатное состояние является промежуточным между ...Строение вещества химия
СТРОЕНИЕ ВЕЩЕСТВА. Основополагающий вопрос КАК УСТРОЕН МИР? Проблемные вопросы Из чего сделано все на Земле? Почему все устроено так, а не иначе? ...Чистые вещества и смеси
Цели урока:. Выяснить, какое вещество считают чистым. Что такое смесь? Какие бывают смеси? Выяснить различия между смесью и химическим соединением. ...Конспекты
Простые и сложные вещества
Отдел по управлению образованием. . Свободненского района Амурской области. МОУ Рогачёвская ООШ. Тема:. . « Простые и сложные вещества». ...Сложные эфиры
Урок по теме "Сложные эфиры". Цель урока:. . . Образовательные:. дать учащимся понятие о составе и строении сложных эфиров; отработать умение ...Решение расчетных задач на вывод химической формулы органического вещества
Муниципальное бюджетное общеобразовательное учреждение. «Средняя общеобразовательная школа №55» г. Брянска. Урок по теме:. «Решение ...Чистые вещества и смеси. Способы разделения смесей. Массовая доля вещества в смеси
Урок 38 / 8 « Чистые вещества и смеси. Способы разделения смесей. Массовая доля вещества в смеси». ( 8 класс – базовый уровень). Учитель:. . Дронова ...Чистые вещества и смеси. Способы разделения смесей
МОУ «Украинская СОШ». Омская облсть, Исилькульский район, с.Украинка. Тема урока:. «. Чистые вещества и смеси. . . Способы разделения ...Чистые вещества и смеси
Тема урока. : «Чистые вещества и смеси».8кл. Учитель химии Соколова Е.Н. МБОУ СОШ №17 г.Нижневартовск Тюменской области. Ведущая идея урока:. . ...Химическая организация клетки. Неорганические вещества
Тема: «Химическая организация клетки. Неорганические вещества». Цели урока:. Образовательные. : сформировать знания о роли химических элементов, ...Сложные эфиры. Жиры
СЦЕНАРИЙ УРОКА ХИМИИ В 9 КЛАССЕ. по теме: «Сложные эфиры. Жиры». Петухова Юлия Валентиновна,. учитель химии и биологии МБОУ СОШ с. Георгиевка. ...Металлы – простые вещества с использованием ИКТ на уроке
Конспект урока химии (по программе О.С. Габриеляна) в 8 классе на тему «Металлы – простые вещества с использованием ИКТ на уроке». Автор: Карачева ...Металлы – простые вещества
Урок химии в 8 классе по теме. «Металлы – простые вещества». Задачи:. . Образовательные:. Сформировать у учащихся знания о том, что металлам ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:1 декабря 2018
Категория:Химия
Содержит:12 слайд(ов)
Поделись с друзьями:
Скачать презентацию