Презентация "Газообразные вещества" по химии – проект, доклад
Презентацию на тему "Газообразные вещества" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 20 слайд(ов).
Слайды презентации
Список похожих презентаций
Простые и сложные вещества
Тема урока: Простые и сложные вещества. Химические элементы существуют в виде химических соединений. химические соединения простые сложные вещества ...Создание и использование комплекса моделей атомов и молекул для изучения строения вещества в курсе химии средней школы
Обзор содержания курса химии 8-11 классов. . . . Классификация моделей. Материальные Идеальные Статические Динамические Раздаточные Демонстрационные ...Простые вещества
Три формы существования химических элементов. В виде одиночных атомов; В составе простых веществ; В составе сложных веществ. ВЕЩЕСТВА. ПРОСТЫЕ- Состоят ...Простые вещества - неметаллы
Периодическая система химических элементов Д.И. Менделеева. Неметаллы – химические элементы, которые образуют в свободном виде простые вещества, не ...Чистые вещества и смеси
Цели урока:. Выяснить, какое вещество считают чистым. Что такое смесь? Какие бывают смеси? Выяснить различия между смесью и химическим соединением. ...Отравляющие вещества
Содержание:. Цели и задачи Определение ОВ Что такое ОВ? История появления Женевский протокол Боевые свойства ОВ Типы несмертельных отравляющих веществ ...Агрегатные состояния вещества
План урока. Определение целей урока Выполнение лабораторного исследования Определение основных следствий эксперимента Решение качественных задач Решение ...Химические вещества в архитектуре города Минусинска
Цели:. показать влияние развития науки химии на архитектуру городов на примере г. Минусинска исследовать химический состав материалов, применяемых ...Агрегатное состояние вещества
Твердое тело. Состояние, характеризующееся способностью сохранять объём и форму. Атомы твёрдого тела совершают лишь небольшие колебания вокруг состояния ...Агрегатные состояния вещества
1. Учение об агрегатных состояниях 1.3. Жидкое состояние вещества. 1.3.1. Основные понятия Жидкое агрегатное состояние является промежуточным между ...Агрегатное состояние вещества
Существуют 3 основных агрегатных состояния вещества. Газообразное Твердое Жидкое. Чем же различаются данные вещества. Агрегатное состояние. Различия. ...Агрегатное состояние вещества
Общие понятия. Агрегатное состояние вещества- состояние вещества, характеризующееся определенными качественными свойствами. Строение твердых тел. ...Агрегатное состояние вещества
Три состояния вещества. Газ Жидкость Твердое тело. Твердое. Жидкое. Газообразное состояние. Процессы с поглощением и выделением тепла. Плавление Парообразование ...Строение вещества химия
СТРОЕНИЕ ВЕЩЕСТВА. Основополагающий вопрос КАК УСТРОЕН МИР? Проблемные вопросы Из чего сделано все на Земле? Почему все устроено так, а не иначе? ...Вычисления массовой доли растворенного вещества
. Задачи ЕГЭ.1. Массовая доля серной кислоты в растворе, полученном при смешивании 120г 20 %-го и 40г 50 %-го растворов кислоты, равна ……...% (Запишите ...
Удивительные органические вещества
Задача от мисс Марпл. Какое приспособление использовал злоумышленник ? И какое вещество помогло ему разрезать сталь? А.Блок. Взгляд обольстительной ...Газообразное состояние вещества
Цели урока:. Рассмотреть особенности газообразных веществ. Выделить важнейшие природные смеси газов. Обозначить основные экологические проблемы атмосферы. ...Химические элементы. Простые и сложные вещества
Другого ничего в природе нет, Ни здесь, ни там, в космически глубинах Все – от песчинок малых до планет Из элементов состоит единых. С.Щипачев. Химический ...Где прячутся взрывчатые вещества
Последнее время в мире всё чаще происходят взрывы и пожары. Причин этому несколько. Одна из них связана с растущим числом химических веществ, используемых ...Чистые вещества и смеси веществ
П л а н у р о к а. 1. Чистые вещества и смеси. Отличительные особенности. 2. Однородные и неоднородные смеси. 3. Способы разделения смесей. Что такое ...Конспекты
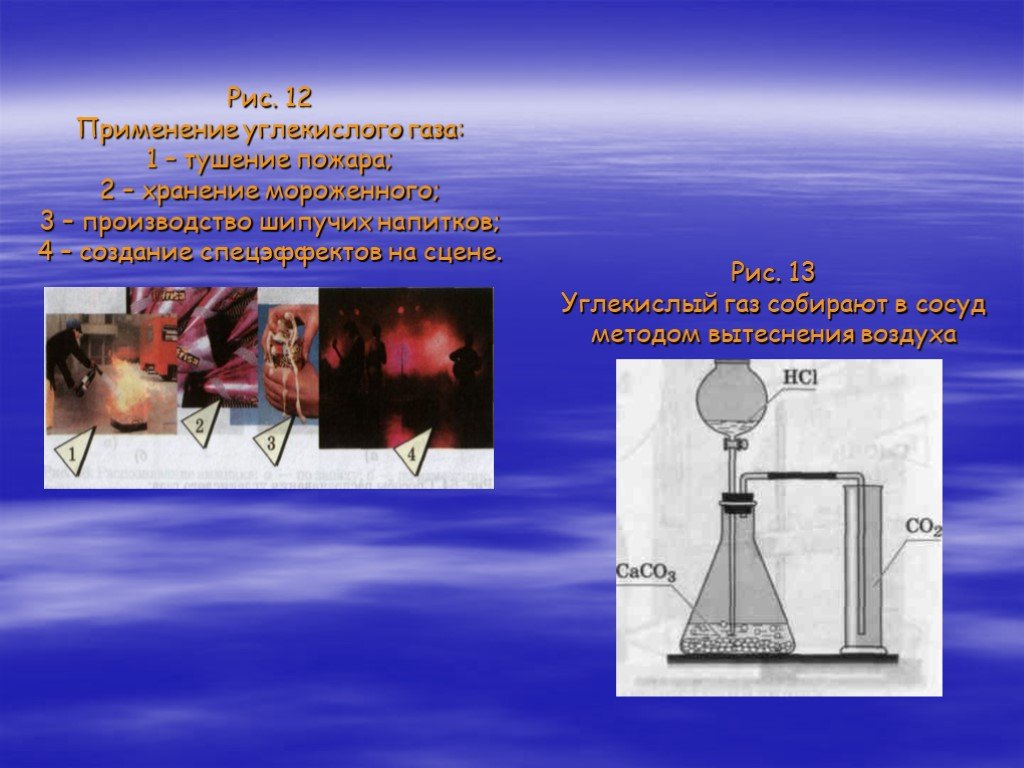
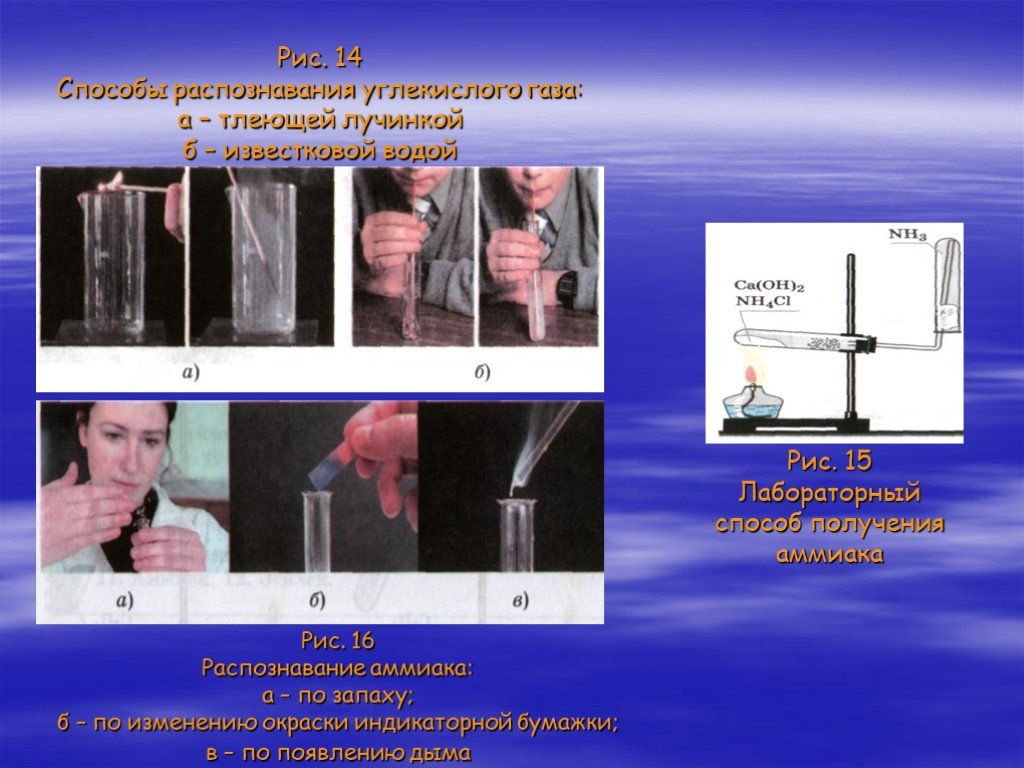
Газообразные вещества
Тема урока:. Газообразные вещества. Место урока:. Урок. . 9. Тема 2 «Строение веществ». 11 класс. Базовый уровень. Цели урока:. актуализировать ...Химическая организация клетки. Неорганические вещества
Тема: «Химическая организация клетки. Неорганические вещества». Цели урока:. Образовательные. : сформировать знания о роли химических элементов, ...Решение расчетных задач на вывод химической формулы органического вещества
Муниципальное бюджетное общеобразовательное учреждение. «Средняя общеобразовательная школа №55» г. Брянска. Урок по теме:. «Решение ...Решение задач на определение молекулярной формулы вещества
Муниципальное бюджетное общеобразовательное учреждение. «Средняя общеобразовательная школа №17» г. Брянска. Урок на тему: «Решение задач ...Растворы. Вычисление массовой доли растворённого вещества в растворе
Муниципальное бюджетное общеобразовательное учреждение. . «Средняя общеобразовательная школа №1». Технологическая карта урока по теме. ...Алюминий. Строение атома, физические и химические свойства простого вещества
ПЛАН-КОНСПЕКТ УРОКА. Тема: Алюминий. Строение атома, физические и химические свойства простого вещества. . . ФИО (полностью). . Иванова ...Чистые вещества и смеси. Способы разделения смесей
Урок химии в 8 классе. Тема: Чистые вещества и смеси. . Способы разделения смесей. Урок разработан на основе программы курса для 8 класса общеобразовательных ...Чистые вещества и смеси
8 класс. Тема урока:. Чистые вещества и смеси. Цели урока:. дать понятие о чистом веществе и смеси веществ; раскрыть значение смесей в природе ...Металлы – простые вещества с использованием ИКТ на уроке
Конспект урока химии (по программе О.С. Габриеляна) в 8 классе на тему «Металлы – простые вещества с использованием ИКТ на уроке». Автор: Карачева ...Металлы – простые вещества
Урок химии в 8 классе по теме. «Металлы – простые вещества». Задачи:. . Образовательные:. Сформировать у учащихся знания о том, что металлам ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:8 ноября 2018
Категория:Химия
Содержит:20 слайд(ов)
Поделись с друзьями:
Скачать презентацию