Презентация "Коррозия металлов" (9 класс) по химии – проект, доклад
Презентацию на тему "Коррозия металлов" (9 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 15 слайд(ов).
Слайды презентации
Список похожих презентаций
Коррозия металлов
Зачем нужны металлы? Что вы узнаете (план изучения темы). Физические свойства металлов. Химические свойства металлов. Mеталлы в нашей жизни. Металлическая ...Коррозия металлов
Коррозия – рыжая крыса, Грызет металлический лом. В Шефнер. - называют самопроизвольное разрушение металлов и сплавов под влиянием окружающей среды ...Коррозия металлов
Коррозия – от лат. corrodere - разъедать. Ежегодно 1/4 всего произведенного Fe теряется из-за коррозии. Химически чистое железо не ржавеет, т.к. не ...Коррозия металлов
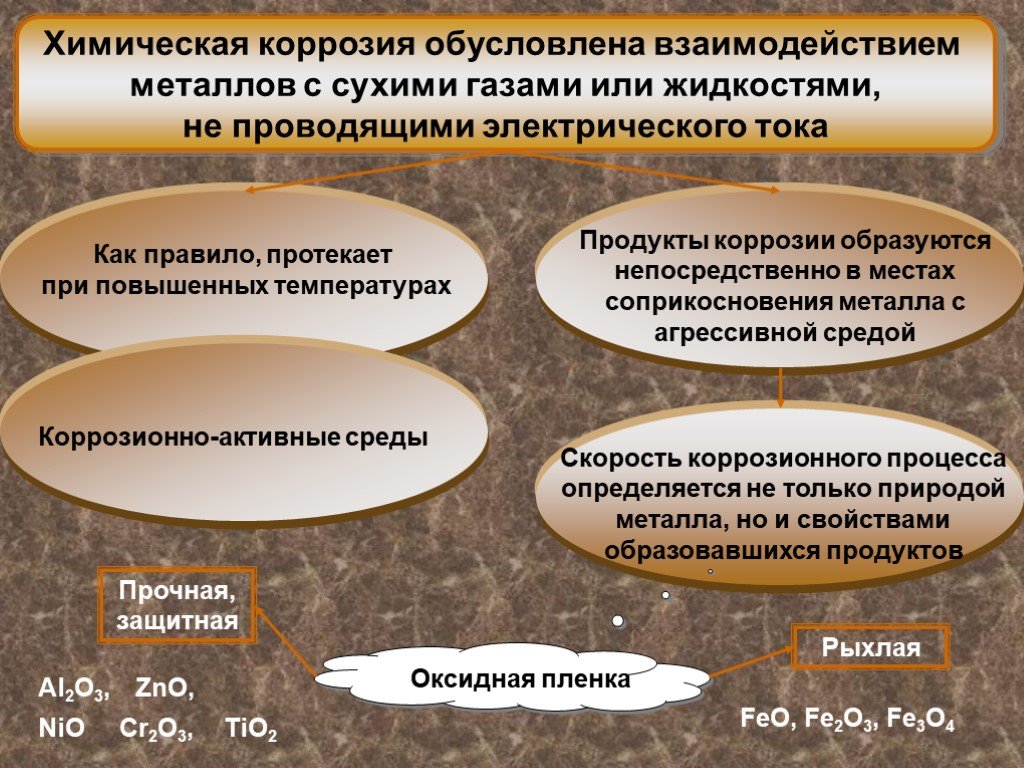
«Ржа ест железо». . По виду коррозионной среды. газовая; жидкостная: - кислотная, щелочная, - солевая; атмосферная; почвенная. По характеру разрушения. ...Коррозия металлов и её виды
Коррозия - это процесс самопроизвольного разрушения металлов и сплавов под влиянием факторов внешней среды. Закладка эксперимента. Лабораторный опыт ...Коррозия металлов
Цель. Исследовать действие факторов окружающей среды на степень ржавления металлов. Гипотеза Если поместить железо в щелочную среду, то скорость коррозии ...Коррозия металлов и способы ее устранения
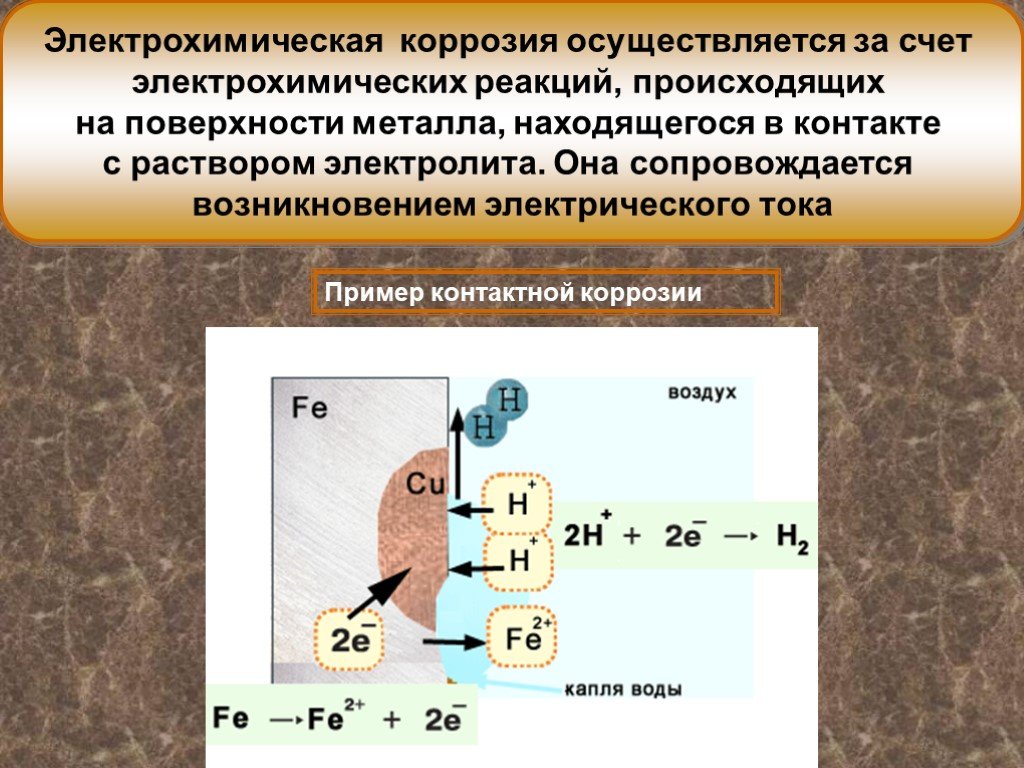
Коррозия (от лат. сorrodere – «разъедать») – химическое и электрохимическое разрушение металлов и их сплавов в результате воздействия на них окружающей ...Металлы и коррозия металлов
Рецензия на научную исследовательскую работу «Металлы и коррозия металлов». Интерес данной работы заключается в том, что тема работы носит познавательное, ...Коррозия железа в различных средах
Цель проекта. изучить процесс коррозии металлов в различных средах на примере железа. Задачи. Изучить литературу и другие источники информации по ...Сплавы металлов
Сплавы – это материалы с характерными свойствами, состоящие из двух или более компонентов, из которых по крайней мере один – металл. СПЛАВЫ. однородные ...Горение металлов
Свойства летучих горючих металлов и их оксидов. На способность металлов возгораться и гореть большое влияние оказывают химические и физические свойства ...Получение металлов
Металлы в природе. Самородные металлы (золото, серебро, медь, платина ). Минералы (красный железняк, цинковая обманка, галенит, киноварь и т.д.). ...Характеристика щелочных металлов
Металлы Сu, Au, Ag не взаимодействуют с водой даже при нагревании. Металлы обладают электропроводностью и теплопроводностью. Для металлов характерна ...Химические свойства металлов
По своим химическим свойствам все металлы являются восстановителями, все они сравнительно легко отдают валентные электроны, переходят в положительно ...Изучение коррозии и защиты металлов
Цель. Изучение проблемы коррозии металлов и исследование коррозийной стойкости металлов и способов их защиты. Задачи. изучить литературу по теме исследований; ...Способы получения металлов
Металлургия. Металлургия – наука о промышленных способах получения металлов из природного сырья. Металлургия делится на три отрасли: пирометаллургию, ...История металлов
Цель:. Рассказать об открытии металлов. Гипотеза:. Возможно открытие металлов никак не повлияло на развитие цивилизаций. Медь. История цивилизаций ...Изучение свойств оксидов металлов
Цель: определить характер оксидов металлов, имеющихся в школьной лаборатории (оксиды бария, железа, кальция, меди, свинца), изучить их свойства. Задачи: ...Качественные реакции на ионы металлов
Проблемный вопрос: каким образом можно определить ионы металлов в растворах. Цель работы: научиться определять ионы металлов Задачи: расширить знания ...Коррозия
ПЛАН УРОКА. Понятие коррозии Значение коррозии Виды коррозии Условия, способствующие коррозии Химизм процесса коррозии Способы защиты от коррозии. ...Конспекты
Коррозия металлов и сплавов как результат и фактор загрязнения окружающей среды, меры по предупреждению коррозии
Коррозия металлов и сплавов как результат и фактор загрязнения окружающей среды, меры по предупреждению коррозии. Цели:. сформировать представление ...Коррозия металлов и способы защиты от нее
Урок № 37 9 кл. Тема: Коррозия металлов и способы защиты от нее. Цель: сформировать понятие о коррозии металлов, рассмотреть классификацию коррозионных ...Коррозия металлов
Класс:. 9. Дата:. Тема урока:. Коррозия металлов и борьба с ней. Цель урока:. . формирование у учащихся представление о коррозии металлов и ...Коррозия металлов
Конспект урока на тему: «Коррозия металлов». 11 класс. «Коррозия – рыжая крыса,. Грызет металлический лом». В. Шефнер. Цели урока. :. - познакомить ...Химические свойства металлов
. Тема урока. Химические свойства металлов. . Класс. . 11. . . Тип урока. . Изучение и первичное закрепление нового материала. ...Химические свойства металлов
Разработка урока по химии в 9-м классе по теме: "Химические свойства металлов". . Бодыкова Гульшат Зулхарнаевна. учитель. ница. химии. . . ...Характеристика щелочных металлов
Тема урока: Характеристика щелочных металлов. Цель урока:. . дать общую характеристику щелочных металлов по положению в периодической таблице ...Способы получения металлов
Разработка урока для учащихся 10 класса. Тема урока. «Способы получения металлов». Цель урока:. . Рассмотреть запасы природных соединений металлов ...Роль металлов и их соединений в природной среде и в живых организмах
Дата. . . Предмет химия. . Класс 9 Урок 45. . . . Название занятия. . . Роль металлов и их соединений в природной среде. и в живых ...Практическая работа № 1 Получение и свойства соединений металлов
Лысоконь Ирина Алексеевна. МБОУ СОШ № 2 ст. Архонская Пригородного района РСО-Алания. Учитель химии. Тема урока: Практическая работа № 1 Получение ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:8 ноября 2018
Категория:Химия
Содержит:15 слайд(ов)
Поделись с друзьями:
Скачать презентацию