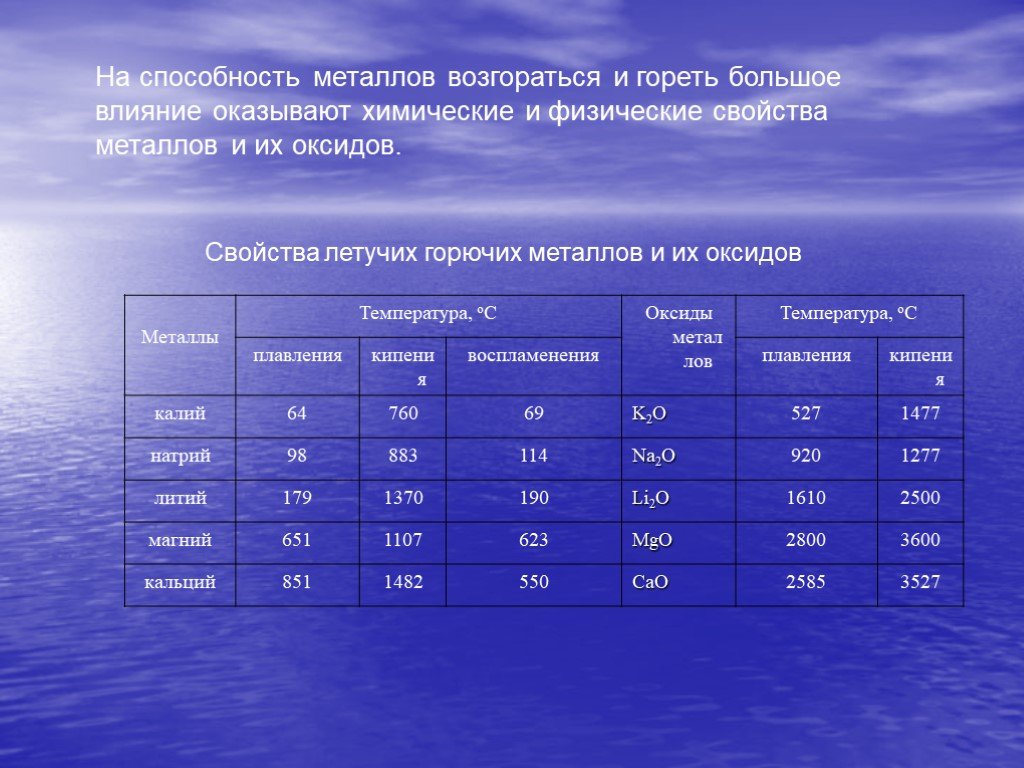
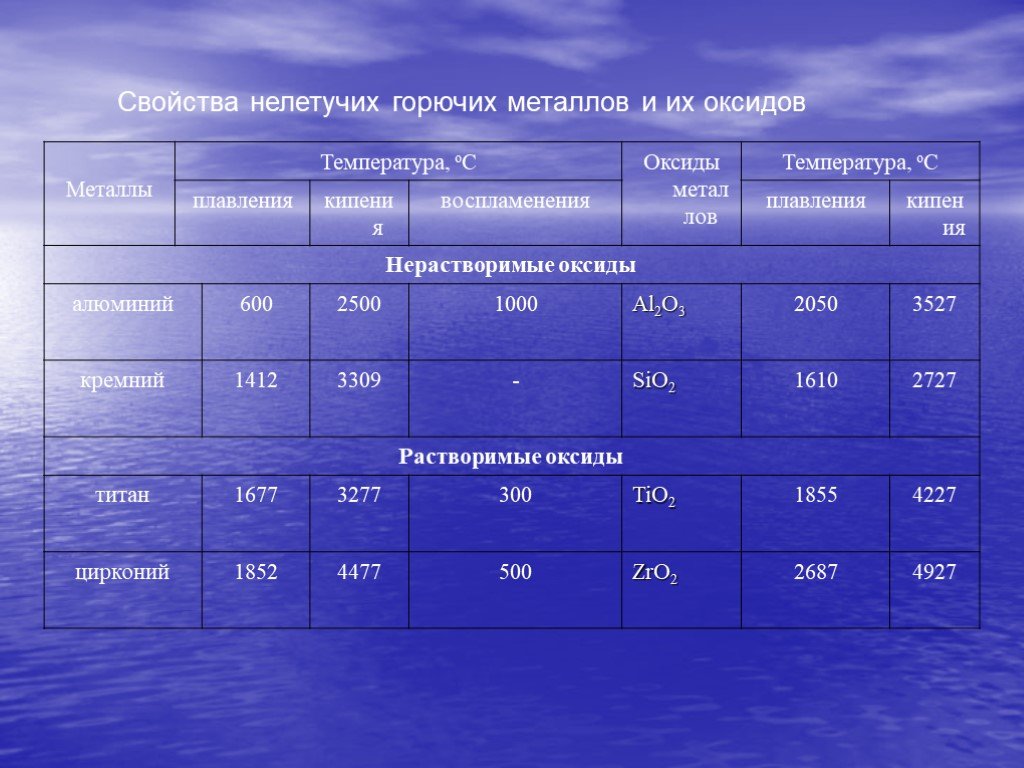
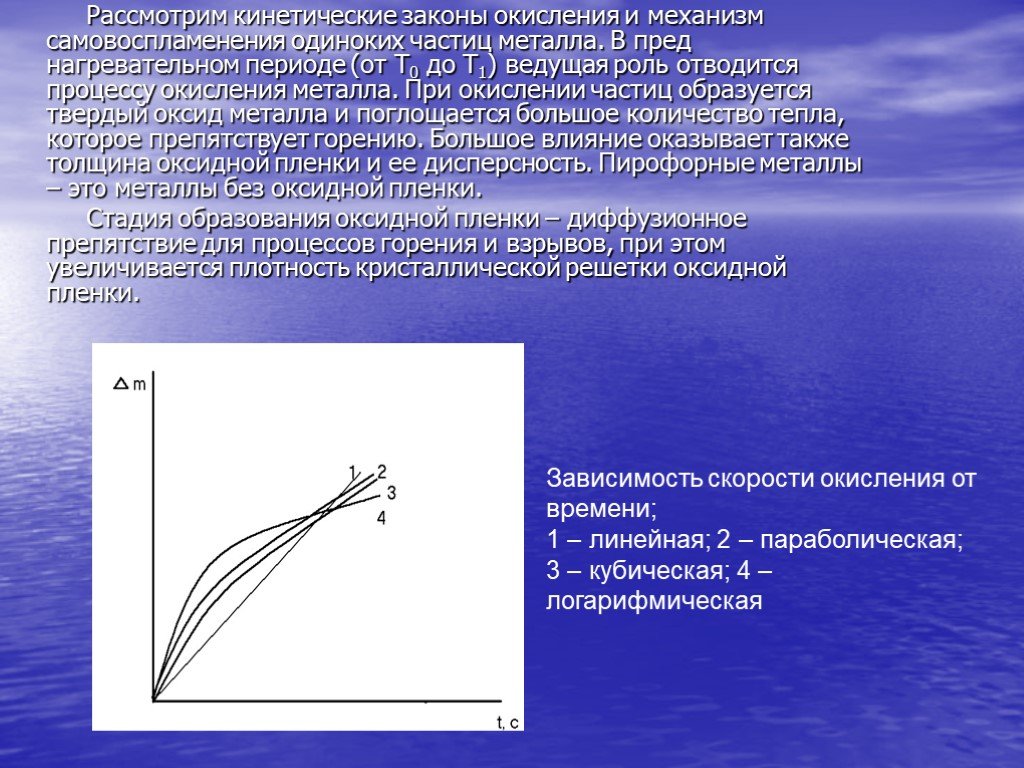
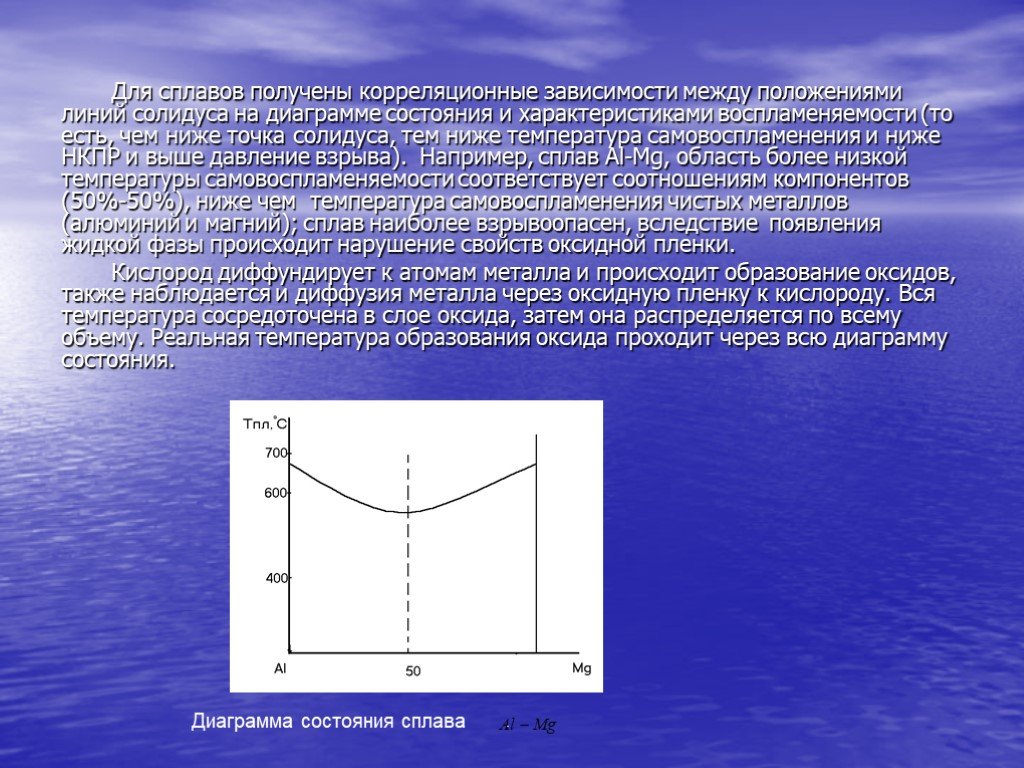
Презентация "Горение металлов" по химии – проект, доклад
Презентацию на тему "Горение металлов" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 11 слайд(ов).
Слайды презентации
Список похожих презентаций
Электронная проводимость металлов
Лекция 13. Тема: Классическая теория электропроводности металлов. 13.1.Классическое представление об электропроводности металлов. Экспериментальные ...Физические свойства металлов
Модель строения атома. «Крестики-нолики». Na Fe B He F Al Ca Ba C Li Na Ca P Al F P Cu N. Цель урока:. изучить общие физические свойства металлов, ...Химические свойства металлов
Цель урока:. обобщить знание учащихся, полученные ранее при рассмотрении общих химических свойств металлов; повторить особенности протекания реакций ...Сплавы металлов
Для производства брони используется широкий спектр конструкционных материалов, обладающих необходимыми механическими свойствами, главными из которых ...Способы получения металлов
Электрометаллургический способ. Электрометаллургия методы получения металлов, основанные на выделении металлов из растворов или расплавов их соединений ...Руды чёрных и цветных металлов
Цель:. Собрать материал о руде черных и цветных металлов. Задачи:. Ознакомится с учебным материалом; Изучить дополнительную литературу по данной теме; ...Соединения щелочноземельных металлов
Соединения щелочноземельных металлов. Тип и класс веществ. Физические свойства. Химические свойства. Оксиды щелочноземельных металлов. . 15.03.2019. ...Качественные реакции на ионы металлов
Проблемный вопрос: каким образом можно определить ионы металлов в растворах. Цель работы: научиться определять ионы металлов Задачи: расширить знания ...Коррозия металлов
Цель. Исследовать действие факторов окружающей среды на степень ржавления металлов. Гипотеза Если поместить железо в щелочную среду, то скорость коррозии ...Изучение свойств оксидов металлов
Цель: определить характер оксидов металлов, имеющихся в школьной лаборатории (оксиды бария, железа, кальция, меди, свинца), изучить их свойства. Задачи: ...История металлов
Цель:. Рассказать об открытии металлов. Гипотеза:. Возможно открытие металлов никак не повлияло на развитие цивилизаций. Медь. История цивилизаций ...Изучение коррозии и защиты металлов
Цель. Изучение проблемы коррозии металлов и исследование коррозийной стойкости металлов и способов их защиты. Задачи. изучить литературу по теме исследований; ...Грозит ли миру военный конфликт из-за металлов?
Плотность металлов. Металлы Лёгкие ρ5 гр/см3. Вся авиационная техника построена на основе сплавов лёгких металлов. Ртуть плотность - 14,19 г/см3. ...Горение кислорода
1. Элемент № 8 2. Oxygenium - Кислород 3. Джозеф Пристли 4. Карл Вильгельм Шееле 5. Антуан Лоран Лавуазье 6. Корнелиус Дреббел 7. Распространение ...Понятие металлов
Урок "Обобщение и закрепление материала по теме: "Металлы". Цели урока:. Повторить и закрепить все основные понятия по теме: «Металлы» с помощью разноплановых ...Коррозия металлов
Коррозия – рыжая крыса, Грызет металлический лом. В Шефнер. - называют самопроизвольное разрушение металлов и сплавов под влиянием окружающей среды ...Реакция тяжелых металлов в почве
К числу тяжелых металлов относят хром, марганец, железо, кобальт, никель, медь, цинк, галлий, германий, молибден, кадмий, олово, сурьму, теллур, вольфрам, ...Коррозия металлов
Зачем нужны металлы? Что вы узнаете (план изучения темы). Физические свойства металлов. Химические свойства металлов. Mеталлы в нашей жизни. Металлическая ...Свойства металлов и сплавов
Курс предназначен для студентов института Энергомашиностроения и Механики, обучающихся по специальности 150206 «Машины и технологии высокоэффективных ...Коррозия металлов
Коррозия – от лат. corrodere - разъедать. Ежегодно 1/4 всего произведенного Fe теряется из-за коррозии. Химически чистое железо не ржавеет, т.к. не ...Конспекты
урок Горение простых и сложных веществ. Тепловой эффект реакции
. Горение простых и сложных веществ. . . Тепловой эффект химической реакции.(8 класс). Учитель химии. Вохмякова Татьяна ...Роль металлов и их соединений в природной среде и в живых организмах
Дата:. 26.02. 15 г. Предмет:. химия, 8 класс. Тема: «Роль металлов и их соединений в природной среде и в живых организмах (биогенны и загрязнители). ...Соединения щелочноземельных металлов
Урок. Соединения щелочноземельных металлов. . Урок на основе технологии критического мышления. Цель:. Рассмотреть важнейшие соединения элементов ...Положение металлов в периодической системе Д.И.Менделеева. Металлическая связь
План – конспект. урока химии в 9в классе. «Положение металлов в периодической системе Д.И.Менделеева. Металлическая связь». Учитель: Кубусиди ...Получение и свойства соединений металлов
Муниципальное общеобразовательное учреждение лицей. Технологическая карта урока по химии. Практическая работа. «Получение и свойства соединений ...Химические свойства металлов
. Тема урока. Химические свойства металлов. . Класс. . 11. . . Тип урока. . Изучение и первичное закрепление нового материала. ...Химические свойства металлов. Ряд напряжения металлов
Дата_____________ Класс_______________. Тема:. . Химические свойства металлов. Ряд напряжения металлов. Цели урока:. расширить и углубить знания ...Кислород. Оксиды. Горение
Тема урока « Обобщение по теме: «Кислород. Оксиды. Горение.». Учитель. Наумова И. В. Класс. 8. Методическая цель:. через игровую форму показать ...Кислород. Оксиды. Горение
Урок-зачет по химии в 8 классе «Кислород. Оксиды. Горение». Цели урока:. - обобщить и систематизировать знания учащихся, полученные при изучении ...Значение металлов в жизни человека
Тема:. Значение металлов в жизни человека. Цель урока:. Формирование знаний о значении металлов в жизни человека. Задачи:. обучающие:. знать ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:3 марта 2019
Категория:Химия
Содержит:11 слайд(ов)
Поделись с друзьями:
Скачать презентацию