Слайд 1ЭЛЕКТРОЛИЗ. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ Лекция № 13 А.И. Малышев, проф. ОТИ НИЯУ МИФИ
Слайд 2ЭЛЕКТРОЛИЗ
Электролизом называется совокупность процес-сов, протекающих при прохождении постоянного электрического тока через систему, состоящую из двух электродов и расплава или раствора электролита. Как и в гальваническом элементе, электрод, на котором при электролизе происходит восстановле-ние, называется катодом, а электрод, на котором осуществляется процесс окисления, — анодом.
Слайд 31. на катоде в первую очередь восстанавливаются наиболее сильные окислители (идет реакция с наиболее положительным потенциалом); 2. на аноде в первую очередь окисляются наиболее сильные восстановители (идет реакция с наиболее отрицательным потенциалом); 3. совместный разряд ионов или ионизация ионов, молекул возможна при относительно малом отличии потенциалов.
ЭЛЕКТРОЛИЗ.
При определении продуктов электролиза водных растворов электролитов следует учитывать, что:
Слайд 41. Так, при электролизе кислого водного раствора соли никеля при стандартных концентрациях (или, точнее, активностях) ионов Н+ и Ni2+ ([Н+] = [Ni2+] = 1 моль/л) на катоде возможно восстановление как иона никеля:
Ni2+ + 2e- = Ni, φ1 = -0,25 В , так и иона водорода: 2Н+ + 2е- = Н2, φ2 = 0. Но поскольку φ1
Слайд 5В нейтральном растворе ([Н+] = 10-7 моль/л) потенциал водородного электрода φ1 = —0,41 В. В этом случае при прежней концентрации иона никеля (1 моль/л) φ1 > φ2, поэтому на катоде будет выделяться никель.
Ответ на вопрос:
Слайд 6ЭЛЕКТРОЛИЗ (процессы на аноде)
2. При электролизе водного раствора сульфата меди с инертными электродами (например, угольными) на аноде может окисляться как сульфат-ион
2SО42- " = S2О82- + 2е‾, φо1 = 2,01 В, так и вода*: 2Н2О = О2 + 4Н+ + 4е-, φо2 = 1,23 В.
Поскольку (φо2
Слайд 7Во многих случаях электролиза применяют раство-римые аноды из металла, восстанавливаемого на катоде. Нерастворимыми являются аноды из золота, платиновых металлов, графита, диоксида свинца, титана, оксида рутения и других веществ.
Однако при замене инертного электрода медным становится возможным протекание еще одного окислительного процесса — анодного растворения меди:
Сu = Сu2+ + 2е- , φо1 = 0,34 В.
Поскольку, φо3 **
Слайд 8При электролизе водных растворов нитратов (NO3‾), перхлоратов (ClO4‾) и фосфатов (PO43-), как и в случае сульфатов (SO42-), на инертном аноде обычно происходит окисление воды с образованием свободного кислорода.
Пример 1. Написать уравнения процессов, происходящих при электролизе водного раствора сульфата натрия с инертным анодом
Слайд 9Р е ш е н и е . На катоде возможны процессы:
φо1 = -2,71 В
2Н2О + 2е- = Н2 + 2ОН‾ , φо2 = -0,41 В
Поскольку, φо1
На аноде возможны процессы:
2Н2О = О2 + 4Н+ + 4е- , 2SО42- = S2O82- + 2e- , Na+ + e- = Na, φо4 = 2,1 В φо3 = 1,23 В
Таким образом на аноде будет происходить окисление воды, приводящее к выделению кислорода.
Слайд 10Умножая уравнение катодного процесса на два и складывая его с уравнением анодного процесса, получаем суммарное уравнение процесса электро-лиза:
6Н2О = 2Н2 ↑ + 4ОН‾ + О2↑ + 4Н+ .
(у катода) (у анода)
Приняв во внимание, что одновременно происходит накопление ионов Na+ в катодном пространстве и ионов SО42- в анодном пространстве, суммарное уравнение процесса можно записать в следующей форме:
6H2О + 2Na2SО4 = 2H2↑+ 4Na+ + 4ОН- + О2 ↑+ 4H+ + 2SO42-
Слайд 11ЗАКОНЫ ФАРАДЕЯ
Количественная характеристика процессов электро-лиза определяется законами, установленными Фарадеем. Им обычно придают следующую общую формулировку ( з а к о н Фа р а д е я):
масса электролита, подвергшаяся превраще-нию при электролизе, а также массы веществ, выделившиеся на электродах прямо пропорци-ональны количеству электричества, прошед-шего через раствор или расплав электролита, и эквивалентным массам соответствующих веществ.
Слайд 12Закон Фарадея выражается следующим уравнением: т = ЭIt / F. Здесь т — масса образовавшегося или подвергшегося превращению вещества; Э — его эквивалентная масса; I — сила тока; t — время; F — постоянная Фарадея (96500 Кл/моль), т. е. количество электричества, необходимое для осуществления электрохимического превращения одного эквива-лента вещества.
ОБЪЕДИНЕННОЕ УРАВНЕНИЕ ЗАКОНОВ ФАРАДЕЯ:
Слайд 13ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Слайд 14Пример 1. Ток силой 2,5 А, проходя через раствор электролита, за 30 мин выделяет из раствора 2,77 г металла. Найти эквивалент-ную массу металла.
Слайд 15Решение 1. Решим уравнение закона Фарадея относительно эквивалентной массы металла и подставим в него данные задачи (т = 2,77 г, I = 2,5 A, t = 30 мин = 1800 с): Э = mF/(It) = 2,77•96500/(2,5 • 1800) = 59,4 г/моль.
Слайд 16Пример 2. Какова масса меди, выделившейся на электроде при прохождении через электрохими-ческую систему количества электричества, равного 2F и выходе меди по току, равном единице (100%)?
Слайд 17Решение 2. Согласно законов Фарадея при прохождении количества электричества, равного 2F, выделится 2 моль эквивалента меди, что составляет: тСи = ЭСu· 2 = (63,57/2) г/моль ·2 моль = 63,57 г,
Слайд 18Пример 3. Определите выход по току водорода, выделенного на электроде при нормальных условиях, если объем его составил 112 л при прохождении через электрод 1000 А·ч.
Слайд 19Решение 3. Эквивалентный объем моль водорода при н. у. составляет 22,4/2 = 11,2 л. Для выделения такого объема водорода требуется количество электричества, равное 1F, или 26,8 А·ч. Следовательно, для выделения 112 л требуется 268 А ·ч. Найдем выход по току водорода:
Bj = = 0,27 (или 27%). QH2 Q 268 А∙ч 1000 А∙ч =
Слайд 20Пример 4. Ток силой 6 А пропускали через водный раствор серной кислоты в течение 1,5 ч. Вычислить массу разложившейся воды и объем выделившихся кислорода и водорода (условия нормальные)
Слайд 21Решение 4. Массу разложившейся воды находим из уравнения закона Фарадея, имея в виду, что 1,5 ч = 5400 с и Эн2о — 9 г/моль: mн2о = ЭIt /F = 9 • 6 • 5400/96500 = 3,02 г.
V = VЭIt /F. Здесь V — объем выделившегося газа, л; VЭ — его эквивалентный объем, л/моль. Поскольку при н.у. VЭ,Н2 = 11,2 л/моль, а VЭ,О2 = 5,6 л/моль, то полу-чаем:
11,2∙6∙5400 96 500 VН2 = = 3,76л ; 5,6∙6∙5400 96 500 VО2 = = 1,88л ;
При вычислении объемов выделившихся газов представим уравнение закона Фарадея в следую-щей форме:
Слайд 22687. Составить схемы электролиза водных растворов H2SO4, СuСl2, Рb(NО3)2 с платиновыми электродами. 689. Написать уравнения электродных процессов, протекающих при электролизе водных растворов FeCl3 и Са(NОз)2 с инертным анодом.
695. Имеется раствор, содержащий КСl и Cu(NO3)2 . Предложить наиболее простой способ получения практически чистого KNO3.
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
Слайд 23699. Вычислить массу серебра, выделившегося на катоде при пропускании тока силой 6 А через раствор нитрата серебра в течение 30 мин. 700. Сколько времени потребуется для полного разложения 2 молей воды током силой 2 А? 702. Найти объем кислорода (условия нормаль-ные), который выделится при пропускании тока силой 6 А в течение 30 мин через водный раствор КОН.
Слайд 24707. За 10 мин из раствора платиновой соли ток силой 5 А выделил 1,517 г Pt. Определить эквивалентную массу платины. 709. При прохождении через раствор соли трех-валентного металла тока силой 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Вычислить атомную массу металла.
Слайд 25Т Е С Т Ы По теме «Электролиз»
Слайд 26710. Какой процесс протекает при электролизе водного раствора хлорида олова (II) на оловянном аноде: a) Sn → Sn +2e- ; б) 2Сl‾ → Сl2 + 2 е- ; в) 2Н2О → О2 + 4Н+ + 4е- ? 711. При электролизе водного раствора сульфата никеля (II) на аноде протекает процесс: 2Н2О = 2О2+ 4Н+ + 4е-. Из какого материала сделан анод: а) из никеля; б) из меди; в) из золота?
Слайд 27712. При электролизе водного раствора сульфата калия значение рН раствора в приэлектродном пространстве возросло. К какому полюсу источника тока присоединен электрод: а) к положительному; б) к отрицательному? 713. При электролизе водного раствора соли значение рН в приэлектродном пространстве одного из электродов возросло. Раствор какой соли подвергся электролизу: а) КСl; б) СuСl2; в) Cu(NO3)2 ?
Слайд 28714. При электролизе водного раствора NaOH на аноде выделилось 2,8 л кислорода (условия нормальные). Сколько водорода выделилось на катоде: а) 2,8 л; б) 5,6 л; в) 11,2 л; г) 22,4 л? 715. При электролизе раствора хлорида меди (II) масса катода увеличилась на 3,2 г. Что произошло при этом на медном аноде: а) выделилось 0,112 л Сl2; б) выделилось 0,56 л O2 ; в) перешло в раствор 0,1 моля Сu2+; г) перешло в раствор 0,05 моля Сu2+?
Слайд 29КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
Слайд 30Коррозия — это разрушение металла в результате его физико-химического взаимодействия с окружающей средой. По механизму протекания коррозионного процесса различают химическую и электрохимическую коррозию. Химическая коррозия представляет собой самопроизвольное разрушение металлов в среде окислительного газа (например, кислорода, галогенов) при повышенных температурах или в жидких неэлектролитах.
nМ + m/2O2 = MnOm
Слайд 31ХИМИЧЕСКАЯ КОРРОЗИЯ
Рассмотрим химическую коррозию в газах (газовую коррозию), в частности, коррозию в атмосфере кислорода. Уравнение реакции окисления металлов кислородом можно записать в общем виде:
В соответствии с законами химической термодина-мики эта реакция, как и другие реакции коррозии, может протекать лишь при условии уменьшения энергии Гиббса системы, т. е. при условии, если энергия Гиббса меньше нуля: ∆G
Слайд 32Так как, по определению, энергия Гиббса образо-вания простых веществ равна нулю, то энергия Гиббса окисления металлов равна энергии Гиббса образования оксидов. Энергию Гиббса реакции окисления рассчитывают по уравнению:
mRT 2 ln ṕo2 ∆G = ∆G0 −
где ∆G0 - стандартная энергия Гиббса реакции; ṕo2 - относительное парциальное давление кислорода.
Слайд 33Для подавляющего большинства металлов стандартная энергия Гиббса их окисления ниже нуля, что говорит о возможности протекания этой реакции при атмосферном давлении кислорода. Однако энергия Гиббса реакции меняется при изменении температуры, соответственно меняется и давление кислорода, при котором ∆G0 > 0. Отметим: термодинамика указывает лишь на возможность протекания процессов, но не может предсказать их скорость.
Слайд 34Электрохимическая коррозия протекает при контакте металла с растворами электролитов. Например, наиболее распространенная атмосфер-ная коррозия протекает в тонких пленках электро-литов, которые возникают на поверхности металла в результате адсорбции, конденсации или прямого попадания воды и растворения в ней коррозионно-активных газов и солей (O2, SO2, СО2, NO2, NaCl и др.).
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Слайд 35Таким образом, при электрохимической коррозии разрушение металла происходит в результате работы огромного количества коррозионных микро-элементов. При этом на корродирующем металле протекает анодная реакция:
Анод: М → Мn+ + nе,
а на участках металла с более положительным потенциалом - катодное восстановление окислителя (Ох):
Катод: Ох + nе → Red
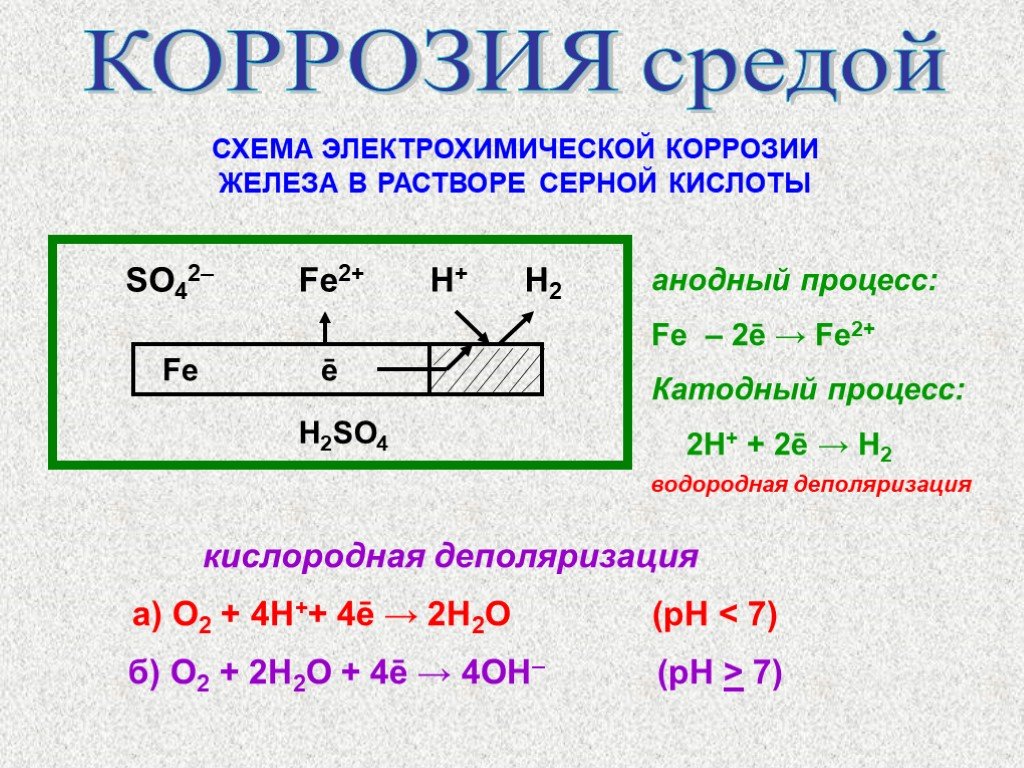
Слайд 36КОРРОЗИЯ средой
СХЕМА ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ ЖЕЛЕЗА В РАСТВОРЕ СЕРНОЙ КИСЛОТЫ
SO42– Fe2+ H+ H2 Fe ē H2SO4
кислородная деполяризация а) O2 + 4H++ 4ē → 2Н2O (pH 7)
анодный процесс: Fe – 2ē → Fe2+ Катодный процесс: 2Н+ + 2ē → Н2
водородная деполяризация
Слайд 37Наиболее распространенными окислителями при электрохимической коррозии являются молекулы O2 воздуха и ионы водорода Н+ электролита. Коррозия с участием кислорода называется коррозией с кислородной деполяризацией. В зависимости от рН среды возможны два механизма ионизации (восстановления) кислорода: а) в щелочной или нейтральной среде:
O2 + 2Н2O + 4е → 4OН– (рН>7)
б) в кислой среде:
O2 + 4Н+ + 4е → 2Н2O (рН
Слайд 38Аналогично, при коррозии с выделением водоро-да (с водородной деполяризацией) реакции выделения водорода имеют вид: а) в нейтральной или щелочной среде:
2Н2O + 2е → Н2 + 2ОН− (рН>7)
2Н+ + 2е → Н2 (рНЕсли в качестве окислителя одновременно высту-пают O2 и Н+, то такая коррозия называется корро-зией со смешанной деполяризацией.
Слайд 39Так как энергия Гиббса реакции непосредственно связана с ЭДС элемента Еэ = - ∆G/nF, то возможность протекания коррозии может быть определена по знаку ЭДС элемента, которая равна разности потенциалов катода и анода ЕЭ = φК — φА. Отсюда следует, что коррозия возможна при условии, что потенциал окислителя (или катода) положительнее потенциала металла:
φOK > φMn+/M или φK > φMn+/M
Слайд 40Равновесный потенциал кислородного электрода при 298 К описывается уравнением:
φо2/он- = 1,227 + 0,0147lg ṕo2 - 0,059рН,
а потенциал водородного электрода - уравнением:
φн+/н2 = - 0,059рН - 0,0295lg ṕн2.
В водных средах, содержащих Н+ и O2, металлы корродируют по-разному, в зависимости от рН:
Слайд 41а) если φ металла положительнее φ кислородного электрода, то коррозия металла невозможна. Например, потенциал золота во всей области рН положительнее потенциала кислородного электрода, поэтому золото с поглощением O2 и выделением Н2 корродировать не может, так как φOK Ен+/н2.
Слайд 42в) если потенциал металла отрицательнее потенциала водородного электрода, то возможна коррозия как с поглощением кислорода, так и с выделением водорода. К таким металлам относятся щелочные и щелочноземельные металлы, магний, алюминий, цинк и др.
Слайд 43ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ По темме «Коррозия металлов»
Слайд 44IX. 1. Во сколько раз возрастает толщина пленки при увеличении продолжительности равномерной газовой коррозии титана от 8 до 100 ч при 300°С. Решение. На алюминии, хроме (при t
Слайд 45IX.2. Определите скорость равномерной коррозии железа в [г/(м2·год)] и в (мм/год), если плотность коррозионного тока составляет 0,02 А/м2.
Слайд 46Решение. Скорость равномерной коррозии, выраженная в г/(м2·с), равна: v = (MЭi)/F,
Умножая эту величину на число секунд в сутки (3600·24) и число дней в году (365), получим скорость коррозии в году v = 170 г/(м2·год). Для перевода этой размерности в мм/год используем плотность железа ρ = 7,87 г/см3. После преобразо-вания единиц получим v = 0,022 мм/год.
где МЭ - молярная масса эквивалента металла; i - плотность тока коррозии.
Слайд 47IX.3. Определите термодинамическую возмож-ность газовой коррозии изделия из углеродистой стали, протекающей по реакции: Fe(т) + Н2O(г) = FeO(т) + Н2(г) если это изделие эксплуатируется при 700°С под действием водяного пара с относительным давлением ṕH2O = 6 и ṕH2= 1.
Слайд 48Решение. Условием протекания является ∆G
Стандартное значение энергии Гиббса ∆G0T,КОРР при температуре Т можно рассчитать по формуле:
∆G0T,корр = ∆H0T,корр - T∆S0T,корр.
Слайд 49Допустим, что ∆H0T,корр, не зависит от темпера-туры, тогда: ∆G0973,корр = ∆H0298,корр -973∆S0298,корр, где ∆H0298,корр и ∆S0298,корр определены по закону Гесса для заданной реакции: ∆H0298,корр = (∆fH0298,FeO + ∆fH0298,н2 ) − (∆fH0298,Fe + ∆fH0298,н2o) = = (-263,68 + 0)-(0-241,84) = -21,84 кДж,
Слайд 50∆S0298,корр = (S0FeO(т) + S0н2(г) ) - (S0Fe(т) + S0н2о(г)) = (58,79+130,6) - (27,15+ 188,84) = -26,61 Дж/К, ∆G0T,корр = −21840 − 973(−26,61) = + 4051,5 Дж, ∆G973,корр = 4051,5 − 8,314 • 973n6 = − 10404,36 Дж. Таким образом, ∆G0973,корр
Слайд 51IX.5. Возможна ли электрохимическая коррозия олова (Sn) в водном растворе при рН 6 при контакте с воздухом. Напишите уравнения реакций анодного и катодного процессов. При каких значениях рН возможна коррозия с выделением водорода?
Слайд 52Решение. Используя П. 14, найдем стандартный электродный потенциал олова (E0sn2+/sn = -0,136 В). По уравнению Нернста определим равновесные потенциалы вероятных окислителей (Н+ и О2) при 25°С, ṕн2о = 1, ṕо2 = 0,21
E0н+/н2 = - 0,059·рН = - 0,059·6 = - 0,354 В, E0о2/он- = 1,227 − 0,059рН + 0,01471g0,21 = 1,227 − 0,059 ·6 − 0,01 = 0,873 В.
Рассчитаем ЭДС предполагаемых коррозионных микроэле-ментов: ЕI = ЕK(н2) - ЕА = -0,354 В − (-0,136 В) = -0,218 В 0 коррозия с поглощением кислорода возможна
Слайд 53Таким образом, уравнения реакций анодного и катодного процессов выглядят следующим образом:
Анод Sn → Sn2+ + 2e Катод 1/2О2 + 2Н+ + 2е → Н2О
Для выяснения диапазона значений рН, при которых возможна коррозия с водородной деполяризацией, решим неравенство: ЕI = ЕK(н2) - ЕА > 0. После подстановки значений электродных потенциа-лов получим: - 0,059рН - (- 0,136) > 0. Откуда следует, что при значениях рН
Слайд 54IX.6. Определите, будет ли корродировать медь (Сu) в деаэрированном (без содержания кислорода) растворе CuSO4 в кислом растворе с рН 0 и выделением водорода при его относительном давлении рн2 = 0,1.
Слайд 55Решение. Стандартный потенциал меди (см. П. 14) составляет Е0сu2+/сu = + 0,337 В, а потенциал водорода рассчитываем по уравнению Нернста: Epн+/н2 = - 0,02951g ṕн2 - 0,059рН. После подстановки рН 0 и рн2 = 0,1, получим: E0н+/н2 = + 0,0295 В. ЭДС коррозионного микроэлемента: Е = ЕK(н2) - ЕА = + 0,0295 - 0,337
Слайд 569.4 Определите термодинамическую возможность газовой коррозии изделия из углеродистой стали (Fe) до Fе2О3 под действием кислорода, находящегося под относительным давлением ṕо2= 0,2 и температуре 350°С. 9.5 Определите термодинамическую возможность газовой коррозии изделия из никеля (Ni) до NiO под действием кислорода с относительным давлением ро2 = 1,4 и температуре 800°С. Определите парциальное давление кислорода, при котором прекращается газовая коррозия при указанной температуре.

Слайд 579.10 Возможна ли коррозия олова в водном растворе с рН 6 при контакте с воздухом? При каких значениях рН возможна коррозия с выделением водорода? 9.11 Возможна ли электрохимическая коррозия свинца (Рb) в водном растворе при рН 6 при контакте с воздухом. Напишите уравнения реакций анодного и катодного процессов. При каких значениях рН возможна коррозия с выделением водорода? 9.12 Определите, будет ли корродировать медь (Сu) в деаэрированном (без содержания кислорода) растворе при рН 0. 9.13 Магний (Mg) корродирует в морской воде (рН 8) при контакте с воздухом. Напишите уравнения реакций анодного и катодного процессов.




























































![1. Так, при электролизе кислого водного раствора соли никеля при стандартных концентрациях (или, точнее, активностях) ионов Н+ и Ni2+ ([Н+] = [Ni2+] = 1 моль/л) на катоде возможно восстановление как иона никеля: Ni2+ + 2e- = Ni, φ1 = -0,25 В , так и иона водорода: 2Н+ + 2е- = Н2, φ2 = 0. Но поскольк 1. Так, при электролизе кислого водного раствора соли никеля при стандартных концентрациях (или, точнее, активностях) ионов Н+ и Ni2+ ([Н+] = [Ni2+] = 1 моль/л) на катоде возможно восстановление как иона никеля: Ni2+ + 2e- = Ni, φ1 = -0,25 В , так и иона водорода: 2Н+ + 2е- = Н2, φ2 = 0. Но поскольк](https://prezentacii.org/upload/cloud/18/12/108406/images/thumbs/screen4.jpg)
![В нейтральном растворе ([Н+] = 10-7 моль/л) потенциал водородного электрода φ1 = —0,41 В. В этом случае при прежней концентрации иона никеля (1 моль/л) φ1 > φ2, поэтому на катоде будет выделяться никель. Ответ на вопрос: В нейтральном растворе ([Н+] = 10-7 моль/л) потенциал водородного электрода φ1 = —0,41 В. В этом случае при прежней концентрации иона никеля (1 моль/л) φ1 > φ2, поэтому на катоде будет выделяться никель. Ответ на вопрос:](https://prezentacii.org/upload/cloud/18/12/108406/images/thumbs/screen5.jpg)







































![IX.2. Определите скорость равномерной коррозии железа в [г/(м2·год)] и в (мм/год), если плотность коррозионного тока составляет 0,02 А/м2. IX.2. Определите скорость равномерной коррозии железа в [г/(м2·год)] и в (мм/год), если плотность коррозионного тока составляет 0,02 А/м2.](https://prezentacii.org/upload/cloud/18/12/108406/images/thumbs/screen45.jpg)