Презентация "Жесткость воды" по химии – проект, доклад
Презентацию на тему "Жесткость воды" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 30 слайд(ов).
Слайды презентации
Список похожих презентаций
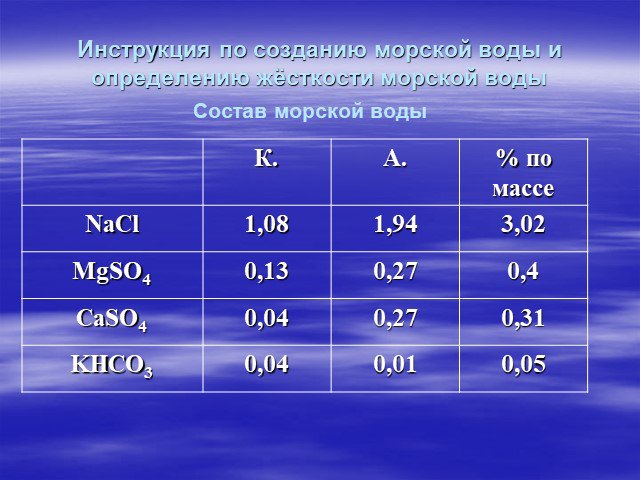
Жесткость воды
Химия жёсткости. Жёсткостью называют свойство воды, обусловленное наличием в ней растворимых солей кальция и магния. Понятие жёсткости воды принято ...Жесткость воды
Классификация воды по жёсткости. Методы устранения жёсткости воды. Кипячение Применение химических веществ Вымораживание льда Перегонка Магнитное ...Жесткость воды
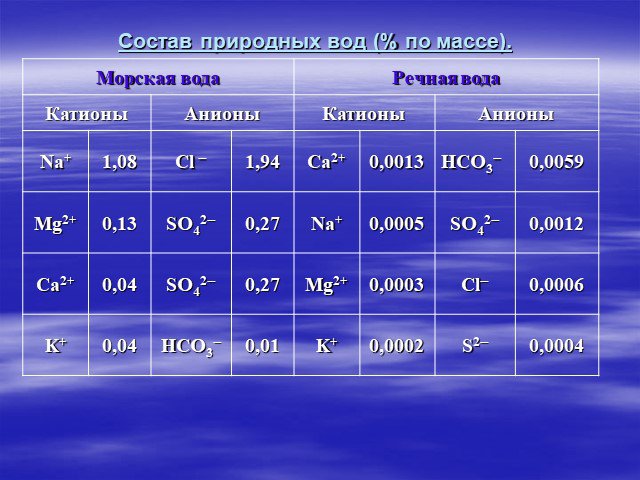
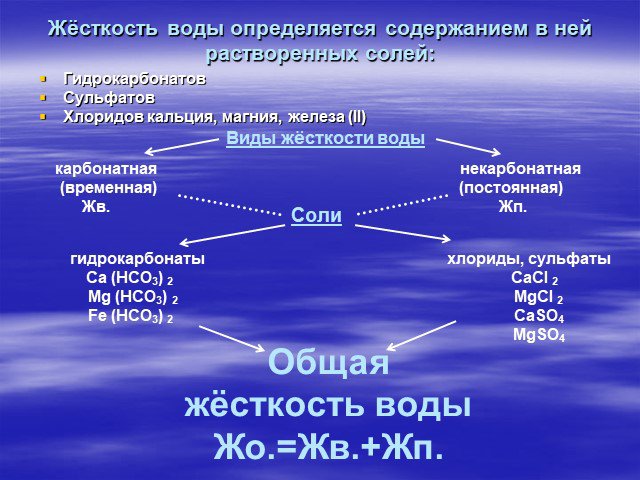
Один из возможных их источников - горные породы (известняки, доломиты), которые растворяются в результате контакта с природной водой. Сумма концентраций ...Общая жесткость воды
Общие сведения.Как утверждают ученые, жизнь на Земле возникла в водной среде. Все живые организмы почти на 2/3 состоят из воды. Качество жизни людей ...
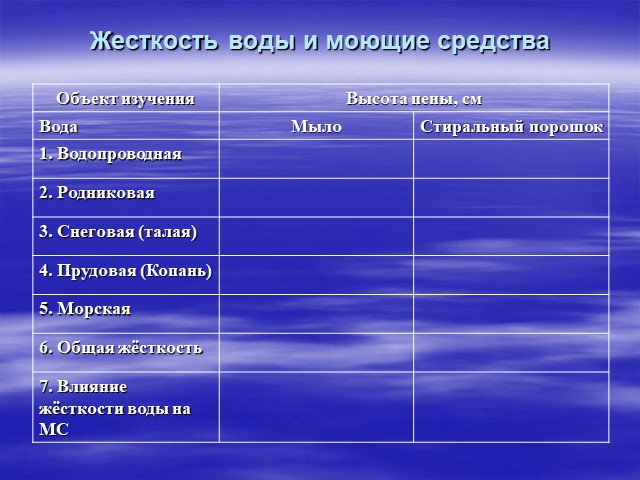
Показатели воды - её жесткость и кислотность
Определить пригодность воды для использования её в бытовых условиях.Определить жесткость исследуемой воды Определить кислотность исследуемой воды. ...
Химические свойства воды
Доказать уникальность воды, как химического вещества. Выяснить причины уникальности воды как химического соединения. Теоретический (анализ статей, ...Физические свойства воды
Физические свойства воды. Цель факультативного урока-презентации: Обобщить и систематизировать знания о физических свойствах воды, накопленные в науке ...Удивительные свойства воды
Содержание. Введение Вода вокруг нас Вода в природе Физические свойства воды Химические свойства воды Лёгкая и тяжёлая вода Вода может помнить! Другие ...Тайны воды
Ни на одной планете нет такого количества воды, как на Земле. Она и вокруг нас и в нас самих. Вода занимает ¾ поверхности Земли. Молекула воды состоит ...Свойства воды. Как человек использует свойства воды
Состав воздуха Упругость. Низкая теплопроводность. Малая плотность Сила ветра. Создание надувного матраца, футбольного мяча, автомобильной шины. Создание ...Влияние талой воды на прорастание семян
Гипотеза:. «Талая вода ускоряет прорастание семян». Задачи:. 1. Доказать что талая вода ускоряет прорастание семян. 2. Проверить влияние водопроводной ...Отстаивание воды
Отстаивание Порядок проведения:. Налил в одну некоторое количество водопроводной воды. Накрыв тканью во избежание попадания в воду посторонних примесей. ...Анализ качества питьевой воды
Вода - важнейший минерал на Земле, который нельзя заменить никаким другим веществом. Вода – основа всех жизненных процессов, единственный источник ...Виды воды
Сколько может быть различных вод? Всего могут существовать сорок две различных воды. Из них тридцать три воды будут радиоактивными, но и стабильных, ...Жёсткость воды
Что может натворить жесткая вода? Интегрированный урок химия физика география Филипповская Л.В. г. Томск гимназия № 26, учитель химии. Жесткой называют ...Волшебные свойства воды
Цель: Изучить особенности минеральной воды как необычного вещества на планете. Задачи: Изучить литературу по данному вопросу. Определить виды минеральной ...Волшебная сила воды
Вода наделялась душой во многих культурах мира. C древнейших времен человечество приписывает чудесные свойства воде. Но только в последние годы вода ...Вода и свойства воды
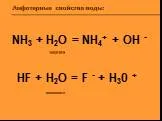
Цель: познакомиться со свойствами воды. Задачи : Формировать эмоционально-ценностное отношение к окружающему миру; Раскрепить знание о неживой природе; ...Амфотерные свойства воды
1. Катион – это: а) ион меди; б) атом серы; в) ион серы; г) атом меди. 2. Анион – это: а) ион натрия; б) ион аммония; в) карбонат-ион; г) ион водорода. ...Путешествие в лабораторию воды
Откуда взяли воду? Ул.Ст.Разина Ул.Пролетарская СХТ Ул.Орская Ул.Энергетиков. Где проверяют качество продукции, необходимой для жизни? В санитарно-гигиенической ...Конспекты
Химические свойства соединений щелочных и щелочноземельных металлов. Жесткость воды
Муниципальное общеобразовательное учреждение. Бельская средняя общеобразовательная школа. г. Белый Тверской области. Конспект урока по химии ...Вода в природе. Потребление воды в быту и на производстве. Жесткость воды и способы его устранения. Минеральные воды, их использование столовых и лечебных целях
Тема:. . Вода в природе. Потребление воды в быту и на производстве. Жесткость воды и способы его устранения. Минеральные воды, их использование ...Жесткость воды и способы ее устранения
Дата_____________ Класс_______________. Тема: Жесткость воды и способы ее устранения. . Цели урока:. рассмотреть жесткость воды и способы ее ...Жесткость воды и способы ее устранения
". Жесткость воды и способы ее устранения". . . Цели урока:. образовательная:. сформировать представление о составе природных вод;. ...Роль воды в клетке
Сценарий урока – исследования с использованием ИКТ. . . Интегрированный урок в 8-м классе: химия и биология:. . «Роль воды в клетке». Цели ...Химические свойства воды. Применение воды
Открытый урок. Тема «Химические свойства воды. Применение воды». (плановая проверка). Класс 8 «А». Учитель: Демеубаева А.К. Тема: ...Урок чистой воды
Химия – 8,9 классы. 17.11.2010. Тема: «Урок чистой воды». Цели урока:. . 1. Обобщить и систематизировать знания учащихся о воде,. акцентируя ...Типы химических реакций на примере свойств воды
Методическая информация. . . Дата. . 5.02.2013г. . . Учитель. . Мешева Айгуль Аскаровна. . . . Школа. . Белоглинская основна ...Типы химических реакций на примере свойств воды
Конспект урока. . по химии на тему. «Типы химических реакций. на примере свойств воды». Подготовила:. Сметанина Ирина Валерьевна. ...Состав и свойства воды
Тема: «Состав и свойства воды». Цель. – изучить состав, физические и химические свойства воды. Задачи:. Образовательные. . – продолжить ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:25 апреля 2015
Категория:Химия
Содержит:30 слайд(ов)
Поделись с друзьями:
Скачать презентацию


































![Методы определения жёсткости воды. Карбонатная жёсткость (временная) [Жв.] – метод кислотно-основного титрования Общая жёсткость [Жо.] – метод комплексонометрии Некарбонатная (постоянная) [Жп.] – определяют по разности между Ж общая - Ж временная Жв. (постоянная) = Ж общая - Ж временная Методы определения жёсткости воды. Карбонатная жёсткость (временная) [Жв.] – метод кислотно-основного титрования Общая жёсткость [Жо.] – метод комплексонометрии Некарбонатная (постоянная) [Жп.] – определяют по разности между Ж общая - Ж временная Жв. (постоянная) = Ж общая - Ж временная](https://prezentacii.org/upload/cloud/15/04/41433/images/thumbs/screen9.jpg)



















![Жо=Cn (Na [H2Tr])*V (Na2[H2Tr])*1000/V(H2O) Где Cn (Na [H2Tr]) – нормальность трилона Б V (H2O) – объём анализируемой воды V (Na2[H2Tr]) – объём трилона Б, пошедший на титрирование или Жо = С(1/2 Na2H2Tr)*V(Na2H2Tr)*1000 100 Жо – [ммоль/л] Расход трилона больше 5см3 на 100см3 Суммарное содержание ка Жо=Cn (Na [H2Tr])*V (Na2[H2Tr])*1000/V(H2O) Где Cn (Na [H2Tr]) – нормальность трилона Б V (H2O) – объём анализируемой воды V (Na2[H2Tr]) – объём трилона Б, пошедший на титрирование или Жо = С(1/2 Na2H2Tr)*V(Na2H2Tr)*1000 100 Жо – [ммоль/л] Расход трилона больше 5см3 на 100см3 Суммарное содержание ка](https://prezentacii.org/upload/cloud/15/04/41433/images/thumbs/screen29.jpg)