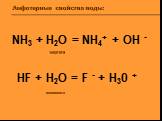Презентация "Химические свойства воды" по химии – проект, доклад
Презентацию на тему "Химические свойства воды" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 9 слайд(ов).
Слайды презентации
Список похожих презентаций
Сера. Ее физические и химические свойства
«В древней магии присутствую при рождении огня, называют серой издавна меня". 1вариант –О2 2вариант-О3. Газ без запаха Проявляет окислительные и восстановительные ...Кремний, его физические и химические свойства
Цели урока: - рассмотреть положение кремния в периодической системе Д.И.Менделеева и строении его атома; - рассмотреть нахождение кремния в природе; ...Карбоновые кислоты в природе, химические свойства, применение
План конференции:. 1. «мозговой штурм» 2. Блицопрос 3.Презентация (часть1): номенклатура, строение, классификация 4. Пресс-конференция 5. Презентация ...Различные свойства воды и значение воды в живой и неживой природе
Вода! У тебя нет ни вкуса, ни цвета, ни запаха, тебя невозможно описать, тобою наслаждаются, не ведая, что ты такое. Нельзя сказать, что ты необходима ...Алкены. Строение. Изомерия. Химические свойства. Получение
Элементный анализ этилена показывает, что в его состав входят примерно 87,5% углерода и 14,3% водорода. Плотность этилена по отношению к водороду ...Алкены. Строение. Изомерия. Химические свойства
Элементный анализ этилена показывает, что в его состав входят примерно 87,5% углерода и 14,3% водорода. Плотность этилена по отношению к водороду ...Понятие об углеводах. Моносахариды. Химические свойства глюкозы
Классификация углеводов. Углеводы Cn(H2O)m Моносахариды Дисахариды Полисахариды. Моносахариды – углеводы, не подвергающиеся гидролизу. триозы тетрозы ...Свойства воды
ВОДА. Девиз урока: Вода – это жизнь! 22 марта — Всемирный день водных ресурсов по календарю ООН, День воды. Аквариум, Акватория, Акваланг, Акварель. ...Основания. Химические свойства оснований
Классификация оснований. Растворимые в воде (щелочи). Нерастворимые в воде. NaOH Ca(OH)2 Al(OH)3 Сu(OH)2. Название оснований. Гидроксид +. Название ...Основные свойства воды
Содержание. Краткая характеристика основных свойств воды Движение частиц воды Особенности смешивания горячей и холодной воды. Цель работы: исследовать ...Волшебные свойства воды
Цель: Изучить особенности минеральной воды как необычного вещества на планете. Задачи: Изучить литературу по данному вопросу. Определить виды минеральной ...Основания. Химические свойства. Способы получения
Химические свойства. Гидроксид – ионы (ОН-), образующиеся при диссоциации оснований, обуславливают их химические свойства 1. Действие на индикаторы. ...Вода и свойства воды
Цель: познакомиться со свойствами воды. Задачи : Формировать эмоционально-ценностное отношение к окружающему миру; Раскрепить знание о неживой природе; ...Получение и химические свойства кислорода
Цели и задачи урока:. Выяснить источник кислорода в природе; познакомиться с лабораторными и промышленными способами получения кислорода Познакомиться ...Альдегиды получение, применение, физические и химические свойства
Парфюмерная продукция. Верхние ноты: бергамота, нероли, лимона Средние ноты: ландыша, ириса, жасмина Базовые ноты: мускуса, ванили, сандалового дерева. ...Алкины-способы получения и химические свойства
Тема и цели урока:. Тема: «Ацетилен. Алкины». Цель урока: Дать представления об углеводородах с тройной связью. О их физико-химических свойствах и ...Металлы. Химические и физические свойства металлов
Физические свойства металлов. Очень важным свойством металлов является их сравнительно легкая механическая деформируемость. Металлы пластичны, они ...Алюминий – металл ХХ века. Физические и химические свойства
Алюминий. Алюминий вы найдете В ложке, кружке, самолете. Нужен легонький металл, Чтобы самолет летал! Самолет парит легко, Небосвод пронзает синий, ..."Электрохимический ряд напряжений металлов. Общие химические свойства металлов". 11-й класс
Цель урока:. Повторить и обобщить общие химические свойства металлов с учетом их положения в ЭХРНМ. Задачи урока:. Повторить общие химические свойства ...Амфотерные свойства воды
1. Катион – это: а) ион меди; б) атом серы; в) ион серы; г) атом меди. 2. Анион – это: а) ион натрия; б) ион аммония; в) карбонат-ион; г) ион водорода. ...Конспекты
Химические свойства воды. Применение воды
Открытый урок. Тема «Химические свойства воды. Применение воды». (плановая проверка). Класс 8 «А». Учитель: Демеубаева А.К. Тема: ...Состав , физические и химические свойства воды
. Открытый урок по химии в 8 классе по теме:. «Состав , физические и химические свойства воды. ». Учитель МКОУ СОШ с.п. Кара-Суу Жабоева Раиса ...Химические свойства металлов. Ряд напряжения металлов
Дата_____________ Класс_______________. Тема:. . Химические свойства металлов. Ряд напряжения металлов. Цели урока:. расширить и углубить знания ...Азот положение в ПСХЭ. Строение атома и молекулы. Физические и химические свойства
Опорный конспект по теме: «Азот положение в ПСХЭ. . Строение атома и молекулы. Физические и химические свойства. I. .Положение азота в ПСХЭ:. ...Химические свойства металлов
. Тема урока. Химические свойства металлов. . Класс. . 11. . . Тип урока. . Изучение и первичное закрепление нового материала. ...Химические свойства металлов
Тема: «Химические свойства металлов». Цель урока:. Сформировать понятие об общих химических свойствах металлов и их восстановительных способностях. ...Химические свойства металлов
Губарева Вера Александровна, г.Нижнекамск РТ. . Муниципальное общеобразовательное учреждение. «Средняя общеобразовательная школа №7». Г.Нижнекамск, ...Химические свойства металлов
Разработка урока по химии в 9-м классе по теме: "Химические свойства металлов". . Бодыкова Гульшат Зулхарнаевна. учитель. ница. химии. . . ...Алюминий. Положение алюминия в периодической системе и строение его атома. Нахождение в природе. Физические и химические свойства алюминия
Дата_____________ Класс_______________. Тема: Алюминий. Положение алюминия в периодической системе и строение его атома. Нахождение в природе. Физические ...Алюминий, его физические и химические свойства
План – конспект урока. Тема урока:. Алюминий, его физические и химические свойства. Тип урока:. изучение нового материала. Цель:. обучающиеся ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:31 января 2019
Категория:Химия
Содержит:9 слайд(ов)
Поделись с друзьями:
Скачать презентацию