Презентация "Ароматические углеводороды" по химии – проект, доклад
Презентацию на тему "Ароматические углеводороды" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 20 слайд(ов).
Слайды презентации
Список похожих презентаций
Ароматические углеводороды. Бензол
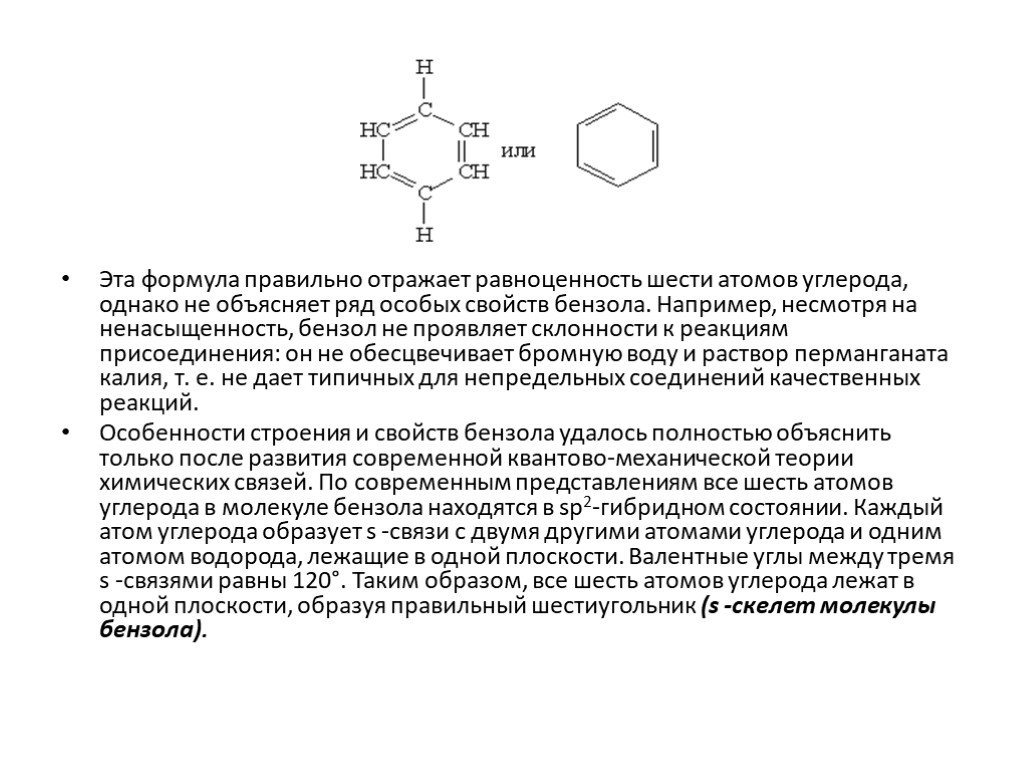
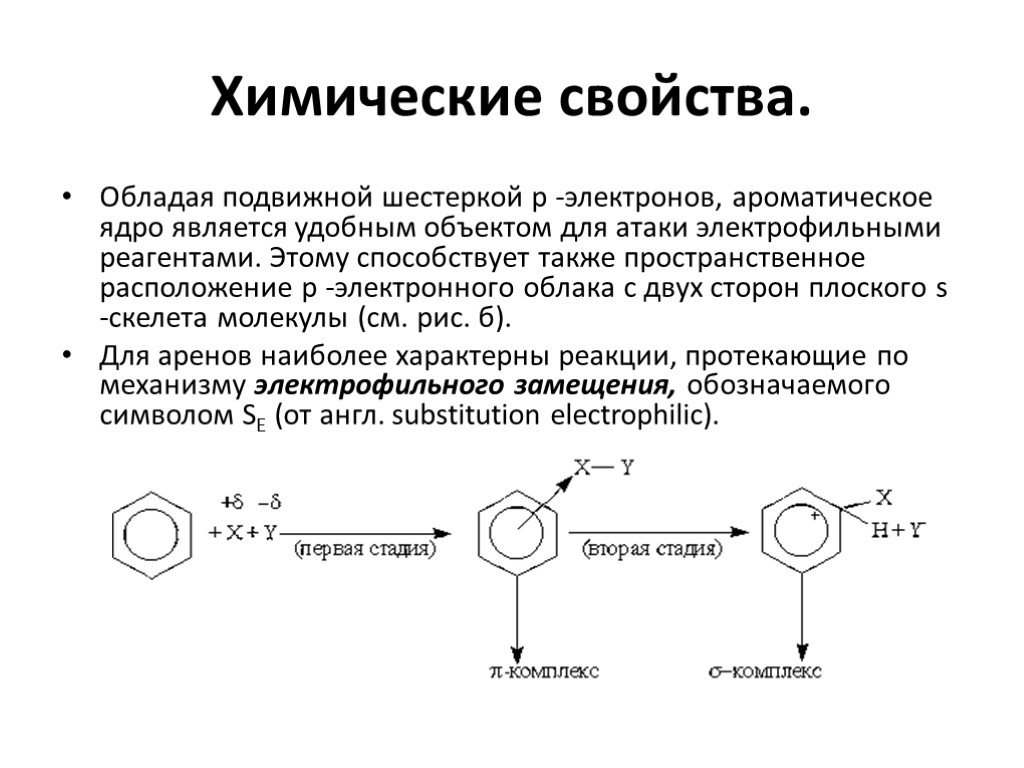
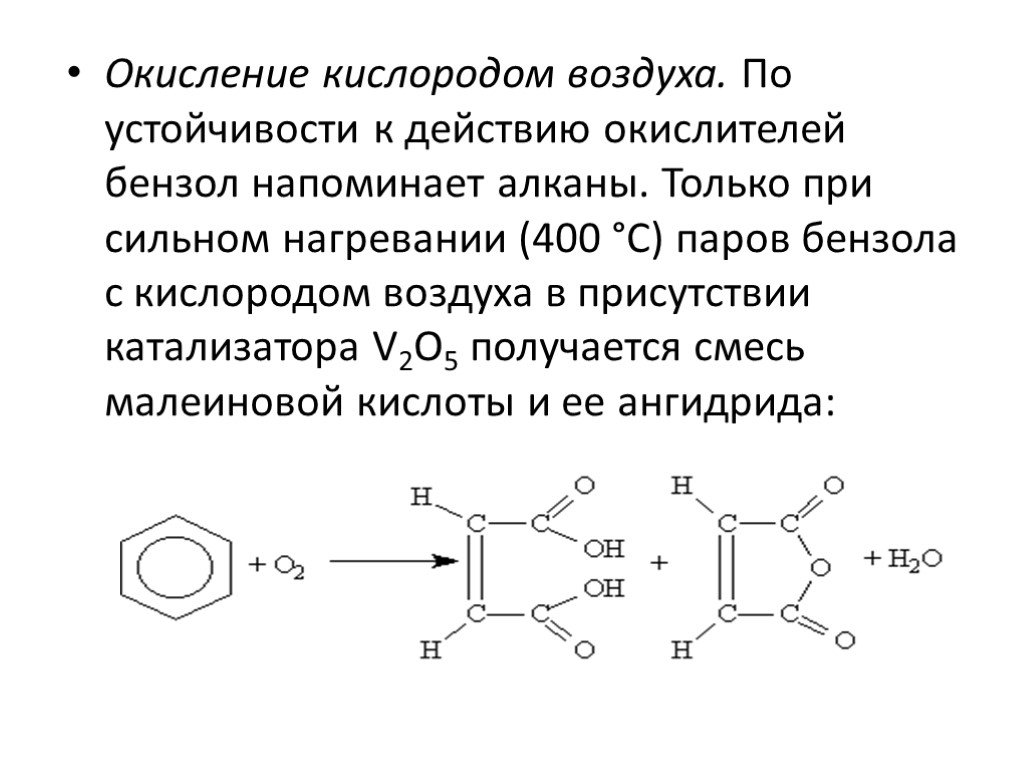
Ароматические углеводороды Название эти углеводороды получили от первых известных представителей этого класса, имевших приятный запах…. По международной ...Арены. Ароматические углеводороды. Бензол.
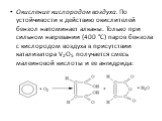
Ароматические соединения — циклические органические соединения, которые имеют в своём составе ароматическую систему. Основные отличительные свойства ...Ароматические углеводороды. Бензол
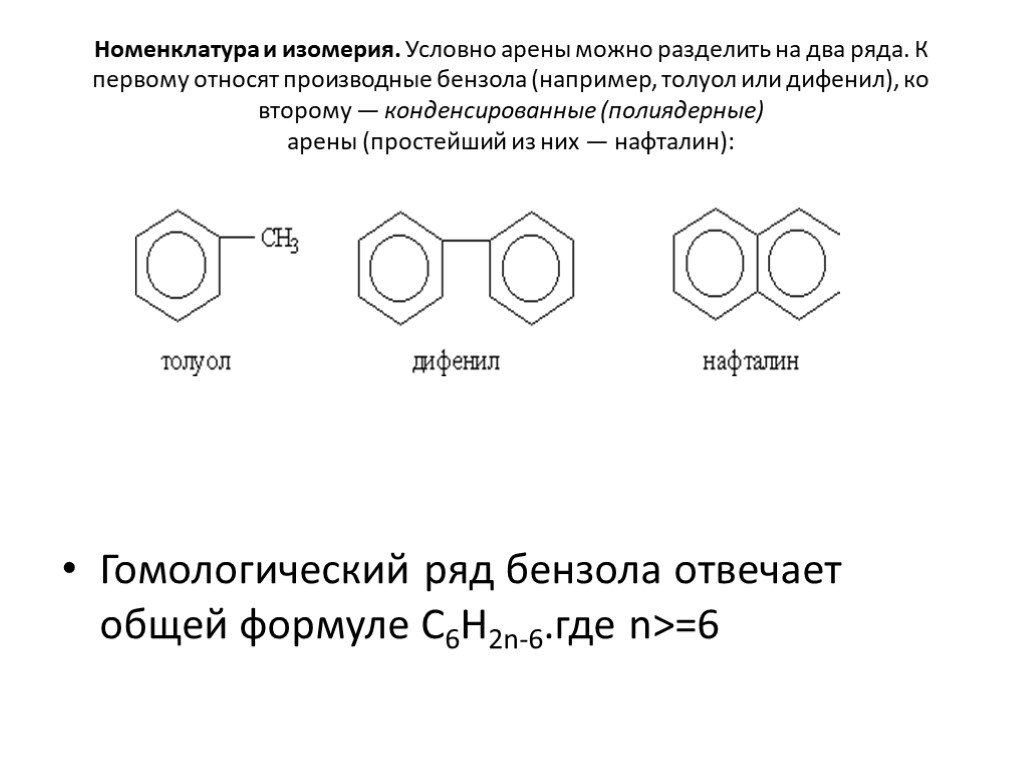
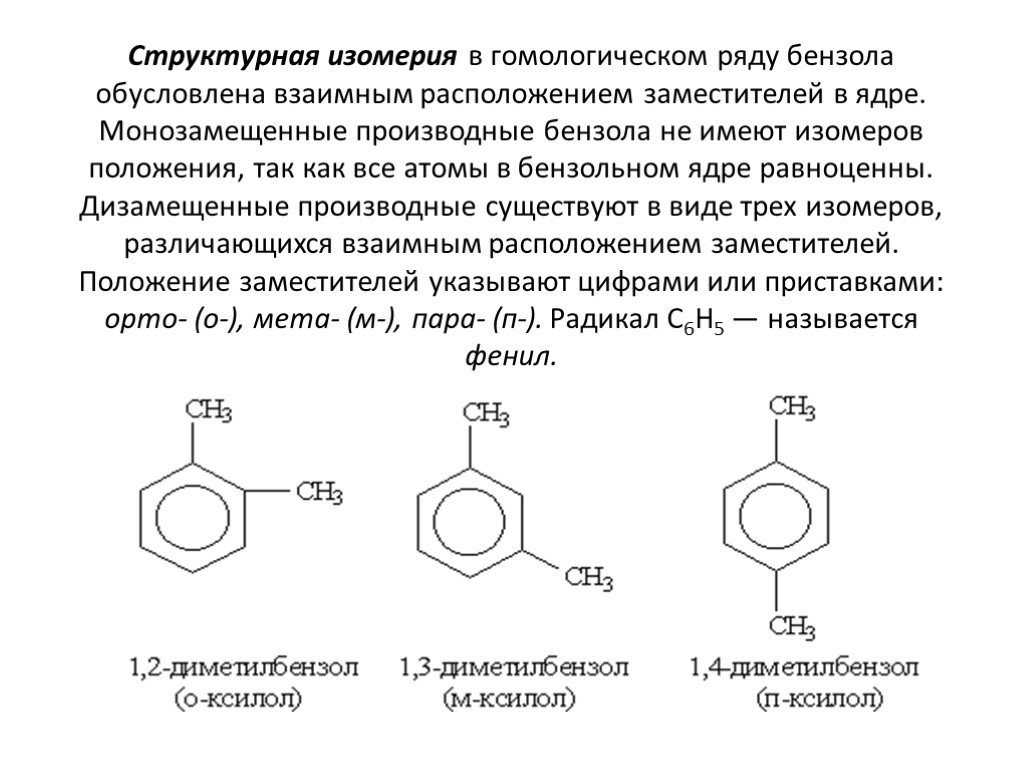
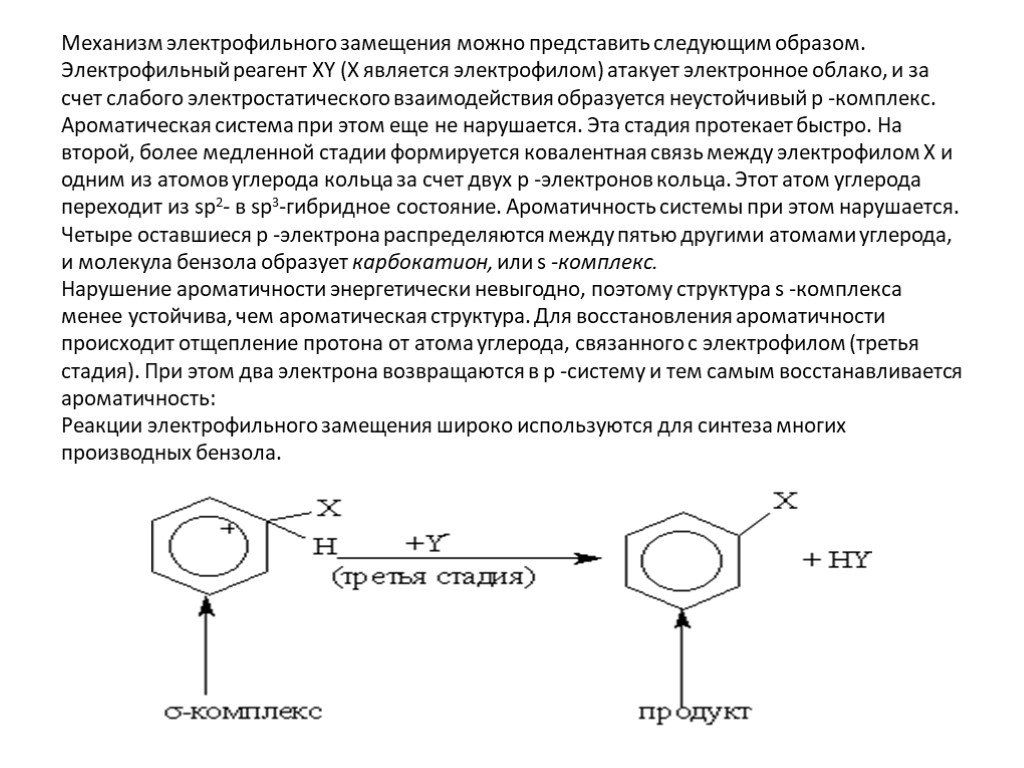
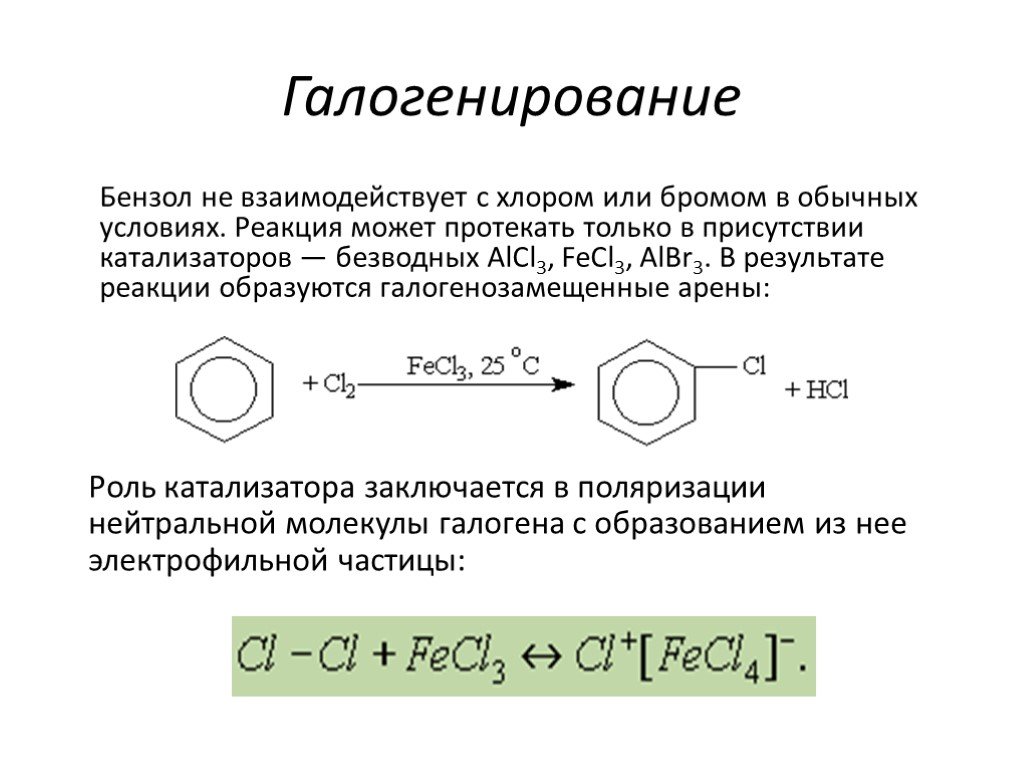
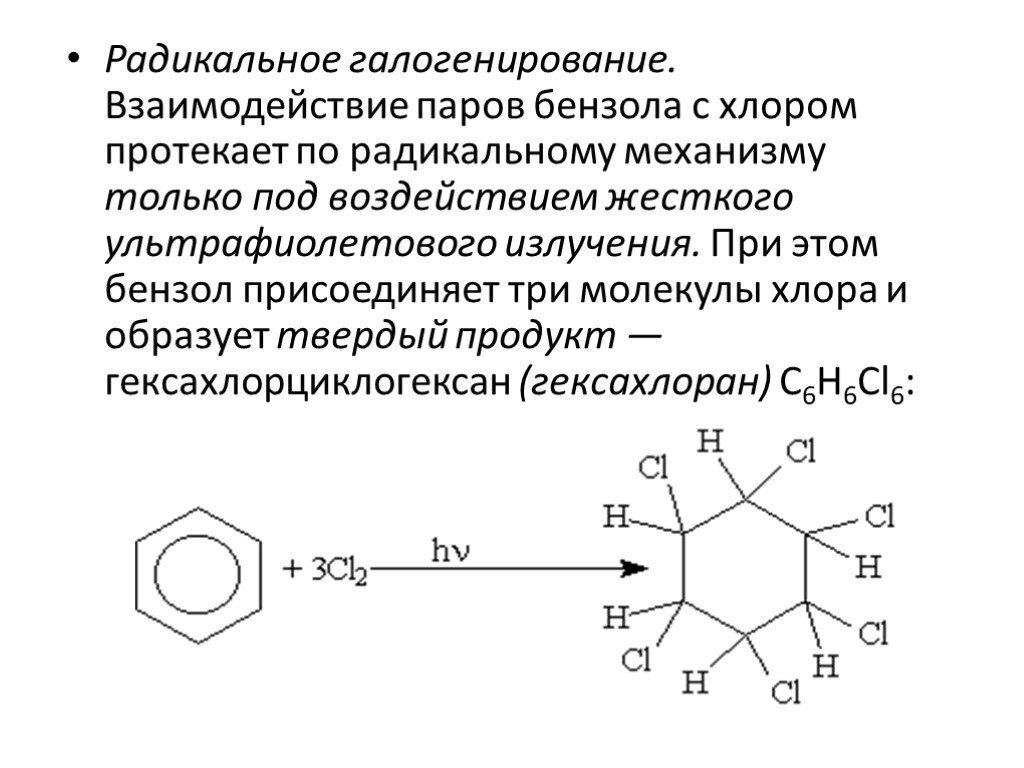
Строение молекулы. УВ. Химические свойства. Изомерия. Физические свойства. Проверка знаний Получение Номенклатура Применение. История открытия бензола. ...Ароматические углеводороды, арены, бензол
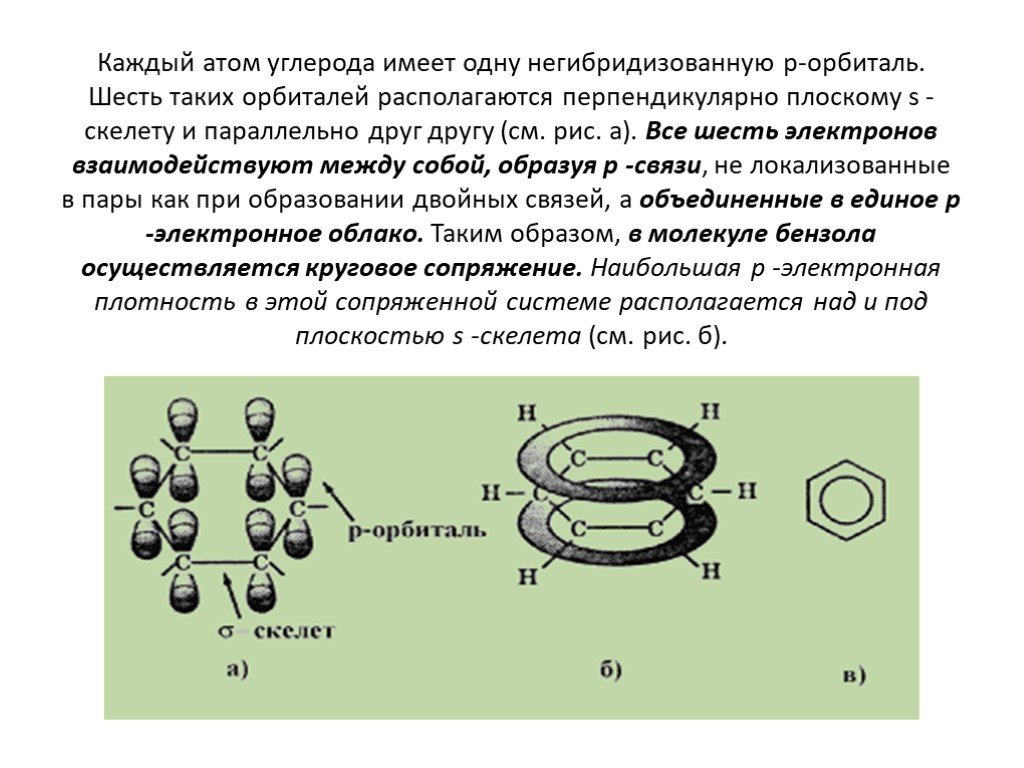
Общая характеристика класса:. Ароматическими углеводородами называются соединения, молекулы которых содержат устойчивые циклические структуры- бензольные ...Ароматические углеводороды – арены. Бензол как представитель ароматических углеводородов
Бензол как представитель ароматических углеводородов. Задачи урока:. на примере бензола познакомиться с углеводородами, которые имеют замкнутые цепи ...Ароматические углеводороды
Познакомиться с классом ароматических углеводородов. Изучить представителей этого класса. Знать их отличительные свойства. Знать области их применения. ...Арены. Ароматические углеводороды. Бензол
Запишите уравнения реакций:. 1 вариант бутанбутен бутадиен 1,3 1,4-дибромбутен-2. Получение этина . 2 вариант 1.Пропенпропинхлор-пропендихлорпропан. ...Предельные углеводороды
Цели урока: Научить учащихся выводить формулу вещества по его относительной плотности и массовым долям элементов, выводить формулу вещества по его ...Обобщение: предельные и непредельные углеводороды
Цели урока:. повторить, обобщить и закрепить полученные знания и умения по темам «Предельные и непредельные углеводороды» изучить генетическую связь ...Непредельные углеводороды
Почему этилен – газ, а полиэтилен – твёрдое вещество? Гипотеза: Свойства веществ определяются их строением. Проблема. Для того, чтобы выяснить, возможно ...Непредельные углеводороды
Непредельные УГЛЕВОДОРОДЫ. Алкены Алкадиены Алкины. Цель викторины:. Повторить, закрепить и проверить материал по теме: «Непредельные углеводороды», ...Предельные углеводороды химия
Органическая химия – это раздел химической науки, в котором изучаются соединения углерода и их превращения. В наши дни к органическим веществам относятся ...Предельные углеводороды
План урока. Понятие о углеводородах. 2.Предельные углеводороды. 3.Природные источники углеводородов. 4. Вопросы. Д/З § 33, В.3, 4. 1. Понятие о углеводородах. ...Ароматические эфирные масла и их использование
Объект исследования:. Ароматические эфирные масла. Предмет исследования:. влияние ароматических масел на организм человека; эфирные масла – натуральные ...Предельные углеводороды
Определение. Предельные углеводороды - это органические вещества, состоящие только из углерода и водорода, соответствующие общей формуле Сn Н2n +2. ...Предельные углеводороды
Классификация органических веществ. УГЛЕВОДОРОДЫ – это вещества, состоящие только из углерода и водорода. Определение предельных углеводородов (ПУВ). ...Диеновые углеводороды
I. Номенклатура и изомерия. Классификация. Непредельные соединения, содержащие в молекуле две двойные связи, называют диеновыми углеводородами. Их ...Предельные углеводороды (алканы, или парафины)
Алканы – название предельных углеводородов по международной номенклатуре Междунаро́дный сою́з теорети́ческой и прикладно́й хи́мии (ИЮПАК, International ...Диеновые углеводороды
« Мало знать, надо и применять. Мало хотеть, надо и делать.» И.В.Гёте. «3» Лимон 1. Какие углеводороды называют диеновыми? 2. Перечислите качественные ...Химия Предельные углеводороды
1.Строение предельных углеводородов. 2.Гомологический ряд метана. 3.Таблица 1 гомологический ряд алканов. 4.Изомерия и номенклатура. 5.Получение. ...Конспекты
Ароматические углеводороды – арены. Бензол как представитель ароматических углеводородов
ФОРМА УРОКА:. презентация с музыкальным сопровождением. ТИП УРОКА:. изучение нового материала. ТЕМА УРОКА. «Ароматические углеводороды – арены. ...Ароматические углеводороды
ПРЕДМЕТ-ХИМИЯ. . 10 класс. Учитель - Барышникова Ирина Владимировна. ГОУ СОШ № 129 Красногвардейского района, г. Санкт-Петербурга. ...Ароматические углеводороды
Ароматические углеводороды (5часов). Планирование уроков:. 1. Строение, изомерия, физические и химические свойства, получение и применение аренов. ...Предельные углеводороды
. Конспект урока химии в 10 классе. . по теме «. Предельные углеводороды». с мультимедийным сопровождением. . . . Урок изучения нового ...Предельные углеводороды
Кроссворд «Предельные углеводороды». . На каждую парту выдается по кроссворду, время решения которого 5 мин. После этого проверяют ответы. Ребята, ...Непредельные углеводороды
тема : Непредельные углеводороды. Цель. :. организация деятельности учащихся, направленной на прочное усвоение знаний по непредельным углеводородам. ...Ненасыщенные углеводороды
Карточка №1 Ненасыщенные углеводороды. . Реши задачу: определи формулу и название вещества. . Массовая доля углерода в веществе 85,7%, а водорода ...Насыщенные углеводороды глава
Составила тест учитель химии и биологии Хамзина Гульжан Минуллаевна. Р.Казахстан. Маржанбулакская средняя школа. Актюбинской области. Конспект ...Как получают этилен и углеводороды ряда этилена?
Гаврикова Людмила Дмитриевна. ,. . учитель химии МБОУ «СОШ №38». . Озерского городского округа Челябинской области. . Тема урока:. . Как получают ...Диеновые углеводороды
"Диеновые углеводороды". (урок химии в 10 классе, учитель химии Хочуева Ф.З,). Цель урока: . формирование теоретического и практического обучения ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:1 декабря 2018
Категория:Химия
Содержит:20 слайд(ов)
Поделись с друзьями:
Скачать презентацию