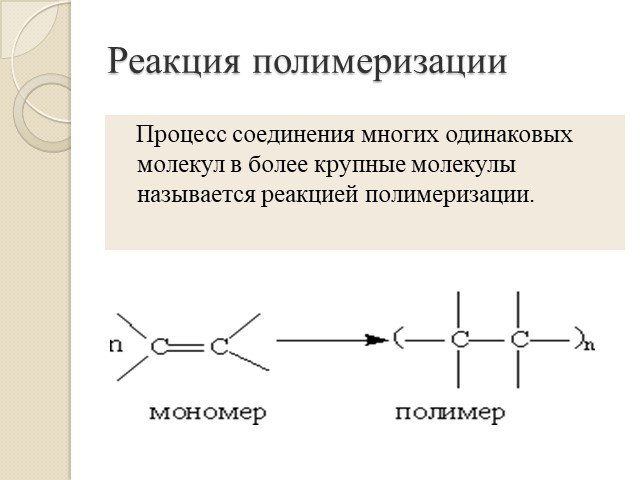
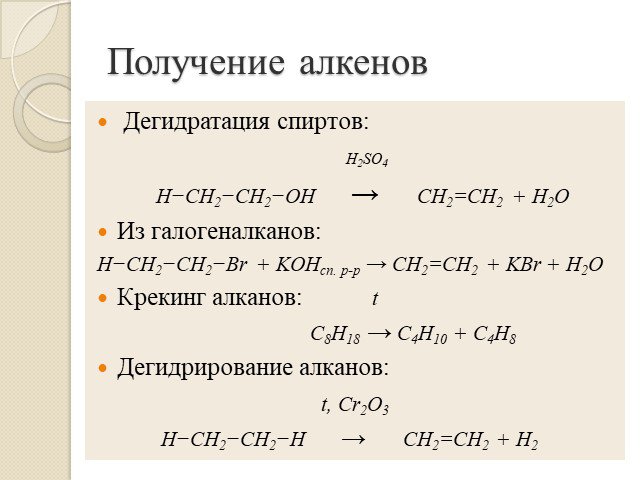
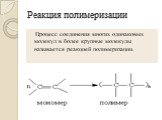
Презентация "Алкены. Строение. Изомерия. Химические свойства. Получение" по химии – проект, доклад
Презентацию на тему "Алкены. Строение. Изомерия. Химические свойства. Получение" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 15 слайд(ов).
Слайды презентации
Список похожих презентаций
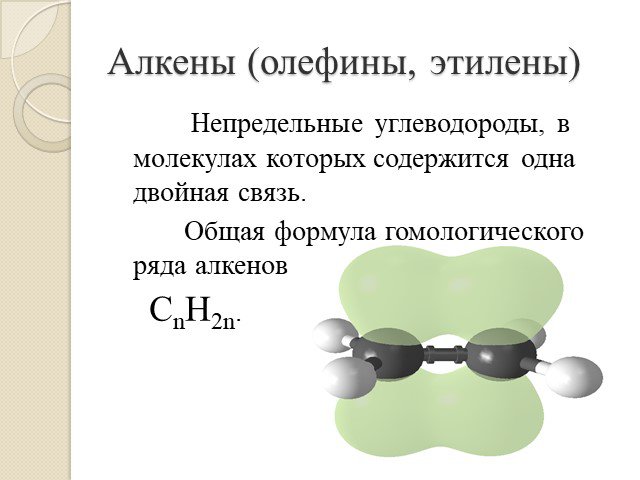
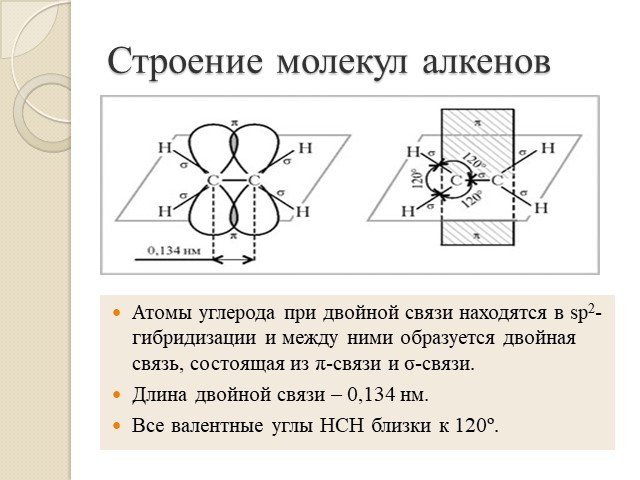
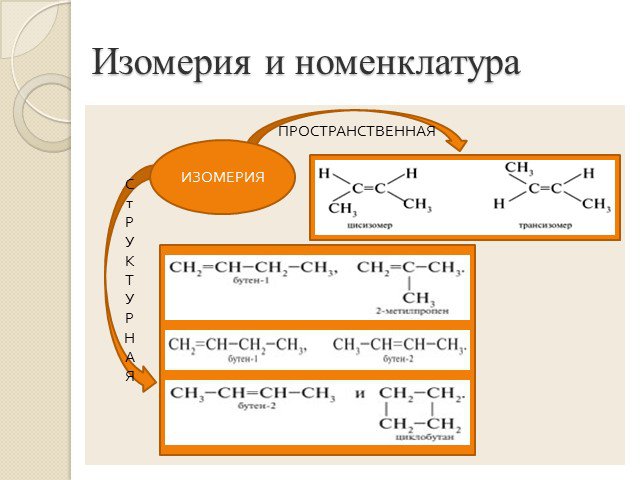
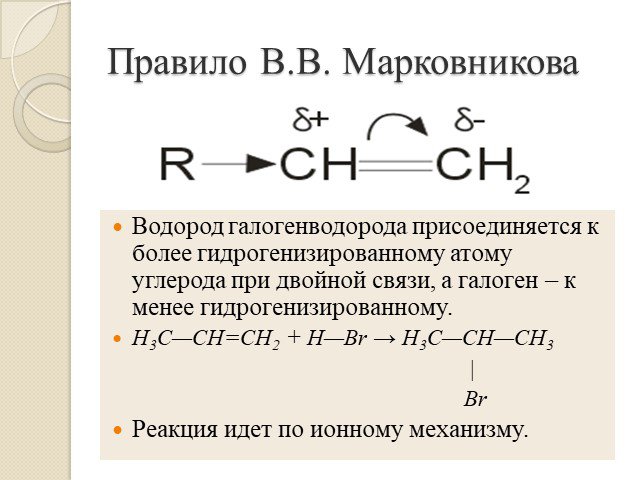
Алкены. Строение. Изомерия. Химические свойства
Элементный анализ этилена показывает, что в его состав входят примерно 87,5% углерода и 14,3% водорода. Плотность этилена по отношению к водороду ...Альдегиды получение, применение, физические и химические свойства
Парфюмерная продукция. Верхние ноты: бергамота, нероли, лимона Средние ноты: ландыша, ириса, жасмина Базовые ноты: мускуса, ванили, сандалового дерева. ...Сложные эфиры. Жиры Строение, получение, свойства
Сложные эфиры. При взаимодействии карбоновых кислот со спиртами (реакция этерификации) образуются сложные эфиры: O O R1- C + R2 – OH R1- C +2H2O O ...Получение и химические свойства кислорода
Цели и задачи урока:. Выяснить источник кислорода в природе; познакомиться с лабораторными и промышленными способами получения кислорода Познакомиться ...Кремний, его физические и химические свойства
Цели урока: - рассмотреть положение кремния в периодической системе Д.И.Менделеева и строении его атома; - рассмотреть нахождение кремния в природе; ...Синтетические каучуки, строение, свойства, применение
Лебедев С.В. Бутадиеновые каучуки. Цис - Транс -. Изопреновые каучуки. Применение каучуков и других полимеров в медицине для изготовления искусственных ...Соли: свойства, получение, применение
4. Что такое кислоты? 1. Какие классы веществ вы знаете? 2. Что такое оксиды? 3. Что такое основания? 5. Что такое основные оксиды, (кислотные оксиды)? ..."Электрохимический ряд напряжений металлов. Общие химические свойства металлов". 11-й класс
Цель урока:. Повторить и обобщить общие химические свойства металлов с учетом их положения в ЭХРНМ. Задачи урока:. Повторить общие химические свойства ...Кислород. Получение кислорода и его физические свойства
Цель. сформировать понятия кислород как атом и молекула; изучить физические и химические свойства кислорода, нахождение его в природе; рассмотреть ...Сера. Ее физические и химические свойства
«В древней магии присутствую при рождении огня, называют серой издавна меня". 1вариант –О2 2вариант-О3. Газ без запаха Проявляет окислительные и восстановительные ...Кислород. Общая характеристика, получение и свойства
Химический элемент Знак элемента – О Относительная атомная масса – 16 Валентность – II. Кислород. Простое вещество Неметалл Молекула – О2 Относительная ...Получение и свойства алканов
ПОЛУЧЕНИЕ АЛКАНОВ:. ФРАКЦИОННАЯ ПЕРЕГОНКА НЕФТИ Нефть поступает в ректификационные колонны на атмосферную перегонку (перегонку при атмосферном давлении), ...Получение и свойства алканов
Оглавление. Определение Гомологического ряд метана Строение молекулы метана Номенклатура Изомерия Получение Физические свойства Химические свойства ...Получение и свойства водорода
Как вы думаете , где используется водород? Каково практическое значение водорода? Где можно использовать знания по данной теме? Каковы цели урока? ...Алюминий – металл ХХ века. Физические и химические свойства
Алюминий. Алюминий вы найдете В ложке, кружке, самолете. Нужен легонький металл, Чтобы самолет летал! Самолет парит легко, Небосвод пронзает синий, ...Альдегиды, свойства, получение, применение
Цели урока.Продолжить знакомить учащихся с кислородсодержащими органическими соединениями на примере альдегидов. Познакомить учащихся с применением ...
Карбоновые кислоты в природе, химические свойства, применение
План конференции:. 1. «мозговой штурм» 2. Блицопрос 3.Презентация (часть1): номенклатура, строение, классификация 4. Пресс-конференция 5. Презентация ...Алкины-способы получения и химические свойства
Тема и цели урока:. Тема: «Ацетилен. Алкины». Цель урока: Дать представления об углеводородах с тройной связью. О их физико-химических свойствах и ...Аммиак: состав, строение, свойства, применение
История названия. Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному ...Аммиак состав, строение, свойства, применение
Аммиак может быть обязан своим названием оазису бога Аммона в Северной Африке, находящемуся на перекрестке караванных путей. В очень жарком климате ...Конспекты
Аммиак. Строение молекулы. Физические и химические свойства. Получение, применение
ПЛАН-КОНСПЕКТ УРОКА Аммиак. Строение молекулы. Физические и химические свойства. Получение, применение. ФИО:. Исмаилова Венера Владимировна. ...Алкены :состав, строение ,номенклатура , изомерия ,физические свойства
Алкены :состав, строение ,номенклатура ,. изомерия ,физические свойства. Девиз: Величие человека в его способности мыслить. Цель урока :. познакомить ...Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот, физические и химические свойства, получение и применение
Дата_____________ Класс_______________. Тема:. . Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот, ...Фосфор. Положение в п.с. Строение атома. Физические и химические свойства
Тема. Фосфор. Положение в п.с. Строение атома. Физические и химические свойства. Фосфор как элемент и простое вещество. Тип урока. – Комбинированный, ...Азот положение в ПСХЭ. Строение атома и молекулы. Физические и химические свойства
Опорный конспект по теме: «Азот положение в ПСХЭ. . Строение атома и молекулы. Физические и химические свойства. I. .Положение азота в ПСХЭ:. ...Спирты, их строение, номенклатура, физические и химические свойства спиртов
Тема:. «Спирты, их строение, номенклатура, физические и химические свойства спиртов». . Цели. :. Знать строение, номенклатуру, физические и химические ...Строение и химические свойства глюкозы
Разработка урока химии:. «Строение и химические свойства. . глюкозы». . Мельяновская И.С. ,учитель химии. . первой ...Алюминий. Строение атома, физические и химические свойства простого вещества
ПЛАН-КОНСПЕКТ УРОКА. Тема: Алюминий. Строение атома, физические и химические свойства простого вещества. . . ФИО (полностью). . Иванова ...Аминокислоты. Состав, строение, физические свойства и получение
Министерство образования и науки РФ. Муниципальное общеобразовательное учреждение СОШ №2. п. Спирово Тверской области. Конспект урока ...Кислород: строение, свойства, получение и применение
Подготовил: Капитаненко В. П. Учитель химии. МБОУ «Беляевская СОШ». Урок по теме: «Кислород: строение, свойства, получение и применение». ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 сентября 2014
Категория:Химия
Автор презентации:учитель химии Елена Викторовна Переверзева
Содержит:15 слайд(ов)
Поделись с друзьями:
Скачать презентацию