Слайд 1Кислотно-щелочное состояние
Подготовила студентка 6 курса 50 группы лечебного факультета Ленцевич Алёна Станиславовна
Слайд 2Кислотно-щелочное состояние (КЩС) рассматривают как совокупность физико-химических, биологических, биохимических и других процессов, поддерживающих относительное постоянство активной реакции внутренней среды организма. Иначе КЩС можно характеризовать как величину, определяющую отношение катионов Н+ к различным анионам. Поддержание оптимального уровня КЩС жидкостей организма — необходимое условие для нормального обмена веществ и сохранения активности ферментных систем.

Слайд 3ФИЗИКО-ХИМИЧЕСКИЕ ФАКТОРЫ КЩС
Организм на 50—60% состоит из воды. Вода, даже в нормальных условиях, диссоциирует на Н+ и ОН. Интегральным показателем КЩС является рН (potentia hydrogenii — сила водорода). Подсчитано, что в одном литре химически чистой воды содержится 0,0000007 г Н+. В логарифме с отрицательным знаком эта величина будет равна 7(нейтральная реакция). Сама вода оказывает определенное буферное действие, т. е. обладает способностью сопротивляться изменениям концентрации водородных ионов. По Бронстеду (Bronsted), кислота определяется как донатор протонов Н+, а основание — как их акцептор. При обычном режиме питания в организме накапливается некоторый избыток Н+ ионов, образующихся в процессе обмена органических и неорганических кислот (молочной, пировиноградной, фосфорной, серной). Кроме того, в условиях нормального обмена в сутки образуется до 20000 ммоль СО2.

Слайд 4Нарушения КЩС, возникающие в связи с накоплением кислот или с недостатком оснований, называют ацидозом; избыток оснований или снижение содержания кислот — алкалозом. Иначе можно сказать, что ацидоз — это сдвиг рН в кислую, а алкалоз — сдвиг рН в щелочную сторону. Если ацидоз или алкалоз вызываются нарушениями вентиляции, сопровождающимися увеличением или уменьшением углекислого газа, их называют дыхательными, во всех других случаях — метаболическими.
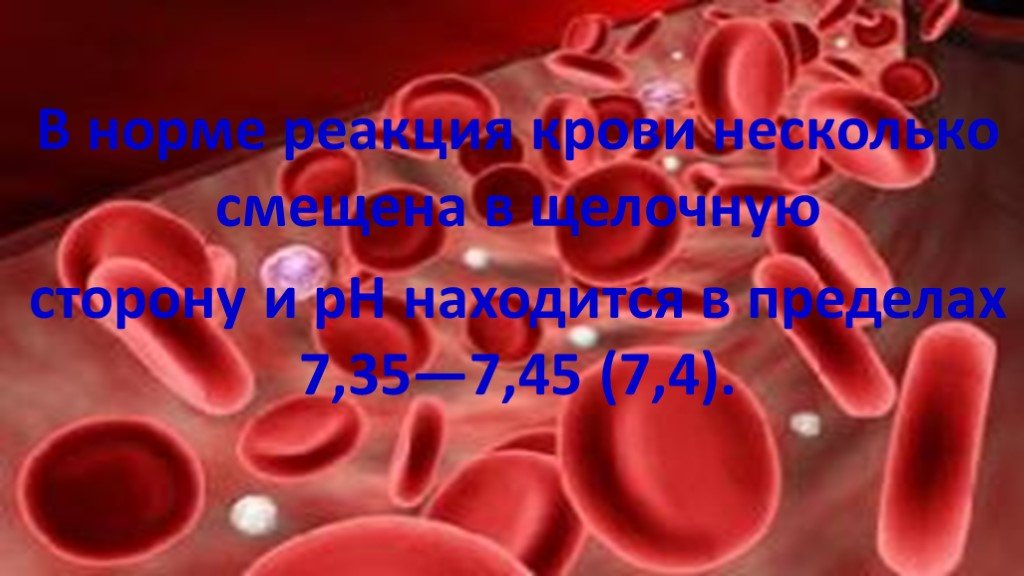
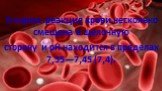
Слайд 5В норме реакция крови несколько смещена в щелочную сторону и рН находится в пределах 7,35—7,45 (7,4).
Слайд 6МЕХАНИЗМЫ ПОДДЕРЖАНИЯ КЩС
Выделяют два основных механизма, обеспечивающих уравновешивание кислых ионов: 1. Химические буферные системы крови и тканей. 2. Физиологические буферные системы.
Слайд 7Химические буферные системы крови и тканей
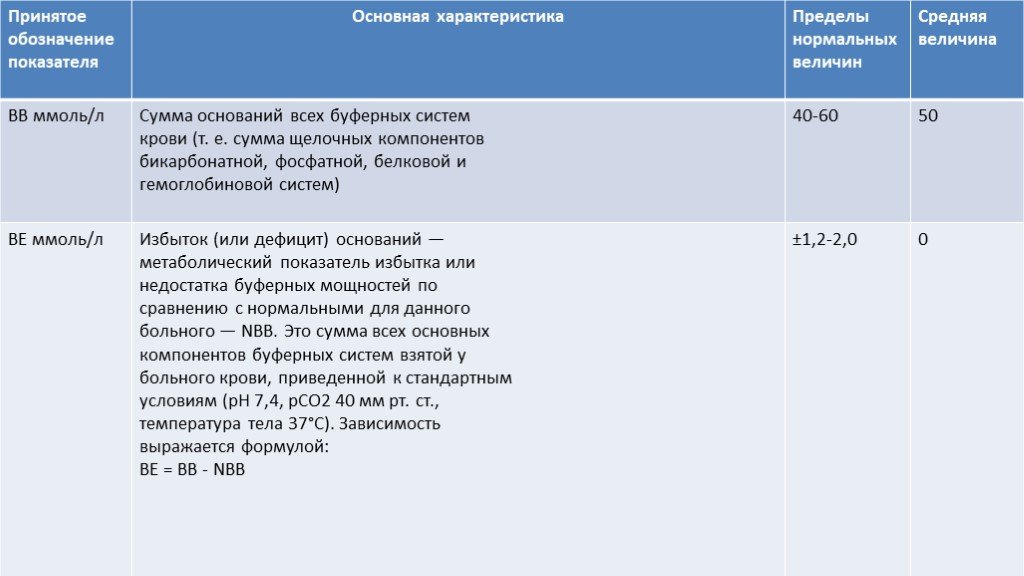
Буферная система представляет собой сопряженную кислотно-основную пару, состоящую из донатора и акцептора водородных ионов (протонов). Для клинициста наибольший интерес представляют четыре наиболее главных буфера, играющих ведущую роль в гомеостатических механизмах регуляции рН крови: • гидрокарбонатный (карбонатный) буфер — 53%, • гемоглобин-оксигемоглобиновый буфер — 35%, • протеиновый (белковый) буфер — 7%, • фосфатная система буферов (фосфатный буфер) — 5%.

Слайд 8Физиологические буферные системы
ДЫХАТЕЛЬНАЯ РЕГУЛЯЦИЯ КЩС Количество углекислого газа, выделяющегося через легкие, контролируется дыхательным центром. При возрастании его концентрации дыхательный центр раздражается и вентиляционная функция легких увеличивается. Дыхательный центр мозга стимулируется через хеморецепторы, расположенные в дуге аорты и в каротидном синусе. Наиболее сильными раздражителями дыхательного центра являются углекислый газ, рН крови и кислород. Уменьшение концентрации кислорода в крови и возрастание концентрации СО2 приводят к увеличению легочной вентиляции. То же самое происходит при сдвиге рН ниже нормы. Так, при падении рН до 7,0 и ниже, МОД возрастает до 35—40 л. Отсюда можно понять, почему становится столь сильной легочная вентиляция при ацидозе, на фоне сахарного диабета. Дыхательная регуляция КЩС относится к системе быстрого реагирования

Слайд 9ПОЧЕЧНАЯ РЕГУЛЯЦИЯ КЩС осуществляется путем поддержания концентрации бикарбонатного буфера плазмы (НСО3) в пределах 22—26 ммоль/л. Процесс происходит при помощи выведения ионов водорода, образующихся из угольной кислоты, через клетки почечных канальцев, а также с задержкой Na+ в канальцевой жидкости (моча). Каждый миллимоль Н+ , экскретируемый в форме титруемых кислот и (или) ионов аммония (NH4 +) добавляет в плазму крови 1 ммоль НСО,~. Таким образом, экскреция Н+ теснейшим образом связана с синтезом НСО3~. Почечная регуляция КЩС протекает медленно и требует многих часов или даже суток для полной компенсации.
Слайд 10ПЕЧЕНЬ оказывает влияние на постоянство КЩС, метаболизируя недоокисленные продукты обмена, поступающие из желудочно-кишечного тракта, образуя мочевину из азотистых шлаков и выводя кислые радикалы с желчью. ЖЕЛУДОЧНО-КИШЕЧНЫЙ ТРАКТ занимает важное место в поддержании постоянства КЩС организма благодаря большой интенсивности процессов поступления и всасывания жидкостей, продуктов питания и электролитов. Нарушение любого звена из данного процесса вызывает неизбежное нарушение КЩС.

Слайд 11ПОКАЗАТЕЛИ КИСЛОТНО-ЩЕЛОЧНОГО СОСТОЯНИЯ КРОВИ
Показатели КЩС определяются эквилибрационным микрометодом Аструпа (с интерполяционным расчетом рСО2) или методами с прямым окислением СО2. Основой метода Аструпа является физическая взаимосвязь между компонентами, от которых зависит равновесие кислот и оснований в организме. Непосредственно в крови определяют рН и рСО2, остальные величины КЩС рассчитывают с помощью номограммы Сиггаарда-Андерсена (1960). Современные микроанализаторы все величины КЩС и парциальное напряжение газов крови определяют в автоматическом режиме.
Слайд 12Показатели номограммы Сиггаарда-Андерсена
Слайд 15ВАРИАНТЫ РАССТРОЙСТВ КИСЛОТНО- ЩЕЛОЧНОГО СОСТОЯНИЯ ОРГАНИЗМА
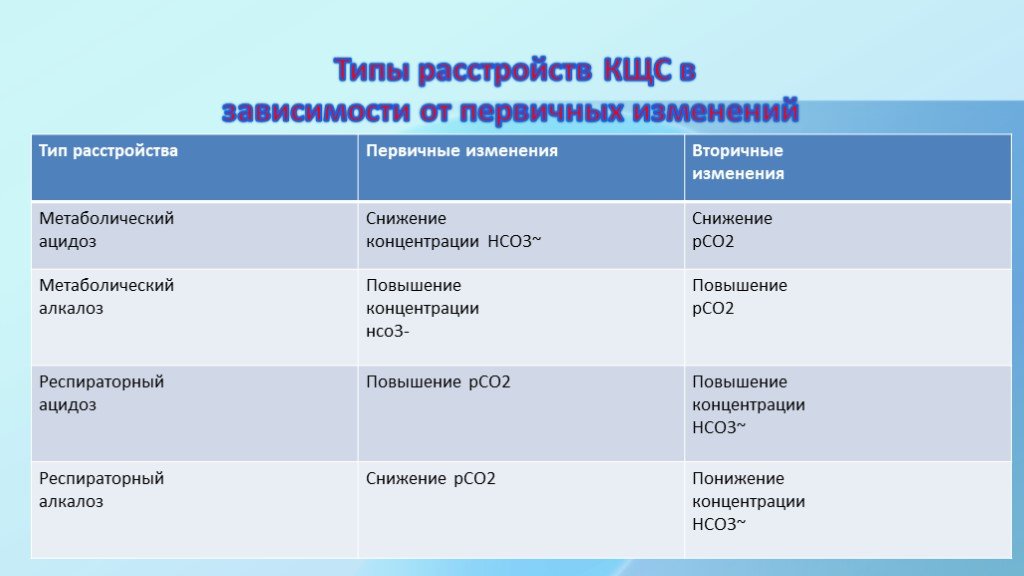
Существуют 4 основных варианта расстройства КЩС: метаболические ацидоз и алкалоз, респираторные ацидоз и алкалоз и различные их сочетания. рН 7,35-7,45 состояние компенсации рН 7,35-7,29 субкомпенсированный ацидоз рН 7,29-6,80 декомпенсированный ацидоз рН 7,80 состояние не совместимо с жизнью
Слайд 16Типы расстройств КЩС в зависимости от первичных изменений данные).
Слайд 17Метаболический ацидоз
Метаболический ацидоз вызывается снижением содержания бикарбоната в плазме крови, которое может быть вызвано следующими причинами: 1. Острая почечная недостаточность. 2. Некомпенсированный диабет (кетоацидоз). 3. Шок любой этиологии. 4. Сердечная недостаточность (молочнокислый ацидоз). 5. Отравления салицилатами, этиленгликолем, метиловым спиртом и др. 6. Повышенная потеря щелочных соков тонкой кишкой. Патогенез Содержание НСО3~ в плазме снижается, а СГ повышается. 2. Ионы К+ выходят из клетки. В обмен поступают Н+ и Na+ (на 3 К+ приходится 1 Н+ и 2 Na+). Концентрация К+ в плазме повышается, а при сохраненной функции почек его повышенное количество выводится с мочой, в итоге формируется внутриклеточная гипокалиемия на фоне нормального или несколько повышенного уровня К+ плазмы.
Слайд 18Клиника
Клинически умеренный ацидоз (BE до —10 ммоль/л) может протекать бессимптомно. При снижении рН до 7,2 заметно усиливается дыхание. При дальнейшем снижении рН подавляется активность дыхательного центра, угнетается миокард, снижается чувствительность рецепторов к катехоламинам. Производительность сердца уменьшается, МОС падает, развивается гипоксическая энцефалопатия, вплоть до развития коматозного состояния. При субкомпенсированном состоянии имеется умеренный дефицит оснований (BE до —9), на фоне компенсаторной гипервентиляции (раСО2 = 28 мм рт. ст.) и умеренного снижения уровня щелочных радикалов (АВ, SB, ВВ). В данном варианте не показано использование буферных растворов. При декомпенсированном состоянии мощный компенсаторный дыхательный алкалоз (раСО2 менее 28 мм рт. ст.) уже не в силах компенсировать большой дефицит оснований (BE менее —9) на фоне значительного снижения уровня щелочных радикалов (АВ, SB, ВВ). Для коррекции данного состояния необходимо использование буферных растворов

Слайд 19Принципы коррекции метаболического ацидоза
1. Устранение этиологического фактора (патология дыхательной и ССС, органов брюшной полости и т. д.). 2. Нормализация гемодинамики — устранение гиповолемии, восстановление микроциркуляции, улучшение реологических свойств крови. 3. Улучшение легочной вентиляции (вплоть до перехода на ИВЛ). 4. Коррекция электролитного обмена. 5. Улучшение почечного кровотока. 6. Устранение гипопротеинемии. 7. Улучшение тканевых окислительных процессов путем введения глюкозы, инсулина, тиамина, пиридоксина, рибоксина, аскорбиновой, пантотеновой и пангамовой кислот. 8. Усиление гидрокарбонатной буферной системы

Слайд 20Для коррекции метаболического ацидоза используются следующие буферные растворы
1. 4,2% раствор натрия бикарбоната с содержанием в 1 мл 0,5 ммоль бикарбоната. Данный буферный раствор довольно быстро корригирует ацидоз, но содержащиеся в нем ионы Na+ еще большеповышают осмолярность внеклеточной жидкости и усугубляют клеточную дегидратацию. Необходимо помнить и о том, что в щелочной среде нарушается процесс диссоциации хлорида кальция и внезапная гипокальциемия может привести к угнетению сократительной способности миокарда. Введение данного буфера должно быть осторожным и сочетаться с введением солей кальция (лучше глюконат кальция) и усиленным контролем гемодинамики. Скорость инфузии данного раствора — 200 мл за 30 мин. 2. 11% раствор натрия лактата с содержанием в 1 мл 1 ммоль лактата. Данный буфер мягче, чем гидрокарбонат, устраняет сдвиги КЩС, но противопоказан при гипоксии (отсутствие которой трудно представить при метаболическом ацидозе) и нарушении функции печени (которая в условиях гипоксии и ацидоза страдает едва ли не больше других органов). 3. ТНАМ (трис-буфер, 3,66% раствор трисамина) — считается довольно эффективным буфером, связывает водородные ионы как вне, так и внутри клеток, не содержит ионов Na+, выделяется почками. Однако он обладает рядом побочных эффектов (повышает уровень глюкозы в крови, вызывает внутриклеточную гипокалиемию и гиперкалийплазмию, угнетает сердечную и дыхательную деятельность). Скорость инфузии: в 1 час не более 2,5—5,0 мл/кг, в сутки до 5—14 мл/кг. 4. Лактасол — комбинированный полиэлектролитный раствор, содержащий 300 ммоль лактата в 1 л (механизм действия — анион молочной кислоты метаболизируется в печени до НСО3~, поэтому переливание лактасола аналогично использовованию бикарбоната натрия).
Слайд 21Метаболический алкалоз
Метаболический алкалоз встречается реже, чем ацидоз, вызывается повышением уровня бикарбоната в плазме и обычно сопровождается снижением содержания хлоридов плазмы. Нарушения баланса электролитов, наблюдаемые при данной патологии, по своей сути противоположны тем, которые могут наблюдаться при метаболическом ацидозе. Этиология. Метаболический алкалоз наиболее часто возникает при следующих патологических состояниях: 1. Потеря желудочного сока при рвоте. 2. Чрезмерное введение соды. 3. Проведение ИВЛ в режиме гипервентиляции. 4. В результате повышенной потери хлоридов и калия с мочой при назначении диуретиков и глюкокортикоидов. 5. Применение больших количеств цитратной крови (в печени цитрат превращается в лактат). 6. Вторичный гиперальдостеронизм из-за гиповолемии различной этиологии. 7. ОПН с замещением клеточного К+ на Н+ и повышенной реабсорбцией НСО3~. 8. Первичный гиперальдостеронизм, болезнь Иценко — Кушинга.

Слайд 22Патогенез
Опасные физиологические эффекты метаболического алкалоза: • инактивация различных ферментных систем; • смещение распределения ионов между клеткой и внеклеточным пространством; • компенсаторная гиповентиляция, которая задерживает СО2, чтобы снизить рН, однако она может закончиться ателектазированием легких и гипоксией; • смещение кривой диссоциации оксигемоглобина влево.

Слайд 23Принципы коррекции метаболического алкалоза
Прежде всего выясняют этиологический фактор возникновения данного состояния и пытаются на него воздействовать. Производится нормализация всех видов обмена. Купирование алкалоза достигается внутривенным введением растворов глюкозы с большим количеством витаминов, электролитных растворов; изотонический раствор хлорида натрия используется для уменьшения осмолярности внеклеточной жидкости и устранения клеточной дегидратации. При субкомпенсированном алкалозе такой терапии бывает достаточно для нормализации КЩС. При декомпенсированном метаболическом алкалозе, помимо вышеуказанной терапии, необходимо производить и целенаправленную коррекцию хлора. Для этого используют хлорсодержащие растворы.

Слайд 24Респираторный ацидоз
Это расстройство КЩС является следствием снижения альвеолярной вентиляции, что вызывает повышение в крови рСО2 Причинами респираторного ацидоза могут быть: 1. Депрессия дыхательного центра (травма мозга, инфекция, действие морфина, барбитуратов и др. препаратов). 2. Нарушение нервно-мышечной проводимости (миастения, полиомиелит). 3. Деформации грудной клетки (кифосколиоз). 4. Легочные заболевания (хронические обструктивные заболевания легких, астматический статус, отек легких, синдром дыхательных расстройств).
Слайд 25В клинической картине дыхательного ацидоза преобладают симптомы интракраниальной гипертензии, которые возникают из-за церебральной вазодилатации, вызываемой избытком СО2. Персистирующий респираторный ацидоз раньше или позже приводит к отеку мозга, выраженность которого соответствует степени гиперкапнии. Нередко развивается сопор с переходом в кому. При дыхании воздухом гиперкапния сочетается со снижением альвеолярного рО2 и гипоксемией.

Слайд 26Основу лечения респираторного ацидоза составляет перевод больного на ИВЛ
У некоторых больных при переводе на ИВЛ и устранении симптомов гипоксии ухудшение состояния может быть обусловлено СО2-наркозом и последующим морфологическим поражением большего или меньшего количества нейронов. В тех случаях, когда предполагается перевод больного на ИВЛ, следует предусмотреть необходимость постепенного снижения рСО2. Если это условие не соблюдается, то возникающий в постгиперкапническом периоде метаболический алкалоз цереброспинальной жидкости приводит к поражению ЦНС с развитием судорог и другими неврологическими симптомами.

Слайд 27Респираторный алкалоз
Данное состояние характеризуется снижением уровня рСО2, возникающим в результате альвеолярной гипервентиляции. Этиология. Основными причинами респираторного алкалоза являются: 1. Травма головного мозга с вовлечением дыхательного центра, инфекция, новообразования мозга. 2. Метаболические расстройства (печеночная недостаточность, грамотрицательный сепсис, передозировка салицилатов, лихорадка). 3. Нарушения дыхательной функции легких (пневмония, status asthmaticus I ст., начальный этап тромбоэмболии легочной артерии,застойная сердечная недостаточность). 4. Длительная ИВЛ в режиме гипервентиляции.

Слайд 28Клиника Ведущим патогенетическим звеном респираторного алкалоза является снижение объемного мозгового кровотока в результате повышения тонуса мозговых сосудов, что является следствием дефицита СО2 в крови. На первоначальных этапах у больного могут отмечаться парестезии кожи конечностей и вокруг рта, мышечные спазмы в конечностях, легкая или выраженная сонливость, головная боль, иногда более глубокие нарушения сознания, вплоть до комы. Неотложная помощь заключается в воздействии на патогенетический фактор, вызвавший гипервентиляцию и гипокапнию (например, купировать status asthmaticus I ст.).
Слайд 29Три золотых правила Ассоциации кардиологов США
Изменение pCO2 крови на 10 мм рт.ст. обусловливает реципрокное снижение pH на 0,08. Изменение pH на 0,15 является результатом изменения концентрации буферных оснований на 10 ммоль/л. Общий дефицит оснований в организме (ммоль/л) = ВЕ, определенный на основе второго правила (ммоль/л)·1/4 массы тела (кг).
Слайд 30Спасибо за внимание!