Презентация "Способы защиты от коррозии металлов" по химии – проект, доклад
Презентацию на тему "Способы защиты от коррозии металлов" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 25 слайд(ов).
Слайды презентации
Список похожих презентаций
Изучение коррозии и защиты металлов
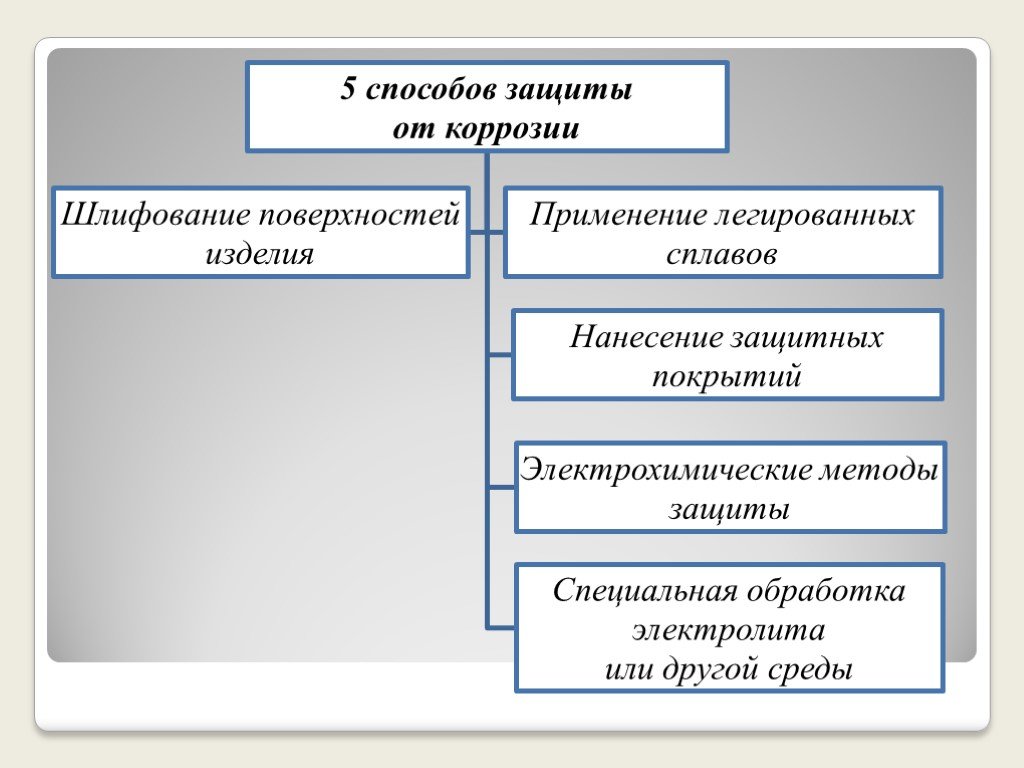
Цель. Изучение проблемы коррозии металлов и исследование коррозийной стойкости металлов и способов их защиты. Задачи. изучить литературу по теме исследований; ...Коррозия металлов и способы ее устранения
Коррозия (от лат. сorrodere – «разъедать») – химическое и электрохимическое разрушение металлов и их сплавов в результате воздействия на них окружающей ...«Нуклеиновые кислоты» химия
Цель урока: сформировать у студентов понимание взаимосвязанности и взаимозависимости веществ в клетке. Задачи урока: повторить строение и основные ...Азот химия
План урока:. История открытия Цели Нахождение в природе Строение и свойства атома и молекулы Физические и химические свойства Получение и применение ...История металлов
Цель:. Рассказать об открытии металлов. Гипотеза:. Возможно открытие металлов никак не повлияло на развитие цивилизаций. Медь. История цивилизаций ...Коррозия металлов и её виды
Коррозия - это процесс самопроизвольного разрушения металлов и сплавов под влиянием факторов внешней среды. Закладка эксперимента. Лабораторный опыт ...Коррозия металлов
В настоящее время мы являемся свидетелями разрушения архитектурных сооружений и конструкций. От кислотных дождей катастрофически страдают памятники ...Коррозия металлов
«Ржа ест железо». . По виду коррозионной среды. газовая; жидкостная: - кислотная, щелочная, - солевая; атмосферная; почвенная. По характеру разрушения. ...Коррозия металлов
Коррозия – от лат. corrodere - разъедать. Ежегодно 1/4 всего произведенного Fe теряется из-за коррозии. Химически чистое железо не ржавеет, т.к. не ...Коррозия металлов
Зачем нужны металлы? Что вы узнаете (план изучения темы). Физические свойства металлов. Химические свойства металлов. Mеталлы в нашей жизни. Металлическая ...Коррозия металлов
Коррозия – рыжая крыса, Грызет металлический лом. В Шефнер. - называют самопроизвольное разрушение металлов и сплавов под влиянием окружающей среды ...Коррозия металлов
Цель. Исследовать действие факторов окружающей среды на степень ржавления металлов. Гипотеза Если поместить железо в щелочную среду, то скорость коррозии ...Качественные реакции на ионы металлов
Проблемный вопрос: каким образом можно определить ионы металлов в растворах. Цель работы: научиться определять ионы металлов Задачи: расширить знания ...Изучение свойств оксидов металлов
Цель: определить характер оксидов металлов, имеющихся в школьной лаборатории (оксиды бария, железа, кальция, меди, свинца), изучить их свойства. Задачи: ...Изучение реакции среды в зависимости от типа гидролиза соли
Лабораторная работа Изучение реакции среды в зависимости от типа гидролиза соли. Цели: понять сущность гидролиза. научиться определять реакцию и тип ...Горение металлов
Свойства летучих горючих металлов и их оксидов. На способность металлов возгораться и гореть большое влияние оказывают химические и физические свойства ...Изменение качества растительных масел в зависимости от условий хранений
ОБЪЕКТАМИ ИССЛЕДОВАНИЯ:. 1)Масло подсолнечное «Аведовъ» 2)Масло подсолнечное «Благо» 3)Масло оливковое «Lorado» 4)Масло подсолнечное «Золотая семечка» ...Защита зоны электродуговой сварки от окисления
Окисление. В зоне сварки кислород является наиболее вредной примесью, так как окисляет элементы, которые входят в состав металла шва, и ухудшает его ...Грозит ли миру военный конфликт из-за металлов?
Плотность металлов. Металлы Лёгкие ρ5 гр/см3. Вся авиационная техника построена на основе сплавов лёгких металлов. Ртуть плотность - 14,19 г/см3. ...Влияние тяжёлых металлов на человека
Методика исследования. При взаимодействии ионов тяжелых металлов с иодидом калия образуются осадки разной окраски: Pb + 2 + 2 I - = PbI 2 ↓ (желтый) ...Конспекты
Коррозия металлов и способы защиты от нее
Урок № 37 9 кл. Тема: Коррозия металлов и способы защиты от нее. Цель: сформировать понятие о коррозии металлов, рассмотреть классификацию коррозионных ...Понятие о металлургии. Способы получения металлов. Сплавы (сталь, чугун, дюралюминий, бронза). Проблема безотходных производств в металлургии и охрана окружающей среды
Дата_____________ Класс_______________. Тема:. Понятие о металлургии. Способы получения металлов. Сплавы (сталь, чугун, дюралюминий, бронза). Проблема ...Основные месторождения металлов и неметаллов в Казах¬стане и проблемы защиты окружающей среды при процессах добычи и переработке сырья
Урок №20, химия 10 класс. тема: Основные месторождения металлов и неметаллов в Казахстане. и проблемы защиты окружающей среды при процессах добычи ...Общие способы получения металлов
Тема:. "Общие способы получения металлов" 9-класс. Цель урока. :. познакомить с природными соединениями металлов и с самородными металлами; дать ...Практическая работа № 1 Получение и свойства соединений металлов
Лысоконь Ирина Алексеевна. МБОУ СОШ № 2 ст. Архонская Пригородного района РСО-Алания. Учитель химии. Тема урока: Практическая работа № 1 Получение ...Коррозия металлов и сплавов как результат и фактор загрязнения окружающей среды, меры по предупреждению коррозии
Коррозия металлов и сплавов как результат и фактор загрязнения окружающей среды, меры по предупреждению коррозии. Цели:. сформировать представление ...Общие свойства металлов
Муниципальное бюджетное образовательное учреждение. «СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 3». Конспект урока по химии в 9 классе. «Общие ...Гидроксиды металлов
Гидроксиды металлов. . ГИДРОКСИДЫ Ме. . . ОСНОВАНИЯ. . АМФОТЕРНЫЕ. . . КИСЛОТЫ. . . . РАСТВОРИМЫЕ ИЛИ ЩЕЛОЧИ. ...Роль металлов и их соединений в природной среде и в живых организмах
Дата. . . Предмет химия. . Класс 9 Урок 45. . . . Название занятия. . . Роль металлов и их соединений в природной среде. и в живых ...Причины мутаций. Пути атимутационной защиты
Методическая разработка интегрированного урока по химии и биологии в 11 классе с использованием ИКТ. Тема. : «Причины мутаций. Пути атимутационной ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:5 сентября 2018
Категория:Химия
Содержит:25 слайд(ов)
Поделись с друзьями:
Скачать презентацию