Презентация "Химическая связь. Ионная химическая связь" по химии – проект, доклад
Презентацию на тему "Химическая связь. Ионная химическая связь" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 26 слайд(ов).
Слайды презентации
Список похожих презентаций
Ионная химическая связь
Катионы – положительно заряженные ионы. Их образуют атомы, в которых мало валентных электронов и они слабо связаны с ядром. Это атомы щелочных и щелочноземельных ...Ионная химическая связь
Цель урока. обобщить и систематизировать знания о видах химической связи и их классификации как о важнейшем универсальном понятии теоретической химии. ...Ионная связь как химическая связь
ХИМИЧЕСКАЯ СВЯЗЬ -. сила, связывающая атомы в молекулы или другие частицы. - совокупность электростатических сил притяжения, связывающих атомы друг ...Ионы и ионная химическая связь
Проверка знаний.Какие изменения происходят в строении внешней электронной оболочки элементов одного периода и одной группы? Как изменяется число ...
Химическая связь и её типы
Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы. Ионная химическая связь. это ...Строение атома Химическая связь
Девиз урока:. Дорога к знанию? Ну, что же, ее легко понять. Ответить можно сразу: Вы ошибаетесь и ошибаетесь, И ошибаетесь опять, но меньше, меньше, ...Химическая связь
Химическая связь. Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы. Типы химической ...Понятие о валентности и химической связи. Ковалентная химическая связь
Химическая связь – это силы взаимодействия, которые соединяют отдельные атомы в молекулы, ионы, кристаллы. Способность атома элемента образовывать ...Химическая связь в комплексных соединениях
Альфред Вернер – первым попытался объяснить химическую связь в комплексных соединениях. 1893 г. – статья Вернера «О строении неорганических соединений». ...Химическая связь
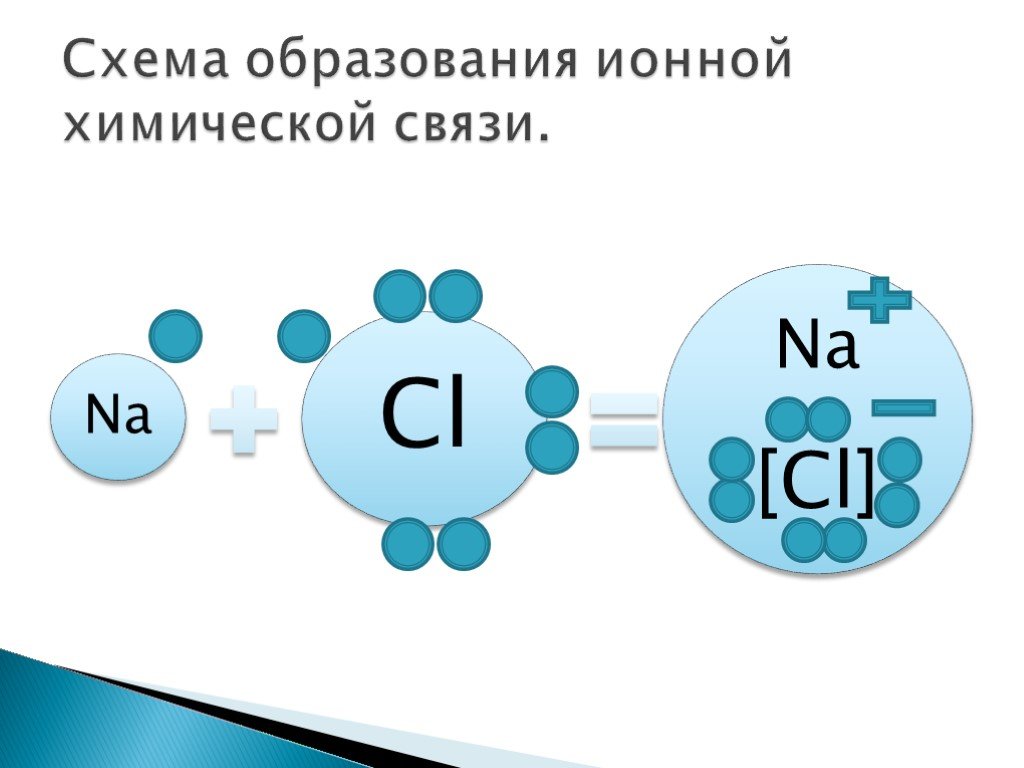
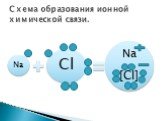
Ионная связь металл + неметалл Na + 11 )2)8) 1 Cl + 17 )2)8) 7 8 + –.Электростатическое притяжение.
Na+ Cl- ионы. Свойства ионной связи.
ненаправленная, ...
Химическая связь
Энергетическая диаграмма двух постепенно сближающихся атомов А + А = А2 + энергия выделяется!!! 1 – расстояние большое, энергия взаимодействия близка ...Химическая связь. Метод молекулярных орбиталей.
Метод молекулярных орбиталей (МО) наиболее нагляден в его графической модели линейной комбинации атомных орбиталей (ЛКАО). Метод МО ЛКАО основан на ...Металлическая химическая связь
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов ...Ковалентная химическая связь
Химический диктант.Валентность – это ……. Валентные электроны – это Высшая валентность по кислороду равна ……….. Низшая валентность по водороду равна ...
Химическая связь и строение атома
Понятие о химической связи. Химическая связь – это связь между атомами, обеспечивающая существование веществ с четко определенным составом. При образовании ...Строение атома, химическая связь
Цель урока:. Обобщить и систематизировать знания по теме «Строения атома, химическая связь». Задание № 1 Определите химический элемент по распределению ...Ковалентная полярная химическая связь
29/01/19. Тема: Ковалентная полярная химическая связь. I. Ковалентная связь. Химическая связь, возникающая в результате образования общих электронных ...Химическая связь
Учащиеся должны знать: определение понятия химическая связь, виды химической связи, механизмы образования каждого вида связи. Учащиеся должны уметь: ...Ионы. Ионная связь
Почему атомы соединяются друг с другом? +1. Что является результатом отдачи электронов? Положительный ион - катион. 1+ Н -1е = Н+. 1-. Что является ...Ионная связь. Вещества ионного немолекулярного строения
Цель урока:. Изучить новый вид химической связи - ионную связь. Дать представление об условиях и механизме ее образования. Сформировать понятия о ...Конспекты
Ковалентная полярная химическая связь
Конспект урока химии. Тема 11:. . Ковалентная полярная химическая связь. . . Цель урока:. изучить механизм образования ковалентной неполярной ...Химическая связь. Строение вещества
Тема: Систематизация и обобщение знаний по теме «Химическая связь. Строение вещества». (стр. флипчарта 1 скрыть / показать). Цель:. . обобщить и ...Химическая связь. Строение вещества. Кристаллические решетки
Дата ____________ Класс _____________. Тема: Химическая связь. Строение вещества. Кристаллические решетки. Цели урока:. закрепить и повторить ...Строение атома. Химическая связь
Учитель: Язрикова Л.М. Предмет Химия. Класс 8 класс. Тема урока Обобщение по теме: «Строение атома. Химическая связь». Место темы в учебном ...ПЗ и ПСХЭ Д.И.Менделеева. Химическая связь
9 класс Дата_________. Урок 1. Тема урока: ПЗ и ПСХЭ Д.И.Менделеева. Химическая связь. . Цель: 1. Обобщить, повторить, закрепить теоретические ...Ковалентная химическая связь
Г. Гуково Ростовской области. Конспект урока по химии. . 8 класс. Тема урока «Ковалентная химическая связь». Подготовила Берлизова Юлия ...Ковалентная химическая связь
Муниципальное Автономное Образовательное Учреждение. . Ветлужская Основная Общеобразовательная Школа. Конспект урока химии. ...Ионная связь
Конспект урока химии. Тема 9:. . Ионная связь. . . Цель урока:. изучить строение ионной связи. Задачи:. Образовательные:. . - сформировать ...Основные классы неорганических соединений. Генетическая связь классов неорганических соединений
Муниципальное бюджетное образовательное учреждение. «Жарынская средняя (полная) общеобразовательная школа». План-конспект открытого ...Металлическая связь
Тема урока:. «Металлическая связь». Тип урока:. Изучение нового материала. . Вид занятия:. Комбинированный урок. . Цель урока. : Сформировать ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:18 сентября 2018
Категория:Химия
Содержит:26 слайд(ов)
Поделись с друзьями:
Скачать презентацию