Презентация "Химическая связь и строение атома" по химии – проект, доклад
Презентацию на тему "Химическая связь и строение атома" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 19 слайд(ов).
Слайды презентации
Список похожих презентаций
Строение атома Химическая связь
Девиз урока:. Дорога к знанию? Ну, что же, ее легко понять. Ответить можно сразу: Вы ошибаетесь и ошибаетесь, И ошибаетесь опять, но меньше, меньше, ...Строение атома, химическая связь
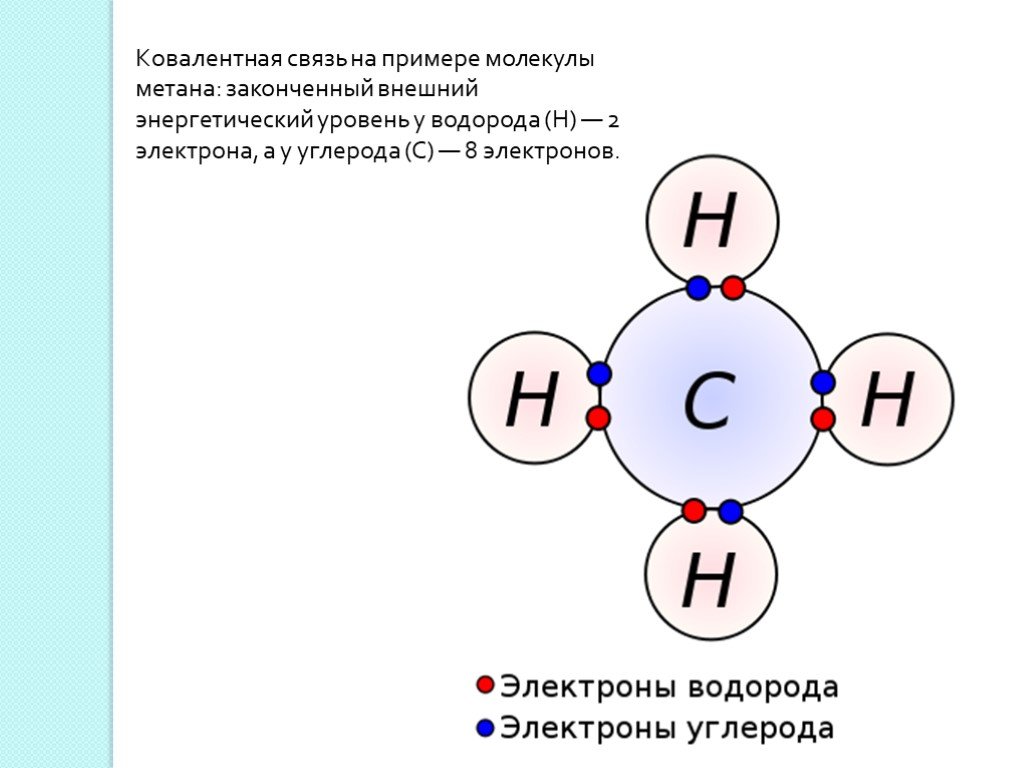
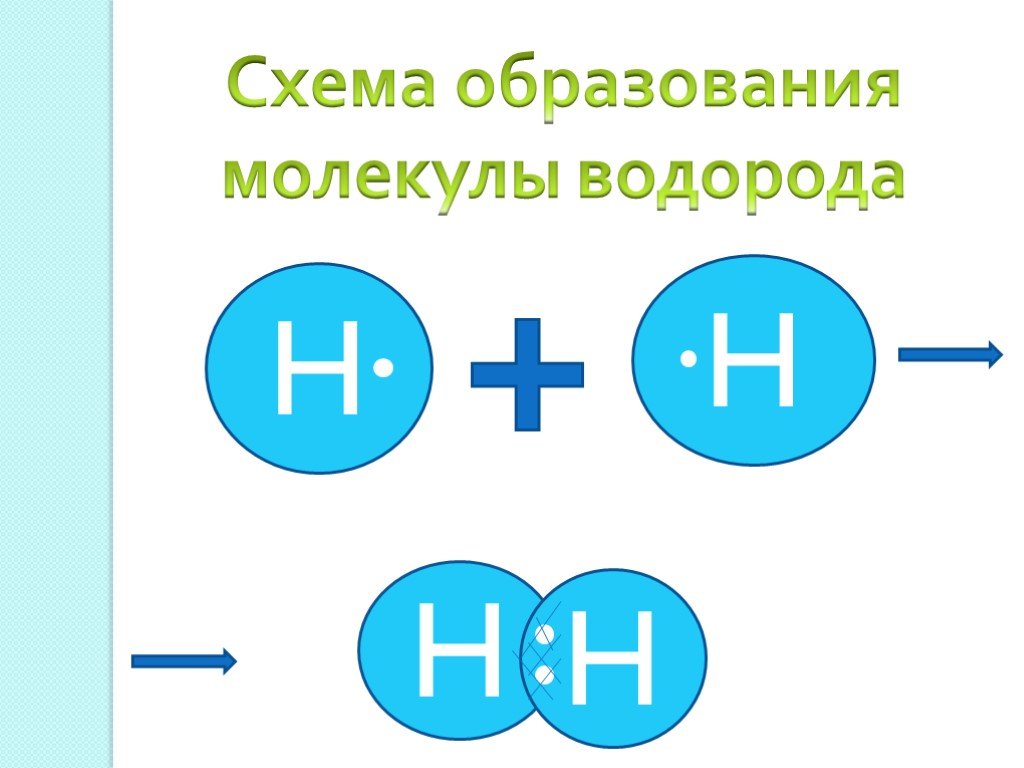
Цель урока:. Обобщить и систематизировать знания по теме «Строения атома, химическая связь». Задание № 1 Определите химический элемент по распределению ...Понятие о валентности и химической связи. Ковалентная химическая связь
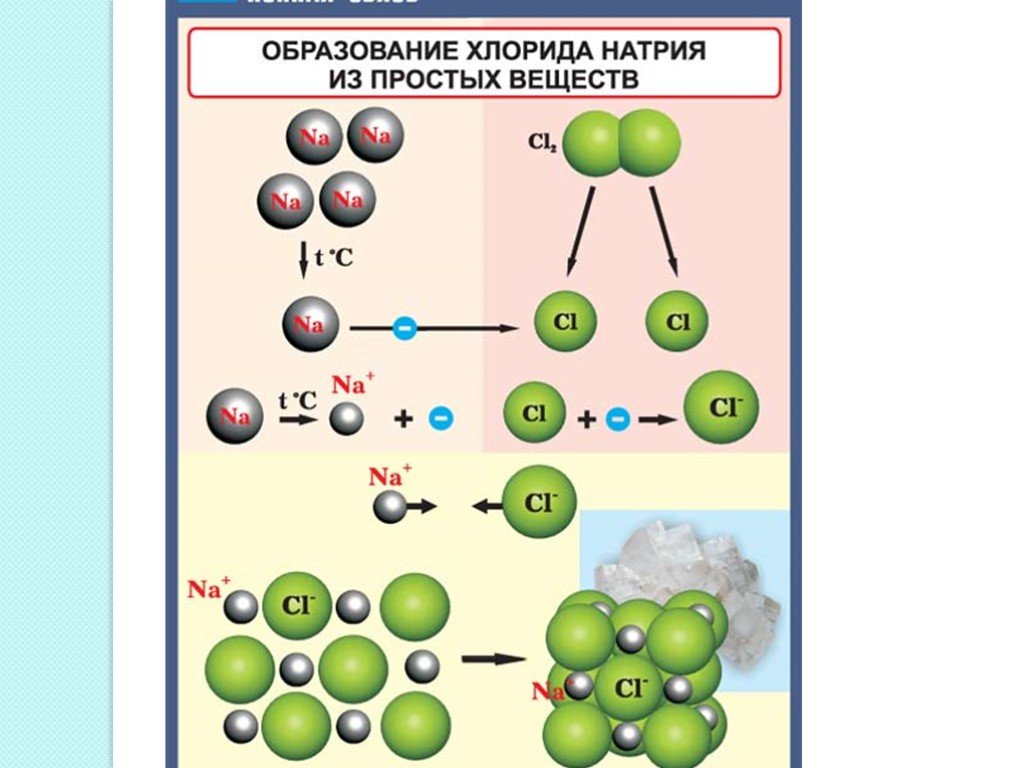
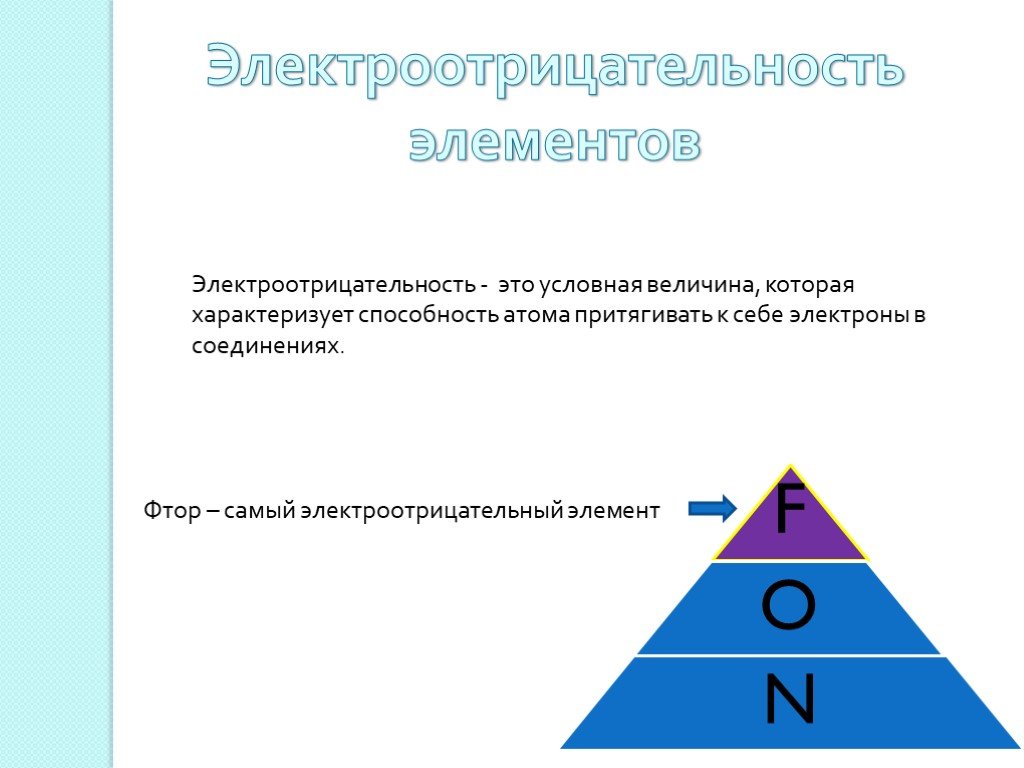
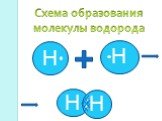
Химическая связь – это силы взаимодействия, которые соединяют отдельные атомы в молекулы, ионы, кристаллы. Способность атома элемента образовывать ...Химическая связь. Ионная химическая связь
Задачи урока: Изучить виды химической связи в теме «строение вещества», на данном уроке разобрать причины и механизмы образования ионной связи. Познакомить: ...Химическая связь. Метод молекулярных орбиталей.
Метод молекулярных орбиталей (МО) наиболее нагляден в его графической модели линейной комбинации атомных орбиталей (ЛКАО). Метод МО ЛКАО основан на ...Химическая связь
Энергетическая диаграмма двух постепенно сближающихся атомов А + А = А2 + энергия выделяется!!! 1 – расстояние большое, энергия взаимодействия близка ...Химическая связь и её типы
Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы. Ионная химическая связь. это ...Химическая связь в комплексных соединениях
Альфред Вернер – первым попытался объяснить химическую связь в комплексных соединениях. 1893 г. – статья Вернера «О строении неорганических соединений». ...Химическая связь
Химическая связь. Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы. Типы химической ...Химическая связь
Учащиеся должны знать: определение понятия химическая связь, виды химической связи, механизмы образования каждого вида связи. Учащиеся должны уметь: ...Подготовка к ЕГЭ "Строение атома"
Число электронов во внешнем электронном слое атома, ядро которого содержит 8 протонов, равно. 1) 8 2) 2 3) 6 4) 4. Число электронов в ионе железа ...Химическая связь
Ионная связь металл + неметалл Na + 11 )2)8) 1 Cl + 17 )2)8) 7 8 + –.Электростатическое притяжение.
Na+ Cl- ионы. Свойства ионной связи.
ненаправленная, ...
Периодическая система химических элементов Д.И. Менделеева и строение атома
Цель:. Повторить основные теоретические вопросы программы 8 класса; Закрепить знания о причинах изменения свойств химических элементов на основании ...Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома
ДЕВИЗ УРОКА:. Чтобы стать настоящим химиком, надо знать, уметь, думать!". ЭПИГРАФ УРОКА:. «… Другого ничего в природе нет, Ни здесь, ни там, в космических ...Строение атома и периодическая система химических элементов
Е 1s 3s 4s 3p 4p 3d n = 1 n = 2 n = 3 n = 4. Энергетическая диаграмма АО для многоэлектронных атомов. Многоэлектронные атомы. 1s. Порядок заполнения ...Строение атома. Периодический закон Д.И.Менделеева в свете теории строения атома
Родители атома. Демокрит (460 до н. э. — 370 до н. э.). Джозеф Джон Томсон (1856–1940 г). Эрнест Резерфорд (1871–1937г). Джеймс Чедвик (1891–1974г). ...Строение атома углерода
↓ ↓↑. Валентность углерода IV. Валентность углерода II. Строение атома углерода. 6 С 2е4е 1S2 2S2 2P2 6 С 2е4е 1S2 2S1 2P3. Гибридизация. Гибридизация ...Строение атома и его свойства
Атом какого химического элемента имеет приведенную ниже схему строения? 1) аргона 2) кислорода 3) серы 4) кальция. . Сколько электронов находится ...Строение атома и периодическая система
Какие открытия сделали ученые? 1. И.В. Деберейнер 2. А. Шанкуртуа 3. Л. Мейер 4. Д. Ньюлендс 5. М. Складовская - Кюри 6. А. Беккерель 7. Э. Резерфорд ...Строение атома
СТРОЕНИЕ АТОМА. Студент должен:. Знать: Основные положения теории строения атома (ядра и состояния электронов), формулировку периодического закона ...Конспекты
Строение атома. Химическая связь
Учитель: Язрикова Л.М. Предмет Химия. Класс 8 класс. Тема урока Обобщение по теме: «Строение атома. Химическая связь». Место темы в учебном ...Химическая связь. Строение вещества
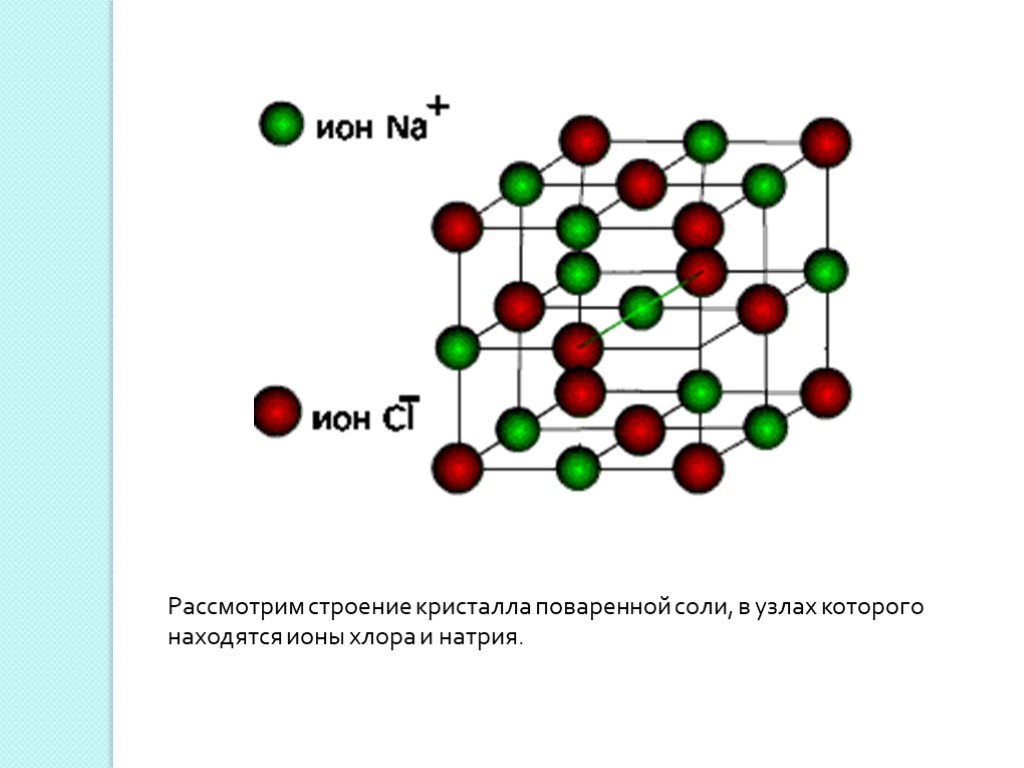
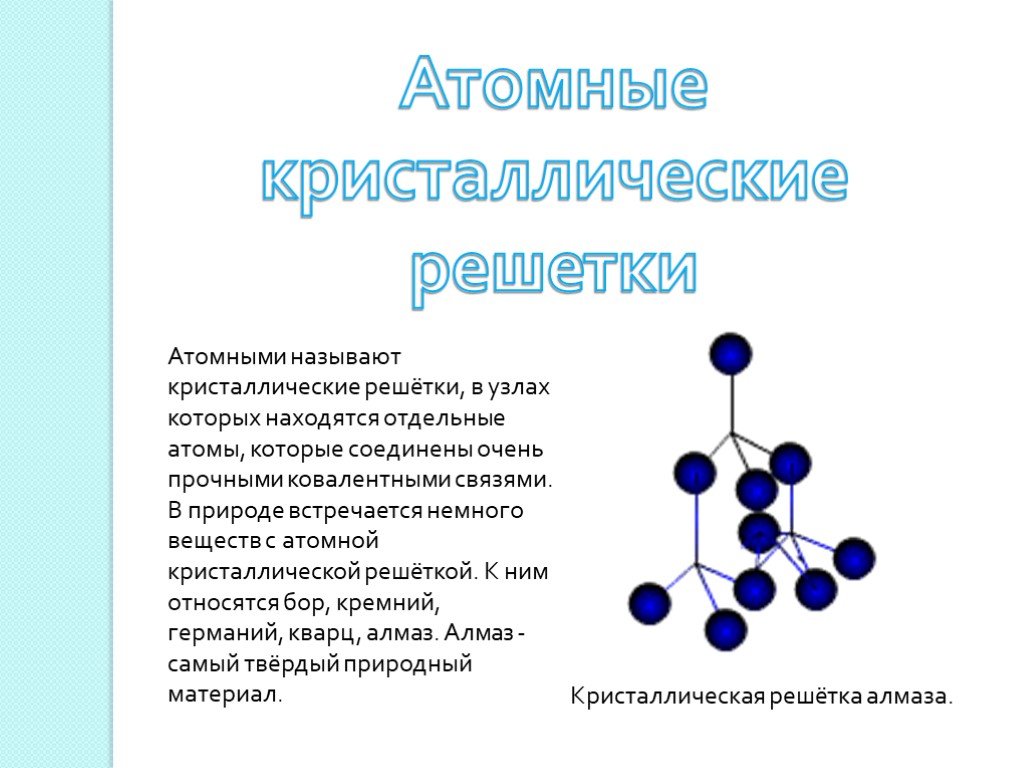
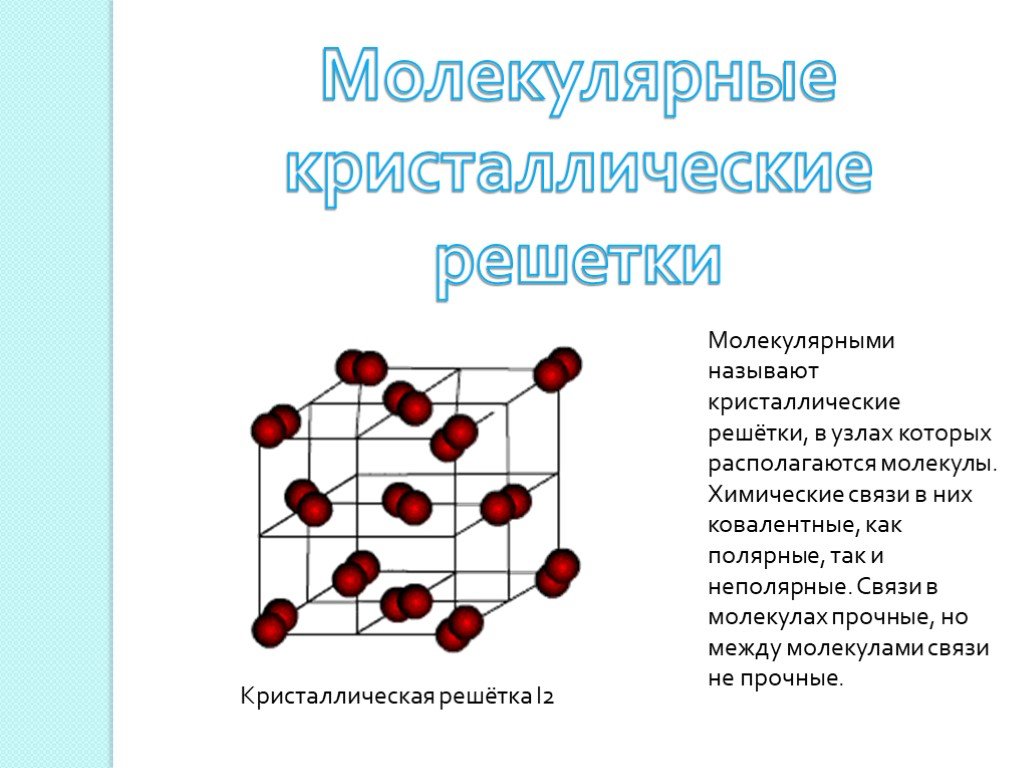
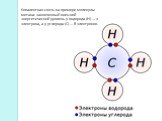
Тема: Систематизация и обобщение знаний по теме «Химическая связь. Строение вещества». (стр. флипчарта 1 скрыть / показать). Цель:. . обобщить и ...Химическая связь. Строение вещества. Кристаллические решетки
Дата ____________ Класс _____________. Тема: Химическая связь. Строение вещества. Кристаллические решетки. Цели урока:. закрепить и повторить ...Алюминий. Положение алюминия в периодической системе и строение его атома. Нахождение в природе. Физические и химические свойства алюминия
Дата_____________ Класс_______________. Тема: Алюминий. Положение алюминия в периодической системе и строение его атома. Нахождение в природе. Физические ...Алюминий. Положение алюминия в периодической системе и строение его атома. Нахождение в природе
МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ. ОБЩАЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 81. Алюминий. Положение алюминия в периодической ...Алюминий. Строение атома, физические и химические свойства простого вещества
ПЛАН-КОНСПЕКТ УРОКА. Тема: Алюминий. Строение атома, физические и химические свойства простого вещества. . . ФИО (полностью). . Иванова ...Ковалентная химическая связь
Муниципальное Автономное Образовательное Учреждение. . Ветлужская Основная Общеобразовательная Школа. Конспект урока химии. ...Азот положение в ПСХЭ. Строение атома и молекулы. Физические и химические свойства
Опорный конспект по теме: «Азот положение в ПСХЭ. . Строение атома и молекулы. Физические и химические свойства. I. .Положение азота в ПСХЭ:. ...Строение атома
Урок по теме: «Строение атома». Задачи урока:. Образовательные. : сформировать представления о строении атома; дать понятие протон, электрон, ...Азот. Строение атома и молекулы, свойства простого вещества
Тема урока. «. Азот. Строение атома и молекулы, свойства простого вещества. » 9-й класс. . Цель урока:. . . изучение строения атома и молекулы ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:31 декабря 2018
Категория:Химия
Содержит:19 слайд(ов)
Поделись с друзьями:
Скачать презентацию