Презентация "Строение атома" по химии – проект, доклад
Презентацию на тему "Строение атома" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 21 слайд(ов).
Слайды презентации
Список похожих презентаций
Строение атома и атомного ядра
1896 г. Анри Беккерель (франц.) открыл явление радиоактивности. Радиоактивность – способность атомов к самопроизвольному излучению. 1899 г. Эрнест ...Строение атома
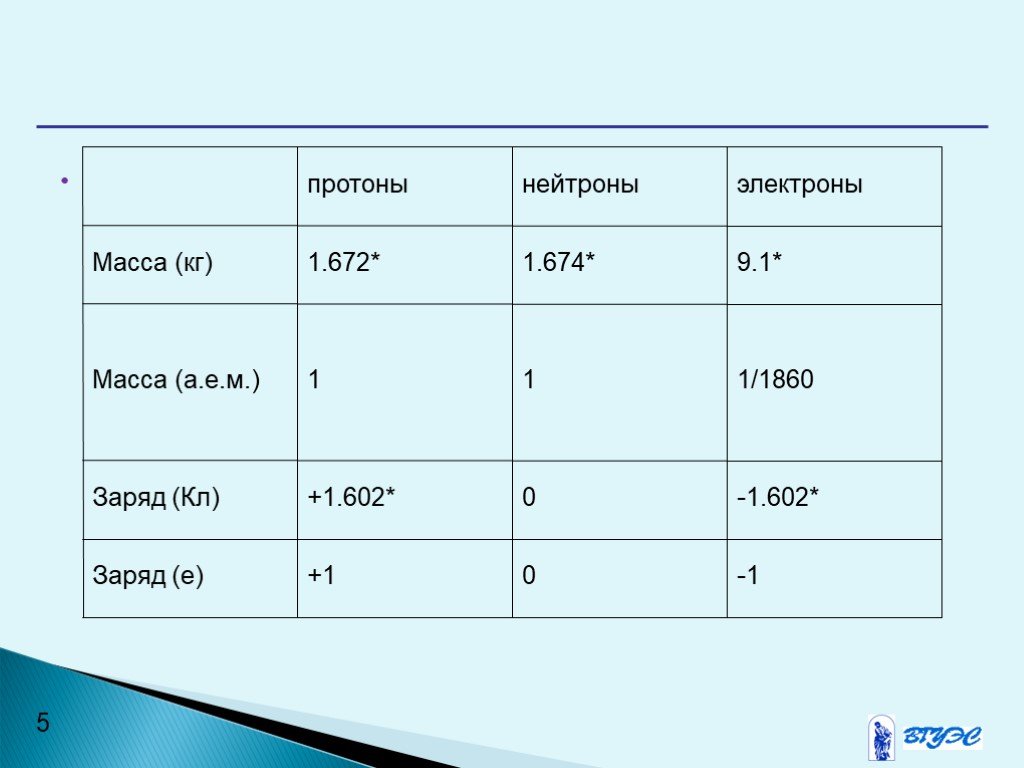
Химический элемент-это определенный вид атомов. Модель атома Резерфорда. протоны электроны нейтроны. Характеристики элементарных частиц. Количество ...Строение атома
Маленькая точка, сделанная карандашом, состоит из огромного количества атомов, большего, чем количество жителей на Земле ! Демокрит. В основе философии ...Строение атома и периодическая система
Какие открытия сделали ученые? 1. И.В. Деберейнер 2. А. Шанкуртуа 3. Л. Мейер 4. Д. Ньюлендс 5. М. Складовская - Кюри 6. А. Беккерель 7. Э. Резерфорд ...Строение атома
Планетарная модель атома. электрон +. Общий заряд атома равен 0. - 3. Сравнение размеров ядра и электрона. Распределение электронов по электронным ...Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома
ДЕВИЗ УРОКА:. Чтобы стать настоящим химиком, надо знать, уметь, думать!". ЭПИГРАФ УРОКА:. «… Другого ничего в природе нет, Ни здесь, ни там, в космических ...Подготовка к ЕГЭ "Строение атома"
Число электронов во внешнем электронном слое атома, ядро которого содержит 8 протонов, равно. 1) 8 2) 2 3) 6 4) 4. Число электронов в ионе железа ...Строение атома и периодическая система химических элементов
Е 1s 3s 4s 3p 4p 3d n = 1 n = 2 n = 3 n = 4. Энергетическая диаграмма АО для многоэлектронных атомов. Многоэлектронные атомы. 1s. Порядок заполнения ...Строение атома углерода
↓ ↓↑. Валентность углерода IV. Валентность углерода II. Строение атома углерода. 6 С 2е4е 1S2 2S2 2P2 6 С 2е4е 1S2 2S1 2P3. Гибридизация. Гибридизация ...Строение атома Химическая связь
Девиз урока:. Дорога к знанию? Ну, что же, ее легко понять. Ответить можно сразу: Вы ошибаетесь и ошибаетесь, И ошибаетесь опять, но меньше, меньше, ...Строение атома, химическая связь
Цель урока:. Обобщить и систематизировать знания по теме «Строения атома, химическая связь». Задание № 1 Определите химический элемент по распределению ...Строение атома и его свойства
Атом какого химического элемента имеет приведенную ниже схему строения? 1) аргона 2) кислорода 3) серы 4) кальция. . Сколько электронов находится ...Строение атома. Периодический закон Д.И.Менделеева в свете теории строения атома
Родители атома. Демокрит (460 до н. э. — 370 до н. э.). Джозеф Джон Томсон (1856–1940 г). Эрнест Резерфорд (1871–1937г). Джеймс Чедвик (1891–1974г). ...Периодическая система химических элементов Д.И. Менделеева и строение атома
Цель:. Повторить основные теоретические вопросы программы 8 класса; Закрепить знания о причинах изменения свойств химических элементов на основании ...Таблица Менделеева и строение атома
Элементы, атомы которых легко отдают ē для получения завершённого электронного уровня наз. металлами. Na + 11 8ē 1ē Mg ē. В. Что легче отдать 7ē или ...Химическая связь и строение атома
Понятие о химической связи. Химическая связь – это связь между атомами, обеспечивающая существование веществ с четко определенным составом. При образовании ...Строение и свойства предельных и непредельных углеводородов
Разминка. I I Вариант. 1.Углеводороды, содержащие. только простые связи. 2.Вещесва, сходные по строению, но отличающие на одну или несколько групп ...Строение и свойства белков
Строение белков. Белки состоят из остатков аминокислот, соединенных пептидными связями, отсюда их второе название- полипептиды. Белки имеют четыре ...Основные сведения о строении атома
I вариант II вариант. 1) Запишите названия химических элементов, разделив их на металлы и неметаллы, укажите значения Аr для элементов, названия которых ...Структура ячейки на примере атома железа
Периоды Группы 1 3 4 5 6 7 I II III IV V VII VIII VI малые большие А Б. Условная граница от бора до астата. Бор Кремний Мышьяк Теллур Астат Металлы ...Конспекты
Строение атома
Урок химии в 8 классе. Тема: «Строение атома». Цель урока:. формировать понятия -атом, орбиталь, изотопы, протон, нейтрон, электрон, умение работать ...Строение атома
Контрольная работа по теме «Строение атома». Часть А. 1. Определите химический элемент по составу его атома - 18 p. +. , 20 n. 0. , 18 e. -. :. ...Строение атома
Тема урока: “Строение атома”. Тип урока:. урок ознакомления с новым материалом. . . Цель:. дать понятие о составе атома и составе атомного ядра; ...Строение атома
Урок по теме: «Строение атома». Задачи урока:. Образовательные. : сформировать представления о строении атома; дать понятие протон, электрон, ...Строение атома. Химическая связь
Учитель: Язрикова Л.М. Предмет Химия. Класс 8 класс. Тема урока Обобщение по теме: «Строение атома. Химическая связь». Место темы в учебном ...Строение атома. Состав атомных ядер
Тема урока: Строение атома. Состав атомных ядер. Цель урока. . Доказать делимость атома на основе изучения научных данных, . ...Строение атома. Электронные оболочки атомов
Урок повторение по теме:. «Строение атома. Электронные оболочки атомов». Учитель химии высшей категории Жансеитова Ф.М.,. . сш№ 9, г. Тараз. ...Алюминий. Строение атома, физические и химические свойства простого вещества
ПЛАН-КОНСПЕКТ УРОКА. Тема: Алюминий. Строение атома, физические и химические свойства простого вещества. . . ФИО (полностью). . Иванова ...Фосфор. Положение в п.с. Строение атома. Физические и химические свойства
Тема. Фосфор. Положение в п.с. Строение атома. Физические и химические свойства. Фосфор как элемент и простое вещество. Тип урока. – Комбинированный, ...Азот. Строение атома и молекулы, свойства простого вещества
Тема урока. «. Азот. Строение атома и молекулы, свойства простого вещества. » 9-й класс. . Цель урока:. . . изучение строения атома и молекулы ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:31 декабря 2018
Категория:Химия
Содержит:21 слайд(ов)
Поделись с друзьями:
Скачать презентацию