Презентация "Комплексные соединения" по химии – проект, доклад
Презентацию на тему "Комплексные соединения" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 26 слайд(ов).
Слайды презентации
Список похожих презентаций
Комплексные соединения палладия в промышленных каталитических системах
Катализ. Производство аммиака, серной и азотной кислот. Гидрогенизация жиров, превращение бензола в циклогексан и др. Комплексные соединения палладия. ...Комплексные соединения
Что такое комплексные соединения? Как они образуются? . NH3, H2O, CO2, KI, HgCl2, CoCl2, …. валентнонасыщенные мол-лы (соединения первого порядка):. ...Комплексные соединения
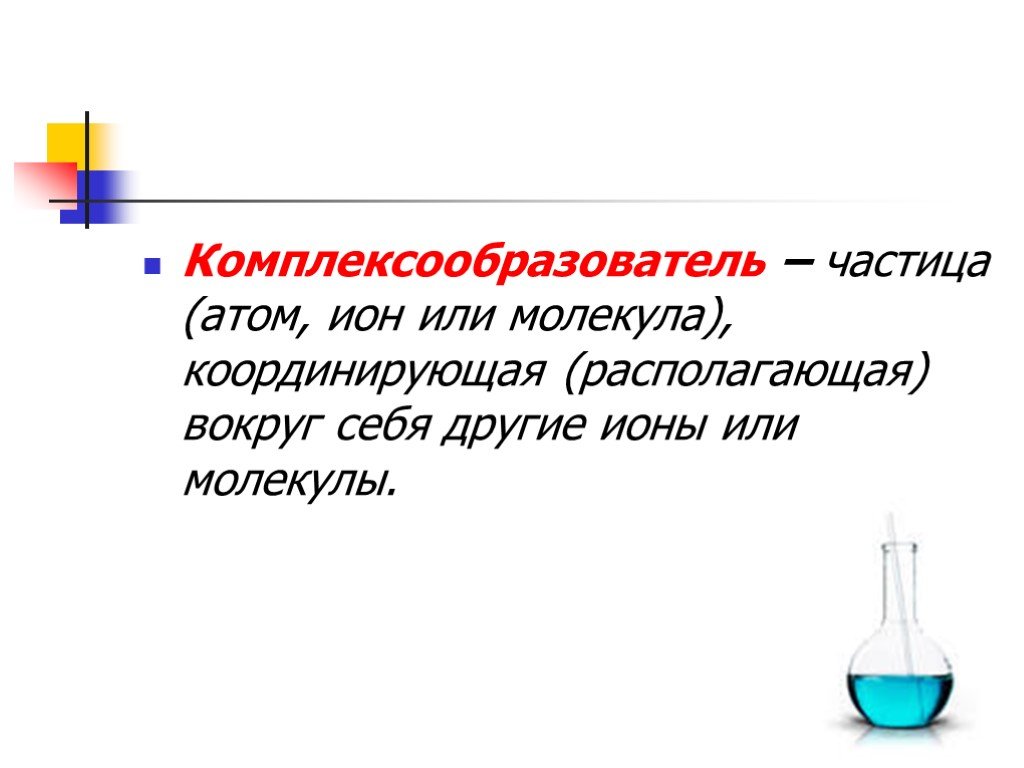
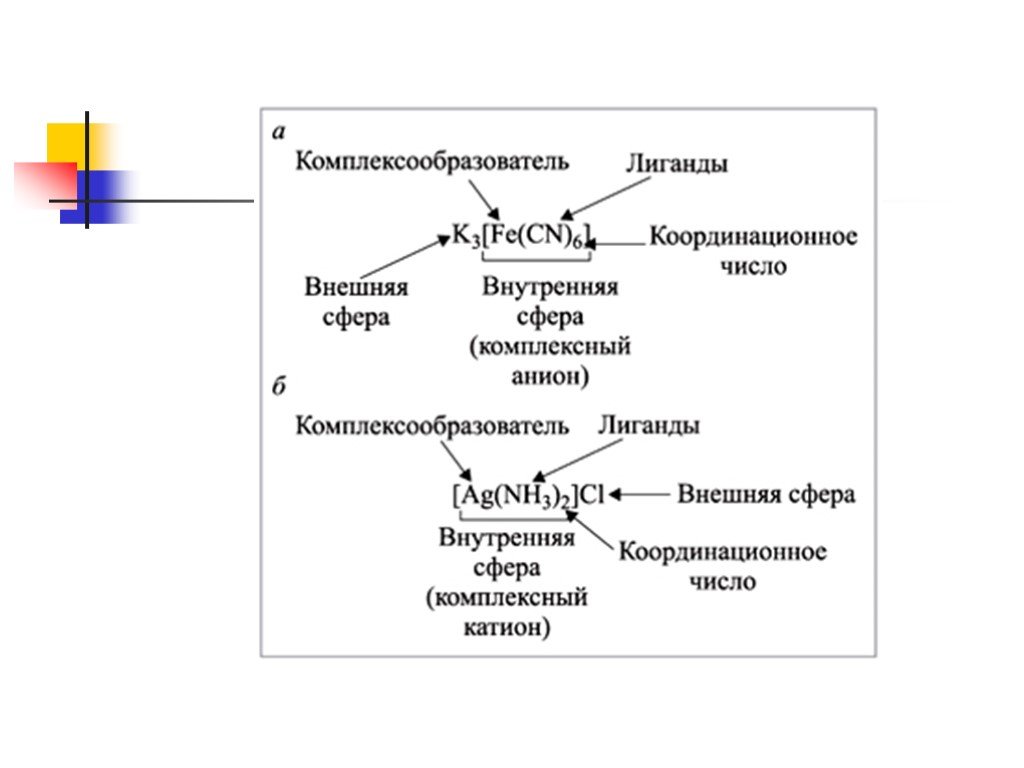
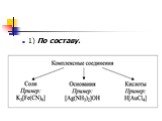
Соединения,имеющие в своем составе комплексные ионы, относят к комплексным соединениям. СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ. N H Cl + - [ * NH4Cl. КОМПЛЕКСООБРАЗОВАТЕЛЬ. ...Комплексные соединения
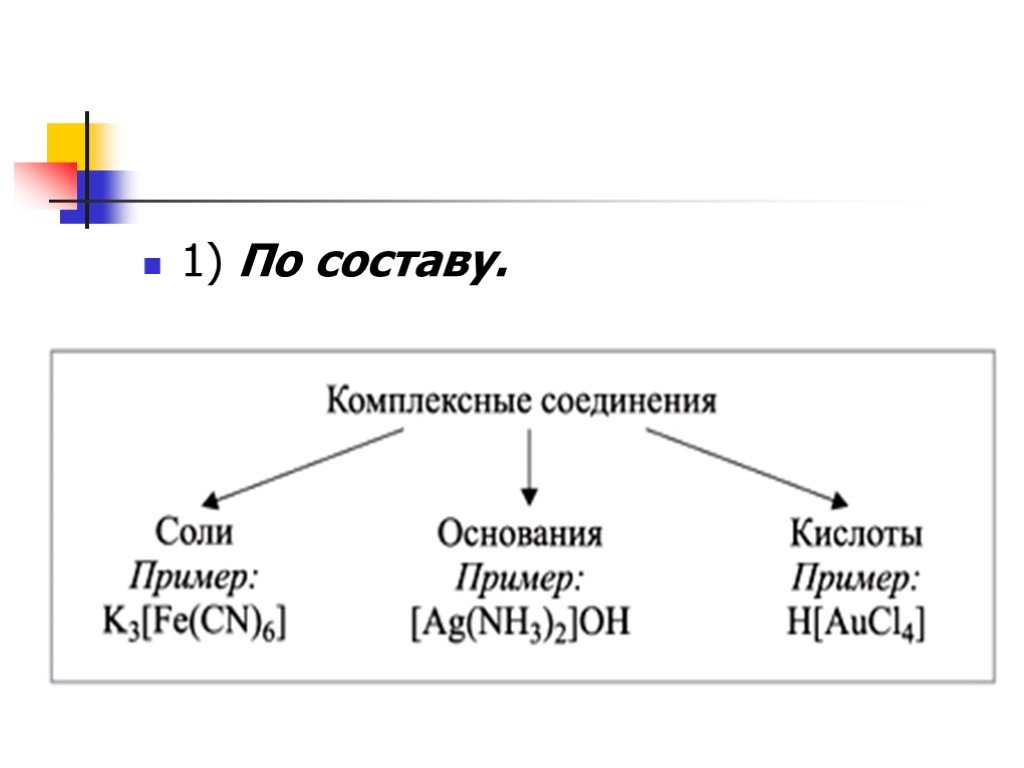
Комплексные называют соединения, содержащие сложные ионы и молекулы, способные к существованию как а кристаллическом виде, так и в растворе. Швейцарский ...Водородные соединения неметаллов
метан аммиак вода сероводород кислоты. Метан. Газ без цвета и запаха, малорастворим в воде, легче воздуха, горит бледным синеватым пламенем. Смесь ...Фосфор и его соединения и их свойства
Аллотропные модификации фосфора. Чёрный фосфор Красный фосфор Белый фосфор. Химические свойства фосфора. Горение фосфора. Оксиды фосфора. Взаимодействие ...Алюминий и его соединения
Положение в Периодической системе. Алюминий располагается в 3 периоде, в главной подгруппе 3 группы. Порядковый номер элемента – 13 Относительная ...Синтетические высокомолекулярные соединения и полимеры на их основе
Сегодня на уроке…. Общая характеристика синтетических высокомолекулярных соединений(ВМС). Полимеры. Происхождение полимеров. Способ получения полимеров. ...Ферменты как биологически активные соединения
Ферменты (энзимы) – это органические катализаторы белковой природы, которые ускоряют реакции, необходимые для функционирования живых организмов. Типы ...Органические соединения железа
Почему наш век можно назвать железным веком? Элементы и атомы, В менделеевский взятые круг, Сделали химию самой богатой И самой творческой из наук. ...Природные соединения кремния
«Минерал есть химическое соединение химических элементов, образовавшихся естественным путем, без вмешательства человека. Это своего рода здание, построенное ...Алюминий и его соединения
Учителя химии: Гершановская Евгения Владимировна ГБОУ СОШ № 880 Город Москва Попова Светлана Анатольевна ГБОУ СОШ № 1465 Город Москва. СОДЕРЖАНИЕ. ...НЕМЕТАЛЛЫ природные соединения применения продуктов их переработки
Элементы в природе. Нахождение в природе. Самородные элементы. Сера Графит С Алмаз С. Азот и кислород, инертные газы в составе воздуха. Нахождение ...Важнейшие соединения серы
Сероводород выделяется в результате вулканической деятельности, при гниении белков животных и растений, при работе производств химической, текстильной, ...Важнейшие соединения серы
Сероводород выделяется в результате вулканической деятельности, при гниении белков животных и растений, при работе производств химической, текстильной, ...Важнейшие представители бинарных соединений – оксиды и летучие водородные соединения
Н2О - вода. СО2 углекислый газ. СУХОЙ ЛЁД. NH3 аммиак. HCL хлороводород. Бесцветный газ. Тяжелее воздуха. Хорошо растворяется в воде. Раствор хлороводорода ...Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения
SiO2 , H2O , CO2 , AI2O3 , Fe2O3 , CO. Всесильная стихия природы-вода во все времена, во все периоды истории покоряла ум и воображение людей. Человек ...Бинарные соединения
17.09.2018. Бинарные соединения: определение. Многообразие природных бинарных соединений. Вода Хлорид натрия Углекислый газ. Бинарные вещества состоят ...Бинарные соединения
ОПРЕДЕЛЕНИЕ. Бинарные соединения – это соединения, состоящие из двух химических элементов. H2O, NH3, K2S, P2O5, CaC2. Бинарные соединения - хлориды. ...Бинарные соединения
Классификация сложных веществ. Бинарные соединения – это вещества, состоящие из двух разных атомов. Как составить формулу бинарного соединения. Знать ...Конспекты
Комплексные соединения
Петрова Марина Валериевна. МОУ «Кокшамарская средняя общеобразовательная школа им.И.С.Ключникова-Палантая» Звениговского района Республики Марий ...Комплексные соединения
РАЗРАБОТКА УРОКА ПО ХИМИИ С ИСПОЛЬЗОВАНИЕМ КОМПЬЮТЕРНЫХ ТЕХНОЛОГИЙ. Тема: Комплексные соединения. Задачи урока. : повторить виды химической ...Комплексные соединения
. Муниципальное общеобразовательное учреждение. средняя общеобразовательная школа № 9. Урок в 11 классе. «Комплексные соединения». ...Комплексные соединения
МОУ «Бишевская средняя общеобразовательная школа». Апастовского муниципального района РТ. Конспект урока ...Алюминий и его соединения
Технологическая карта урока по химии. подготовила учитель химии МБОУ СОШ № 1 г.Тимашевск. . ИСПАЛОВА НАТАЛЬЯ СЕРГЕЕВНА. Тема урока. . Алюминий ...Кислородсодержащие органические соединения
Е.А.Кудравец, учитель химии. МОУ гимназии № 32. . Дидактическая разработка урока. . Тема:. «Кислородосодержащие органические соединения». ...Фосфор и его соединения
ТЕМА. . УРОКА:. «Фосфор и его соединения» (9 класс). . Цель. : выяснение общей характеристики фосфора на основании. положения в периодической ...Фосфор и его соединения
Тема:. . Фосфор и его соединения. . Класс. : 9. Цель:. . Знать характеристику фосфора как химического элемента и как простого вещества, знать ...Типы химических реакций: соединения, разложения
. Муниципальное бюджетное общеобразовательное учреждение. «Харьковская средняя общеобразовательная школа. . Ровеньского района Белгородской ...Органические соединения в упражнениях и задачах
И.И. Ильинова, учитель химии. МБОУ «Лицей «Дубна». г. Дубны Московской области». Россия, Московская обл., г. Дубна. Разработка. . урок - ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 марта 2019
Категория:Химия
Содержит:26 слайд(ов)
Поделись с друзьями:
Скачать презентацию

































![б)Гидроксокомплексы – это комплексные анионы, в которых лигандами являются гидроксид-ионы OH–. Комплексообразователями являются металлы, склонные к проявлению амфотерных свойств – Be, Zn, Al, Cr. Например: Na[Al(OH)4], Ba[Zn(OH)4]. в) Аммиакаты – это комплексные катионы, в которых лигандами являются б)Гидроксокомплексы – это комплексные анионы, в которых лигандами являются гидроксид-ионы OH–. Комплексообразователями являются металлы, склонные к проявлению амфотерных свойств – Be, Zn, Al, Cr. Например: Na[Al(OH)4], Ba[Zn(OH)4]. в) Аммиакаты – это комплексные катионы, в которых лигандами являются](https://prezentacii.org/upload/cloud/19/03/133648/images/thumbs/screen12.jpg)
![г) Ацидокомплексы – это комплексные анионы, в которых лигандами являются анионы неорганических и органических кислот. Например: K3[Al(C2O4)3], Na2[Zn(CN)4], K4[Fe(CN)6]. г) Ацидокомплексы – это комплексные анионы, в которых лигандами являются анионы неорганических и органических кислот. Например: K3[Al(C2O4)3], Na2[Zn(CN)4], K4[Fe(CN)6].](https://prezentacii.org/upload/cloud/19/03/133648/images/thumbs/screen13.jpg)



![Примеры: K3[Fe(CN)6] – гексацианоферрат(III) калия, K4[Fe(CN)6] – гексацианоферрат(II) калия, K2[Zn(OH)4] – тетрагидроксоцинкат калия. Примеры: K3[Fe(CN)6] – гексацианоферрат(III) калия, K4[Fe(CN)6] – гексацианоферрат(II) калия, K2[Zn(OH)4] – тетрагидроксоцинкат калия.](https://prezentacii.org/upload/cloud/19/03/133648/images/thumbs/screen17.jpg)
![Например: [Cu(NH3)4]SO4 – сульфат тетраамминмеди(II), [Al(H2O)6]Cl3 – хлорид гексаакваалюминия. Например: [Cu(NH3)4]SO4 – сульфат тетраамминмеди(II), [Al(H2O)6]Cl3 – хлорид гексаакваалюминия.](https://prezentacii.org/upload/cloud/19/03/133648/images/thumbs/screen18.jpg)
![Химические свойства комплексных соединений. 1. В растворе комплексные соединения ведут себя как сильные электролиты, т.е. полностью диссоциируют на катионы и анионы. [Pt(NH3)4]Cl2 = Pt(NH3)4] 2+ + 2Cl –, K2[PtCl4] = 2K+ + [PtCl4] 2– Химические свойства комплексных соединений. 1. В растворе комплексные соединения ведут себя как сильные электролиты, т.е. полностью диссоциируют на катионы и анионы. [Pt(NH3)4]Cl2 = Pt(NH3)4] 2+ + 2Cl –, K2[PtCl4] = 2K+ + [PtCl4] 2–](https://prezentacii.org/upload/cloud/19/03/133648/images/thumbs/screen19.jpg)
![2. При действии сильных кислот происходит разрушение гидроксокомплексов а) при недостатке кислоты Na3[Al(OH)6] + 3HCl = 3NaCl + Al(OH)3 + 3H2O; б) при избытке кислоты Na3[Al(OH)6] + 6HCl = 3NaCl + AlCl3 + 6H2O. 2. При действии сильных кислот происходит разрушение гидроксокомплексов а) при недостатке кислоты Na3[Al(OH)6] + 3HCl = 3NaCl + Al(OH)3 + 3H2O; б) при избытке кислоты Na3[Al(OH)6] + 6HCl = 3NaCl + AlCl3 + 6H2O.](https://prezentacii.org/upload/cloud/19/03/133648/images/thumbs/screen20.jpg)
![3. Нагревание (термолиз) всех аммиакатов приводит к их разложению, например: [Cu(NH3)4]SO4 = CuSO4 + 4NH3 . 3. Нагревание (термолиз) всех аммиакатов приводит к их разложению, например: [Cu(NH3)4]SO4 = CuSO4 + 4NH3 .](https://prezentacii.org/upload/cloud/19/03/133648/images/thumbs/screen21.jpg)



![Задания. Письменно дать характеристику следующим комплексным соединениям по строению и классифицировать по признакам: K3[Cr(OH)6], [Cr(H2O)6](NO3)3, Na2[Zn(CN)4], [Ag(NH3)2]OH. Задания. Письменно дать характеристику следующим комплексным соединениям по строению и классифицировать по признакам: K3[Cr(OH)6], [Cr(H2O)6](NO3)3, Na2[Zn(CN)4], [Ag(NH3)2]OH.](https://prezentacii.org/upload/cloud/19/03/133648/images/thumbs/screen25.jpg)