Презентация "Комплексные соединения" по химии – проект, доклад
Презентацию на тему "Комплексные соединения" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 26 слайд(ов).
Слайды презентации
Список похожих презентаций
Комплексные соединения палладия в промышленных каталитических системах
Катализ. Производство аммиака, серной и азотной кислот. Гидрогенизация жиров, превращение бензола в циклогексан и др. Комплексные соединения палладия. ...Комплексные соединения
Комплексные называют соединения, содержащие сложные ионы и молекулы, способные к существованию как а кристаллическом виде, так и в растворе. Швейцарский ...Комплексные соединения
Соединения,имеющие в своем составе комплексные ионы, относят к комплексным соединениям. СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ. N H Cl + - [ * NH4Cl. КОМПЛЕКСООБРАЗОВАТЕЛЬ. ...Комплексные соединения
Координационная теория А.Вернера. В 1893 г. швейцарским химиком-неоргаником Альфредом Вернером (1866–1919) была сформулирована теория, позволившая ...Водородные соединения неметаллов
метан аммиак вода сероводород кислоты. Метан. Газ без цвета и запаха, малорастворим в воде, легче воздуха, горит бледным синеватым пламенем. Смесь ...Фосфор и его соединения и их свойства
Аллотропные модификации фосфора. Чёрный фосфор Красный фосфор Белый фосфор. Химические свойства фосфора. Горение фосфора. Оксиды фосфора. Взаимодействие ...Алюминий и его соединения
Положение в Периодической системе. Алюминий располагается в 3 периоде, в главной подгруппе 3 группы. Порядковый номер элемента – 13 Относительная ...Синтетические высокомолекулярные соединения и полимеры на их основе
Сегодня на уроке…. Общая характеристика синтетических высокомолекулярных соединений(ВМС). Полимеры. Происхождение полимеров. Способ получения полимеров. ...Ферменты как биологически активные соединения
Ферменты (энзимы) – это органические катализаторы белковой природы, которые ускоряют реакции, необходимые для функционирования живых организмов. Типы ...Органические соединения железа
Почему наш век можно назвать железным веком? Элементы и атомы, В менделеевский взятые круг, Сделали химию самой богатой И самой творческой из наук. ...Природные соединения кремния
«Минерал есть химическое соединение химических элементов, образовавшихся естественным путем, без вмешательства человека. Это своего рода здание, построенное ...Алюминий и его соединения
Учителя химии: Гершановская Евгения Владимировна ГБОУ СОШ № 880 Город Москва Попова Светлана Анатольевна ГБОУ СОШ № 1465 Город Москва. СОДЕРЖАНИЕ. ...НЕМЕТАЛЛЫ природные соединения применения продуктов их переработки
Элементы в природе. Нахождение в природе. Самородные элементы. Сера Графит С Алмаз С. Азот и кислород, инертные газы в составе воздуха. Нахождение ...Важнейшие соединения серы
Сероводород выделяется в результате вулканической деятельности, при гниении белков животных и растений, при работе производств химической, текстильной, ...Важнейшие соединения серы
Сероводород выделяется в результате вулканической деятельности, при гниении белков животных и растений, при работе производств химической, текстильной, ...Важнейшие представители бинарных соединений – оксиды и летучие водородные соединения
Н2О - вода. СО2 углекислый газ. СУХОЙ ЛЁД. NH3 аммиак. HCL хлороводород. Бесцветный газ. Тяжелее воздуха. Хорошо растворяется в воде. Раствор хлороводорода ...Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения
SiO2 , H2O , CO2 , AI2O3 , Fe2O3 , CO. Всесильная стихия природы-вода во все времена, во все периоды истории покоряла ум и воображение людей. Человек ...Бинарные соединения
17.09.2018. Бинарные соединения: определение. Многообразие природных бинарных соединений. Вода Хлорид натрия Углекислый газ. Бинарные вещества состоят ...Бинарные соединения
ОПРЕДЕЛЕНИЕ. Бинарные соединения – это соединения, состоящие из двух химических элементов. H2O, NH3, K2S, P2O5, CaC2. Бинарные соединения - хлориды. ...Бинарные соединения
Классификация сложных веществ. Бинарные соединения – это вещества, состоящие из двух разных атомов. Как составить формулу бинарного соединения. Знать ...Конспекты
Комплексные соединения
Петрова Марина Валериевна. МОУ «Кокшамарская средняя общеобразовательная школа им.И.С.Ключникова-Палантая» Звениговского района Республики Марий ...Комплексные соединения
РАЗРАБОТКА УРОКА ПО ХИМИИ С ИСПОЛЬЗОВАНИЕМ КОМПЬЮТЕРНЫХ ТЕХНОЛОГИЙ. Тема: Комплексные соединения. Задачи урока. : повторить виды химической ...Комплексные соединения
. Муниципальное общеобразовательное учреждение. средняя общеобразовательная школа № 9. Урок в 11 классе. «Комплексные соединения». ...Комплексные соединения
МОУ «Бишевская средняя общеобразовательная школа». Апастовского муниципального района РТ. Конспект урока ...Алюминий и его соединения
Технологическая карта урока по химии. подготовила учитель химии МБОУ СОШ № 1 г.Тимашевск. . ИСПАЛОВА НАТАЛЬЯ СЕРГЕЕВНА. Тема урока. . Алюминий ...Кислородсодержащие органические соединения
Е.А.Кудравец, учитель химии. МОУ гимназии № 32. . Дидактическая разработка урока. . Тема:. «Кислородосодержащие органические соединения». ...Фосфор и его соединения
ТЕМА. . УРОКА:. «Фосфор и его соединения» (9 класс). . Цель. : выяснение общей характеристики фосфора на основании. положения в периодической ...Фосфор и его соединения
Тема:. . Фосфор и его соединения. . Класс. : 9. Цель:. . Знать характеристику фосфора как химического элемента и как простого вещества, знать ...Типы химических реакций: соединения, разложения
. Муниципальное бюджетное общеобразовательное учреждение. «Харьковская средняя общеобразовательная школа. . Ровеньского района Белгородской ...Органические соединения в упражнениях и задачах
И.И. Ильинова, учитель химии. МБОУ «Лицей «Дубна». г. Дубны Московской области». Россия, Московская обл., г. Дубна. Разработка. . урок - ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:18 октября 2018
Категория:Химия
Содержит:26 слайд(ов)
Поделись с друзьями:
Скачать презентацию

















![[PtIV(NH3)6]Cl4 [PtIV(NH3)5Cl]Cl3 [PtIV(NH3)4Cl2]Cl2 [PtIV(NH3)3Cl3]Cl [PtIV(NH3)2Cl4]. От эмпирических формул КС к координационным: PtCl4 • 2NH3 PtCl4 • 6NH3 PtCl4 • 5NH3 PtCl4 • 4NH3 PtCl4 • 3NH3 [PtIV(NH3)6]Cl4 [PtIV(NH3)5Cl]Cl3 [PtIV(NH3)4Cl2]Cl2 [PtIV(NH3)3Cl3]Cl [PtIV(NH3)2Cl4]. От эмпирических формул КС к координационным: PtCl4 • 2NH3 PtCl4 • 6NH3 PtCl4 • 5NH3 PtCl4 • 4NH3 PtCl4 • 3NH3](https://prezentacii.org/upload/cloud/18/10/88357/images/thumbs/screen4.jpg)
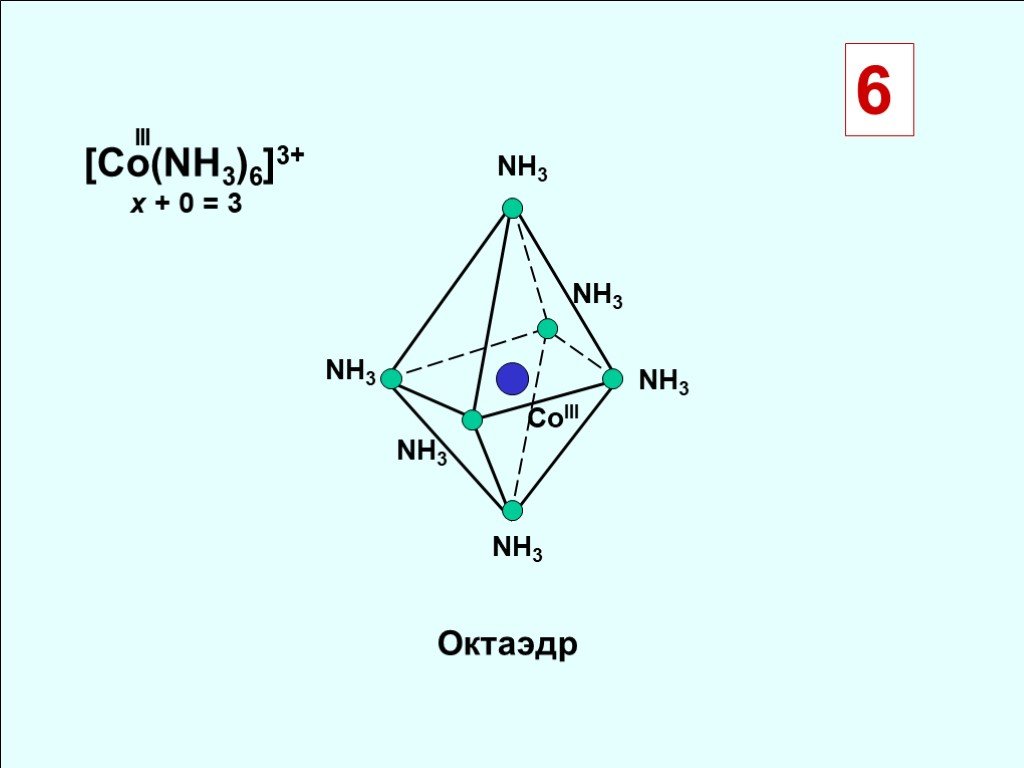
![NH3 CoIII [Co(NH3)6]3+ x + 0 = 3 III Октаэдр 6 NH3 CoIII [Co(NH3)6]3+ x + 0 = 3 III Октаэдр 6](https://prezentacii.org/upload/cloud/18/10/88357/images/thumbs/screen5.jpg)
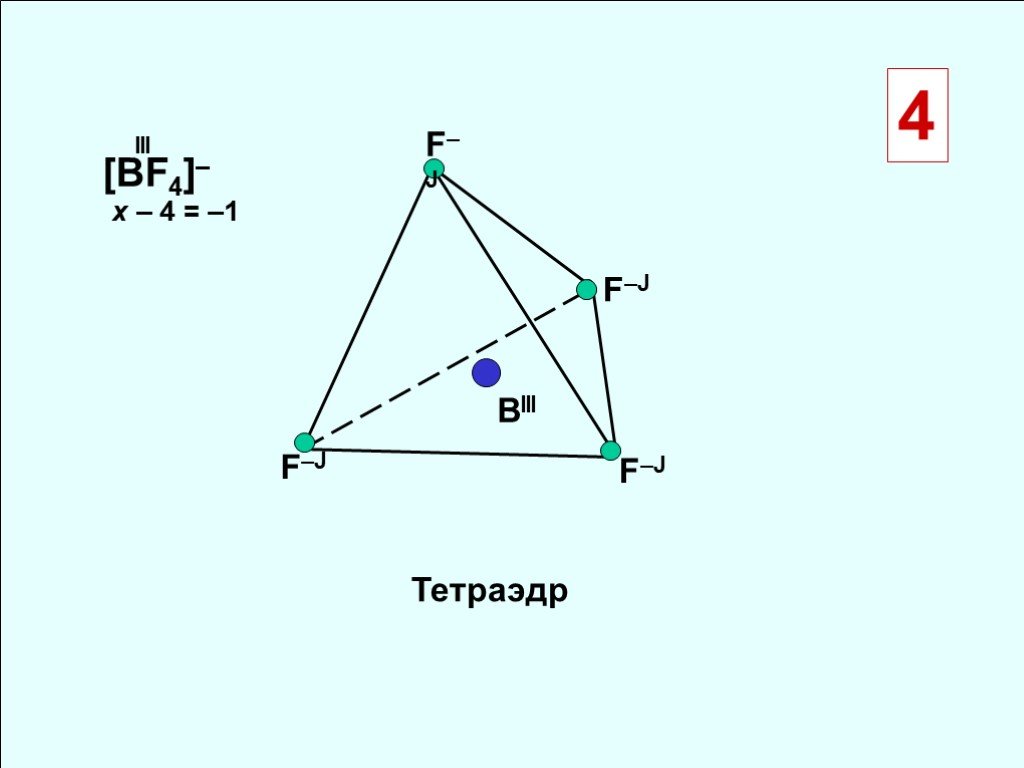
![F–Ј BIII [BF4]– x – 4 = –1 Тетраэдр F–Ј BIII [BF4]– x – 4 = –1 Тетраэдр](https://prezentacii.org/upload/cloud/18/10/88357/images/thumbs/screen6.jpg)
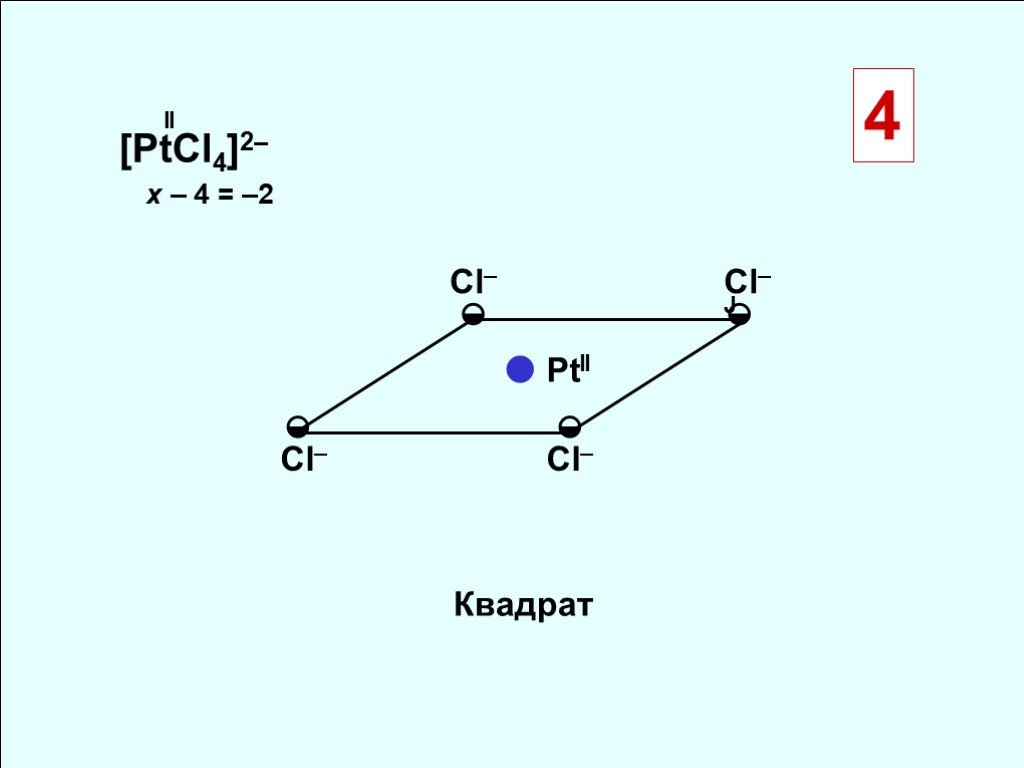
![[PtCl4]2– Квадрат ◒ ● Сl– Сl–Ј x – 4 = –2 II PtII [PtCl4]2– Квадрат ◒ ● Сl– Сl–Ј x – 4 = –2 II PtII](https://prezentacii.org/upload/cloud/18/10/88357/images/thumbs/screen7.jpg)
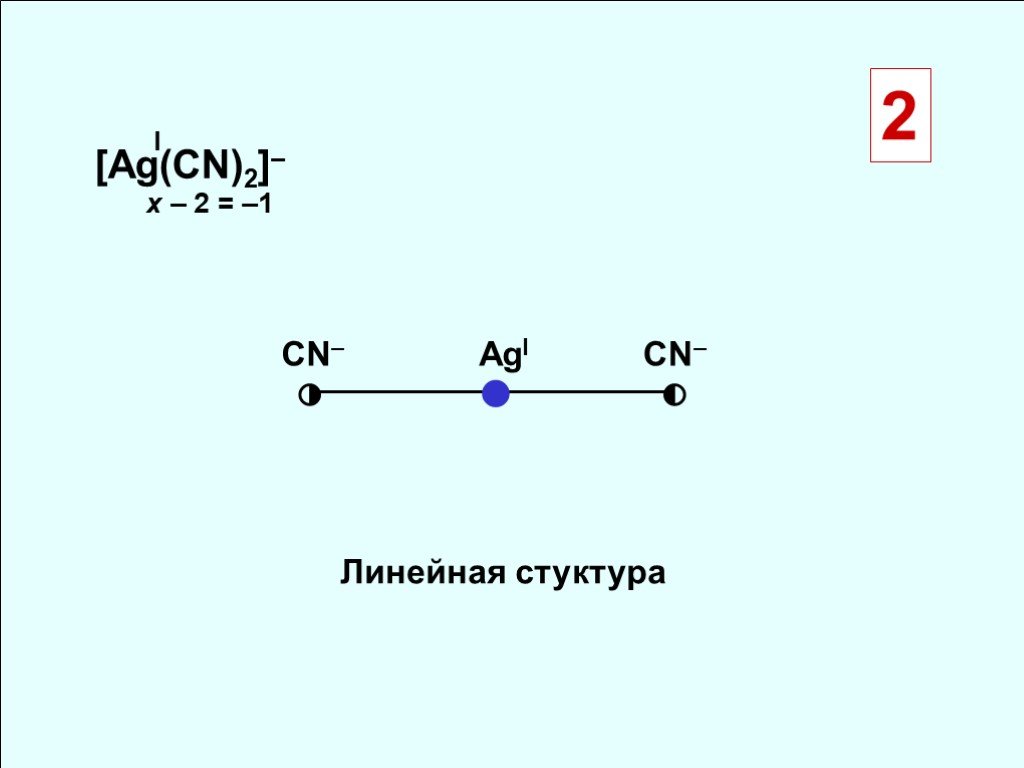
![[Ag(CN)2]– ◑ ◐. Линейная стуктура. СN– CN– x – 2 = –1 I AgI 2 [Ag(CN)2]– ◑ ◐. Линейная стуктура. СN– CN– x – 2 = –1 I AgI 2](https://prezentacii.org/upload/cloud/18/10/88357/images/thumbs/screen8.jpg)
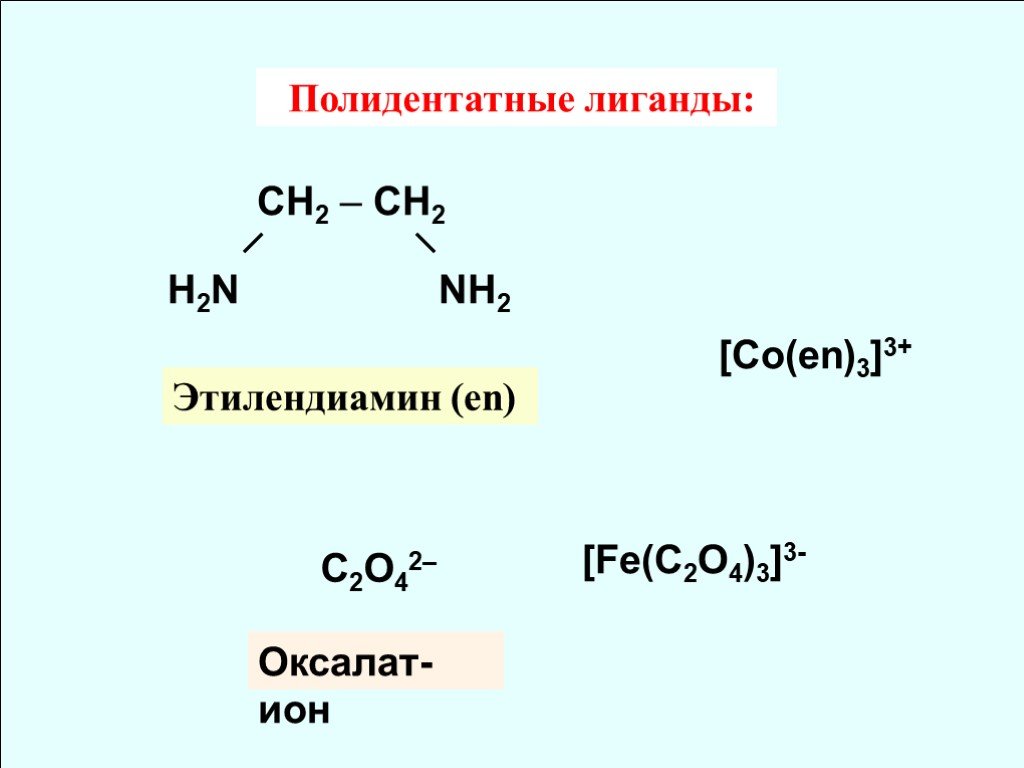
![Полидентатные лиганды: СH2 – СH2 ╱ ╲ H2N NH2 [Co(en)3]3+ C2O42– Этилендиамин (en) Оксалат-ион [Fe(C2O4)3]3- Полидентатные лиганды: СH2 – СH2 ╱ ╲ H2N NH2 [Co(en)3]3+ C2O42– Этилендиамин (en) Оксалат-ион [Fe(C2O4)3]3-](https://prezentacii.org/upload/cloud/18/10/88357/images/thumbs/screen9.jpg)

![[Zn(NH3)4]SO4 [Co(H2O)2(NH3)3Cl]Cl2. Хлорид хлоротриамминдиаквакобальта (III). Сульфат тетраамминцинка (II). x – 1 = 2 K4 [Fe(CN)6]. Гексацианоферрат (II) калия. (жёлтая кровяная соль). NH4[Cr(NH3)2(SCN)4]. Тетрароданодиамминхромат (III) аммония. [Al(H2O)3(OH)3]. Тригидроксотриакваалюминий [Zn(NH3)4]SO4 [Co(H2O)2(NH3)3Cl]Cl2. Хлорид хлоротриамминдиаквакобальта (III). Сульфат тетраамминцинка (II). x – 1 = 2 K4 [Fe(CN)6]. Гексацианоферрат (II) калия. (жёлтая кровяная соль). NH4[Cr(NH3)2(SCN)4]. Тетрароданодиамминхромат (III) аммония. [Al(H2O)3(OH)3]. Тригидроксотриакваалюминий](https://prezentacii.org/upload/cloud/18/10/88357/images/thumbs/screen11.jpg)
![Диссоциация КС в водных растворах. [Cu(NH3)4]SO4 = [Cu(NH3)4]2+ +SO42–. [Cu(NH3)4]2+ ⇄ Cu2+ + 4NH3. Скомпл≫ Спрод.дисс. [Cu2+] [NH3]4 Kн = ——————— = 2 · 10–13 [ [Cu(NH3)4]2+]. α =1 α Диссоциация КС в водных растворах. [Cu(NH3)4]SO4 = [Cu(NH3)4]2+ +SO42–. [Cu(NH3)4]2+ ⇄ Cu2+ + 4NH3. Скомпл≫ Спрод.дисс. [Cu2+] [NH3]4 Kн = ——————— = 2 · 10–13 [ [Cu(NH3)4]2+]. α =1 α](https://prezentacii.org/upload/cloud/18/10/88357/images/thumbs/screen12.jpg)
= 2NH4+ + Fe2+ + 2SO42– K[Al(SO4)2](k) = K+ + Al3+ + 2SO42–. Скомпл < Спрод.дисс. О связи Кн с устойчивостью комплексной частицы Двойные соли: (NH4)2SO4 ∙ FeSO4 ∙ 6H2O (соль Мора) KAl(SO4)2 ∙ 12H2O (алюмокалиевые квасцы). (NH4)2[Fe(SO4)2](k)= 2NH4+ + Fe2+ + 2SO42– K[Al(SO4)2](k) = K+ + Al3+ + 2SO42–. Скомпл < Спрод.дисс. О связи Кн с устойчивостью комплексной частицы](https://prezentacii.org/upload/cloud/18/10/88357/images/thumbs/screen13.jpg)
![Важнейшие типы КС AlCl3 ∙ 6H2O ≡ [Al(H2O)6]Cl3. Если лигандами является вода комплексы называются аквакомплексами. [Co(H2O)6]2+ [Ni(H2O)6] 2 +. Как правило, аквакомплексы неустойчивы. Аквакомплексы образуются при выделении солей из водных растворов в виде кристаллогидратов. Аквакомплексы Важнейшие типы КС AlCl3 ∙ 6H2O ≡ [Al(H2O)6]Cl3. Если лигандами является вода комплексы называются аквакомплексами. [Co(H2O)6]2+ [Ni(H2O)6] 2 +. Как правило, аквакомплексы неустойчивы. Аквакомплексы образуются при выделении солей из водных растворов в виде кристаллогидратов. Аквакомплексы](https://prezentacii.org/upload/cloud/18/10/88357/images/thumbs/screen14.jpg)
![Амминокомплексы. В амминокомплексах лигандами являются молекулы NH3. [Cu(NH3)4]2+ [Ni(NH3)6]2+. ZnSO4 + 2NH3 ∙ H2O = Zn(OH)2↓ + (NH4)2SO4. Zn(OH)2 + 4NH3 = [Zn(NH3)4](OH)2. комплексный гидроксид цинка. Комплексные гидроксиды относятся к сильным основаниям Амминокомплексы. В амминокомплексах лигандами являются молекулы NH3. [Cu(NH3)4]2+ [Ni(NH3)6]2+. ZnSO4 + 2NH3 ∙ H2O = Zn(OH)2↓ + (NH4)2SO4. Zn(OH)2 + 4NH3 = [Zn(NH3)4](OH)2. комплексный гидроксид цинка. Комплексные гидроксиды относятся к сильным основаниям](https://prezentacii.org/upload/cloud/18/10/88357/images/thumbs/screen15.jpg)
![Ацидокомплексы. В ацидокомплексах лигандами являются анионы различных кислот. К ним относятся цианидные, галогенидные, карбонатные, оксалатные и другие комплексы. Na[Au(CN)2] - безцветный K2[SiF6] H2[SiF6]. кремнефтористо- водородная кислота. Комплексные кислоты относятся к сильным электролитам. Hg( Ацидокомплексы. В ацидокомплексах лигандами являются анионы различных кислот. К ним относятся цианидные, галогенидные, карбонатные, оксалатные и другие комплексы. Na[Au(CN)2] - безцветный K2[SiF6] H2[SiF6]. кремнефтористо- водородная кислота. Комплексные кислоты относятся к сильным электролитам. Hg(](https://prezentacii.org/upload/cloud/18/10/88357/images/thumbs/screen16.jpg)
![Be(OH)2 + 2NaOH = Na2[Be(OH)4]. Гидроксокомплексы. В гидроксокомплексах лигандами являются ионы ОН-. Na3[Al(OH)6] K2[Sn(OH)6]. BeCl2 + 2NaOH = Be(OH)2↓ + 2NaCl. Гидроксокомплексы образуют металлы, чьи гидроксиды амфотерны Be(OH)2 + 2NaOH = Na2[Be(OH)4]. Гидроксокомплексы. В гидроксокомплексах лигандами являются ионы ОН-. Na3[Al(OH)6] K2[Sn(OH)6]. BeCl2 + 2NaOH = Be(OH)2↓ + 2NaCl. Гидроксокомплексы образуют металлы, чьи гидроксиды амфотерны](https://prezentacii.org/upload/cloud/18/10/88357/images/thumbs/screen17.jpg)
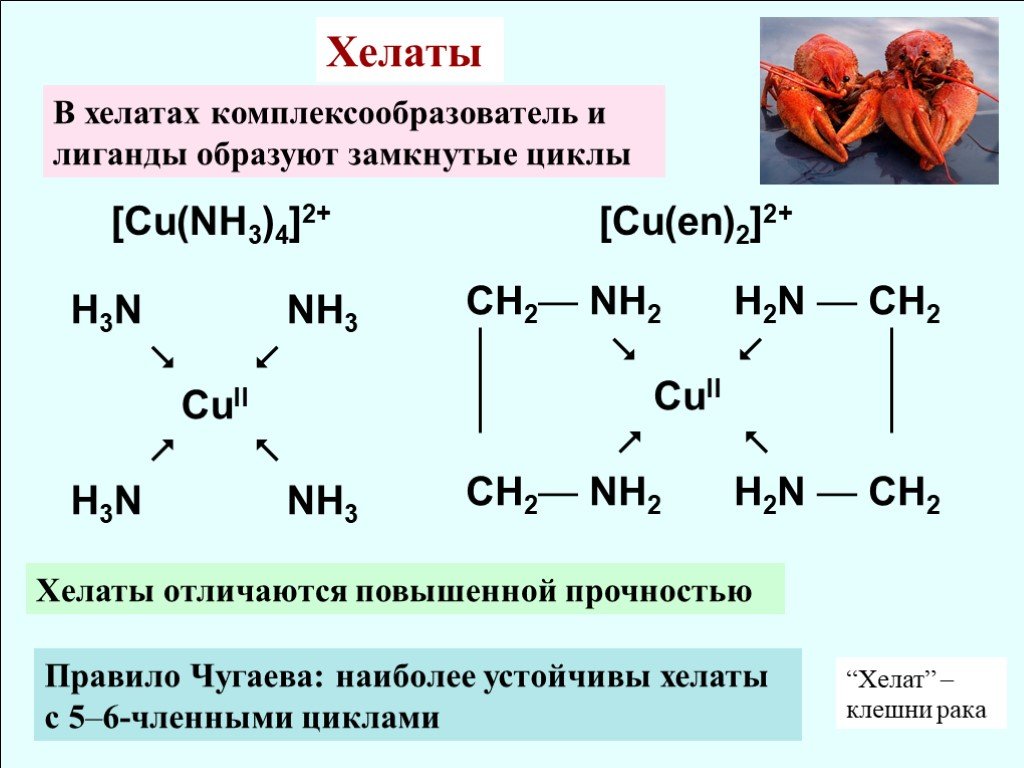
![[Cu(NH3)4]2+ [Cu(en)2]2+. H3N NH3 CuII H3N NH3. CH2— NH2 H2N — CH2 CuII CH2— NH2 H2N — CH2. Правило Чугаева: наиболее устойчивы хелаты с 5–6-членными циклами. Хелаты. В хелатах комплексообразователь и лиганды образуют замкнутые циклы. Хелаты отличаются повышенной прочностью. “Хелат” [Cu(NH3)4]2+ [Cu(en)2]2+. H3N NH3 CuII H3N NH3. CH2— NH2 H2N — CH2 CuII CH2— NH2 H2N — CH2. Правило Чугаева: наиболее устойчивы хелаты с 5–6-членными циклами. Хелаты. В хелатах комплексообразователь и лиганды образуют замкнутые циклы. Хелаты отличаются повышенной прочностью. “Хелат”](https://prezentacii.org/upload/cloud/18/10/88357/images/thumbs/screen18.jpg)
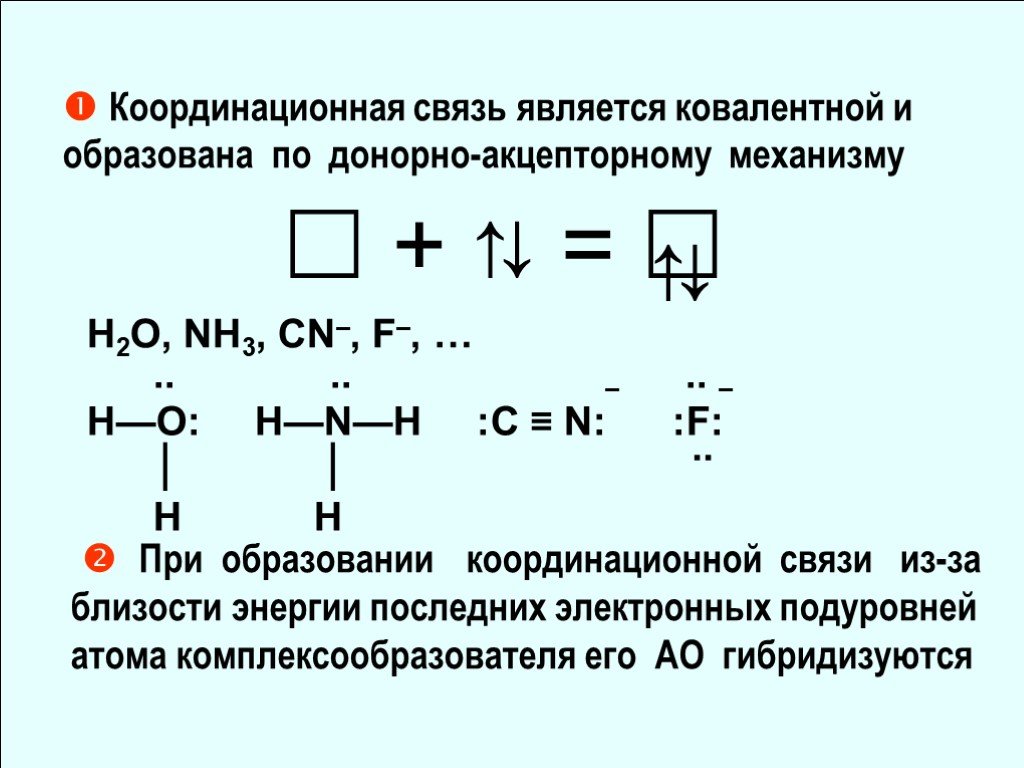
![Природа химической связи в КС. [Zn(NH3)4]Cl2 Ионная связь. Ковалентная связь . ? – Природа химической связи в КС. [Zn(NH3)4]Cl2 Ионная связь. Ковалентная связь . ? –](https://prezentacii.org/upload/cloud/18/10/88357/images/thumbs/screen19.jpg)

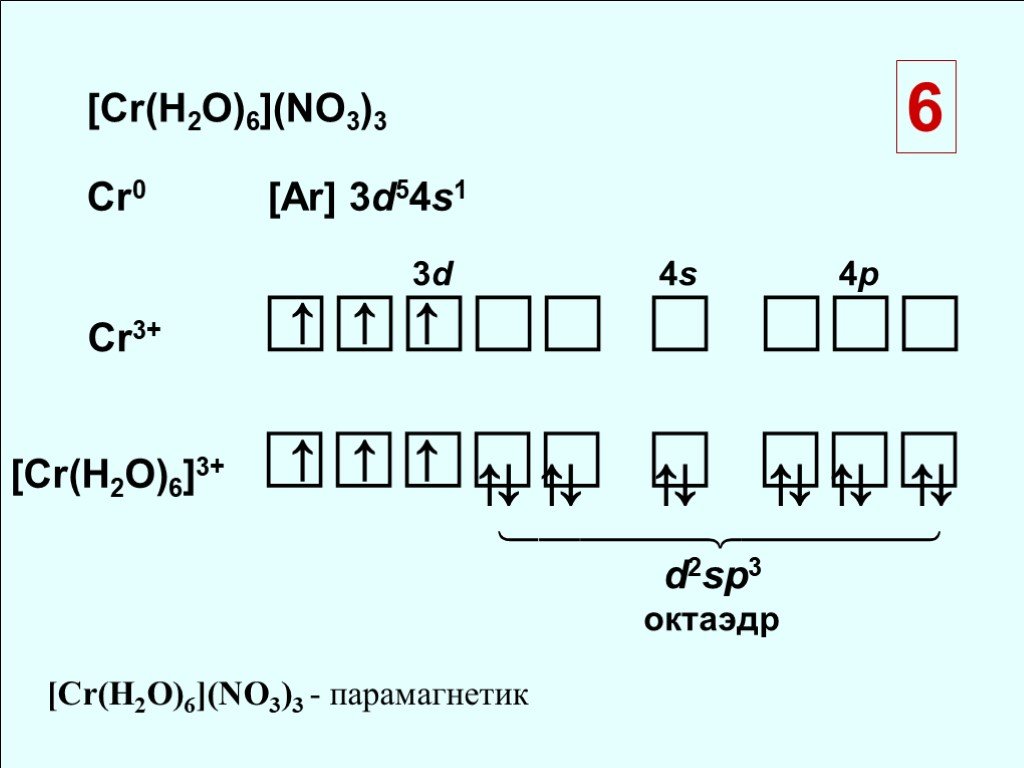
3 Cr0 [Ar] 3d54s1. Cr3+ . [Cr(H2O)6]3+ . ↑ ↑ ↑ 3d 4s 4p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅. d2sp3 октаэдр. [Cr(H2O)6](NO3)3 - парамагнетик [Cr(H2O)6](NO3)3 Cr0 [Ar] 3d54s1. Cr3+ . [Cr(H2O)6]3+ . ↑ ↑ ↑ 3d 4s 4p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅. d2sp3 октаэдр. [Cr(H2O)6](NO3)3 - парамагнетик](https://prezentacii.org/upload/cloud/18/10/88357/images/thumbs/screen21.jpg)
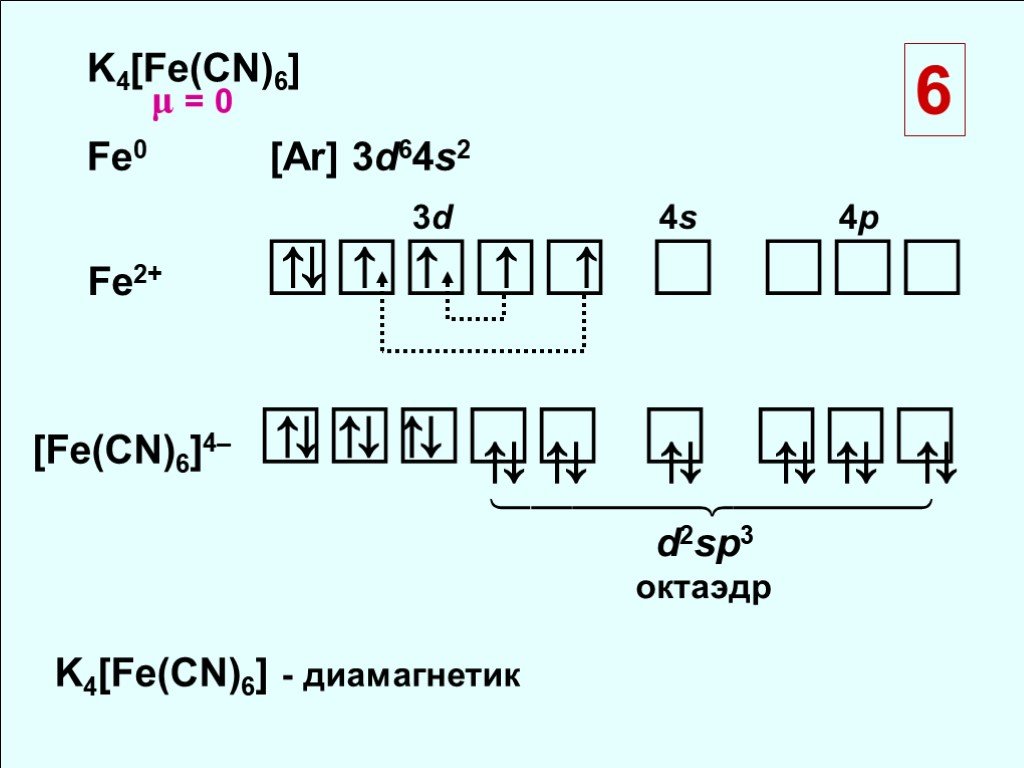
![K4[Fe(CN)6] Fe0 [Ar] 3d64s2. Fe2+ . [Fe(CN)6]4– . ⇅ ↑ ↑ ↑ ↑ ⇅ ⇅ ⇅. K4[Fe(CN)6] - диамагнетик. μ = 0 K4[Fe(CN)6] Fe0 [Ar] 3d64s2. Fe2+ . [Fe(CN)6]4– . ⇅ ↑ ↑ ↑ ↑ ⇅ ⇅ ⇅. K4[Fe(CN)6] - диамагнетик. μ = 0](https://prezentacii.org/upload/cloud/18/10/88357/images/thumbs/screen22.jpg)
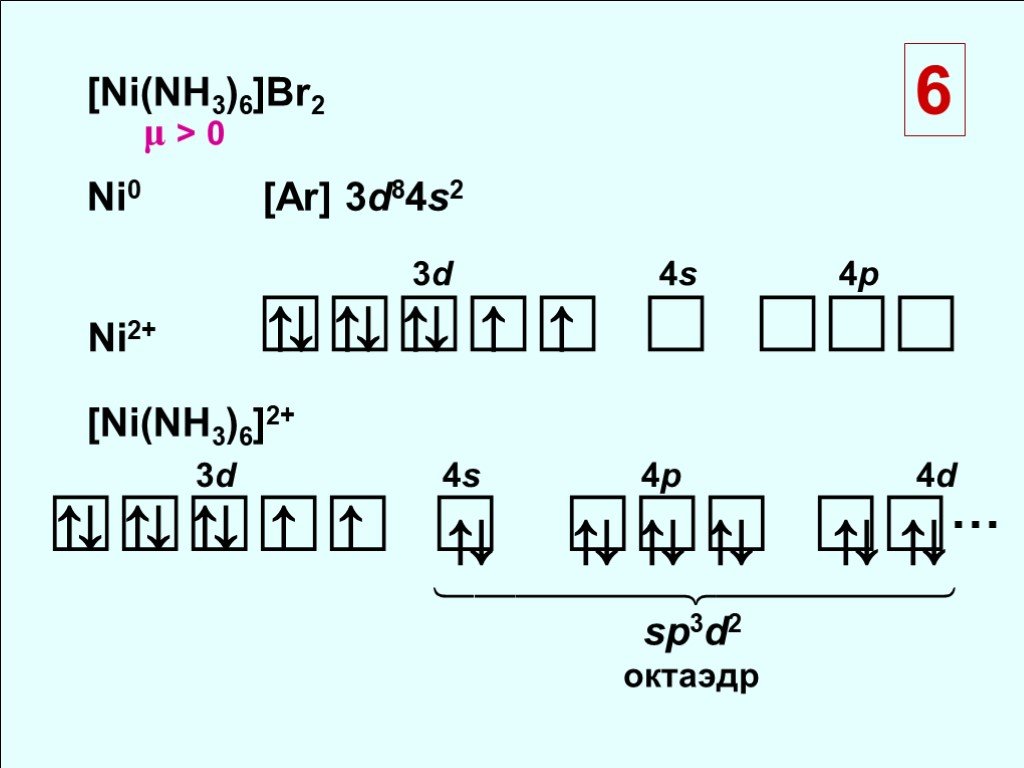
![[Ni(NH3)6]Br2 Ni0 [Ar] 3d84s2. Ni2+ . ⇅ ⇅ ⇅ ↑ ↑. sp3d2 октаэдр. μ > 0. …. 3d 4s 4p 4d [Ni(NH3)6]Br2 Ni0 [Ar] 3d84s2. Ni2+ . ⇅ ⇅ ⇅ ↑ ↑. sp3d2 октаэдр. μ > 0. …. 3d 4s 4p 4d](https://prezentacii.org/upload/cloud/18/10/88357/images/thumbs/screen23.jpg)
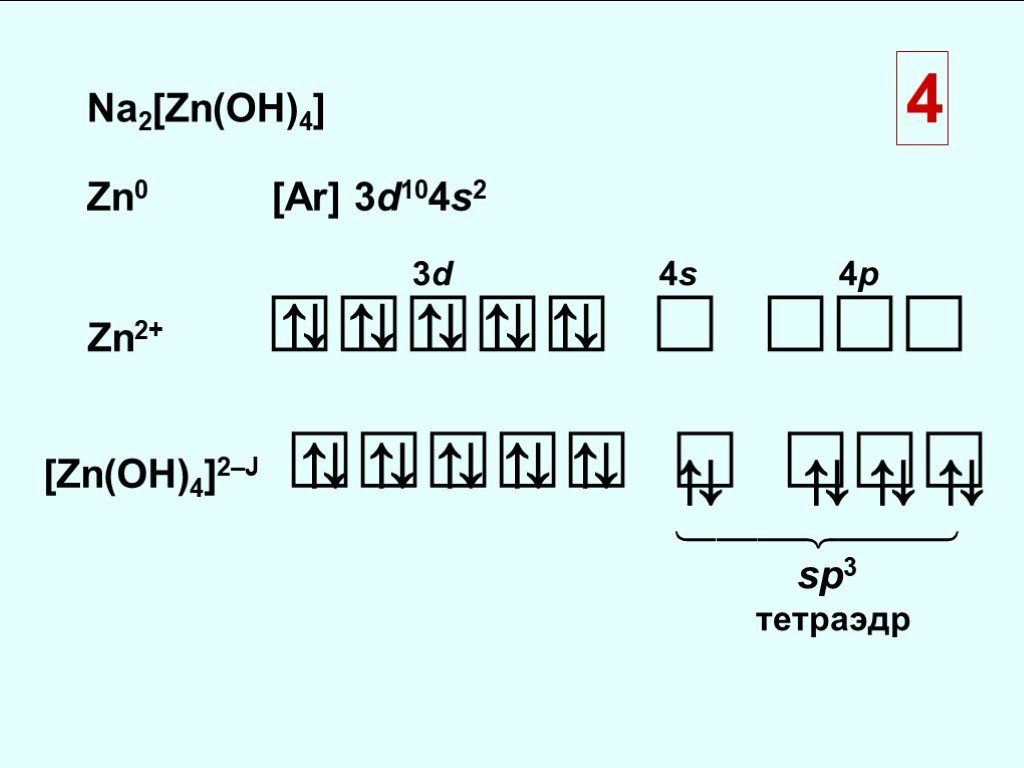
![Na2[Zn(OH)4] Zn0 [Ar] 3d104s2. Zn2+ . [Zn(OH)4]2–Ј . ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅. sp3 тетраэдр Na2[Zn(OH)4] Zn0 [Ar] 3d104s2. Zn2+ . [Zn(OH)4]2–Ј . ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅. sp3 тетраэдр](https://prezentacii.org/upload/cloud/18/10/88357/images/thumbs/screen24.jpg)
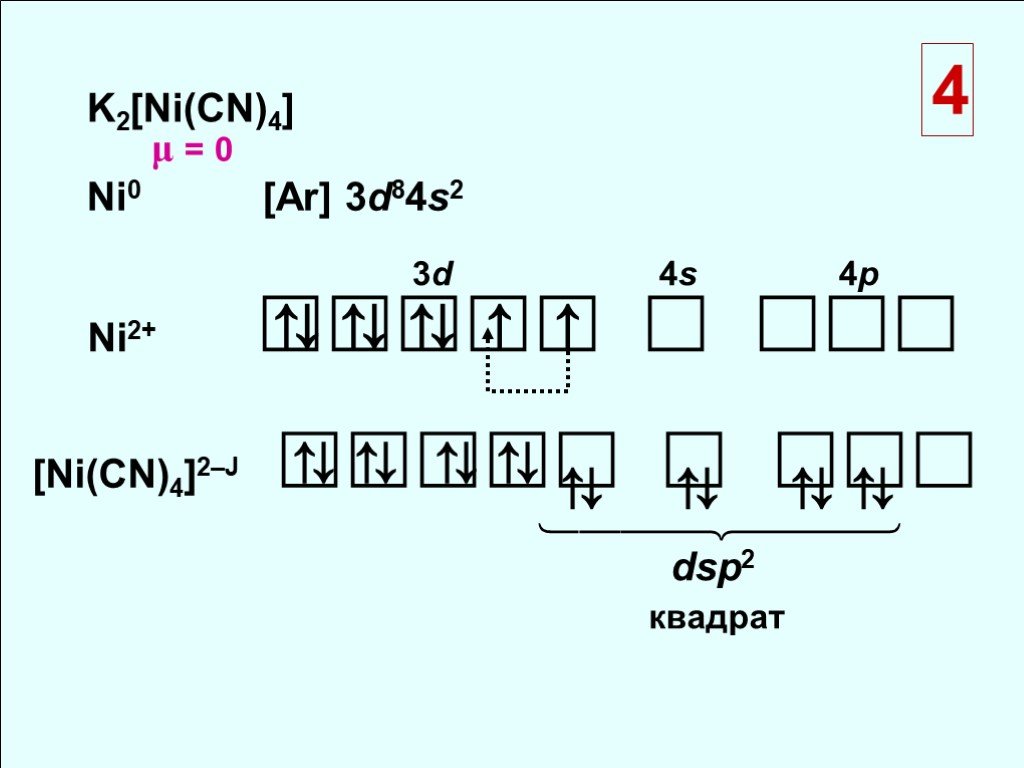
![K2[Ni(CN)4]. [Ni(СN)4]2–Ј . dsp2 квадрат K2[Ni(CN)4]. [Ni(СN)4]2–Ј . dsp2 квадрат](https://prezentacii.org/upload/cloud/18/10/88357/images/thumbs/screen25.jpg)
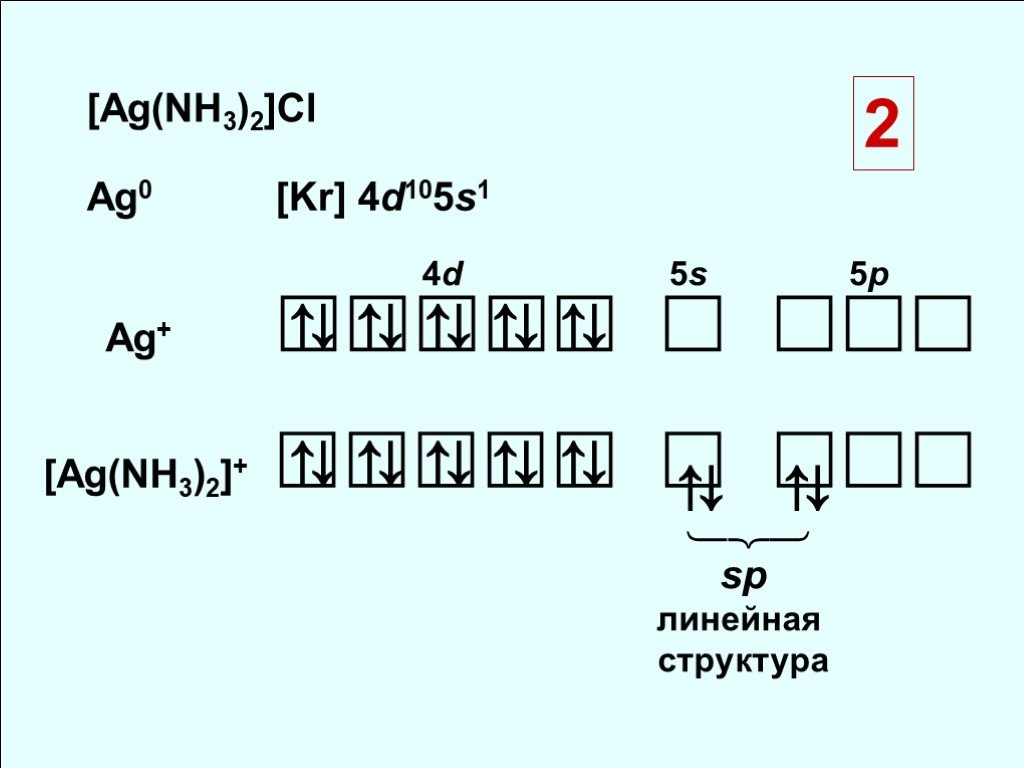
![[Ag(NH3)2]Cl Ag0 [Kr] 4d105s1. Ag+ . [Ag(NH3)2]+ . 4d 5s 5p ⇅ ⇅. sp линейная структура [Ag(NH3)2]Cl Ag0 [Kr] 4d105s1. Ag+ . [Ag(NH3)2]+ . 4d 5s 5p ⇅ ⇅. sp линейная структура](https://prezentacii.org/upload/cloud/18/10/88357/images/thumbs/screen26.jpg)