Презентация "Алюминий и его соединения" по химии – проект, доклад
Презентацию на тему "Алюминий и его соединения" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 13 слайд(ов).
Слайды презентации
Список похожих презентаций
Алюминий и его соединения
Учителя химии: Гершановская Евгения Владимировна ГБОУ СОШ № 880 Город Москва Попова Светлана Анатольевна ГБОУ СОШ № 1465 Город Москва. СОДЕРЖАНИЕ. ...Алюминий и его соединения
Стартовое задание. Выполнение задания А оценивается одним баллом. Выполнение задания В оценивается 2 баллами. Выполнение задания С оценивается 3 баллами. ...Азот и его соединения
Содержание. Открытие Происхождение названия Круговорот азота в природе Азот в природе Получение Свойства Соединения азота Применение. Открытие. В ...Фосфор и его соединения
Строение атома. Символ элемента: P. Атомный номер: 15. Положение в таблице: 3-й период, группа - VA (2) Относительная атомная масса: 30.973761 Степени ...Цинк и его соединения
30Zn 1s22s22p63s23p64s23d10. d-элемент IV-го периода второй группы побочной подгруппы. Zn Строение. Нахождение в природе. По содержанию в земной коре ...Фосфор и его соединения и их свойства
Аллотропные модификации фосфора. Чёрный фосфор Красный фосфор Белый фосфор. Химические свойства фосфора. Горение фосфора. Оксиды фосфора. Взаимодействие ...Фосфор и его соединения
«Чудовище лежало перед нами… Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза обведены огненными кругами. Я ...Железо, его соединения и их свойства
Задачи:. Проверить знание основных теоретических вопросов темы “Железо и его соединения”; Развивать умения составлять электронный баланс и уравнения, ...Углерод и его соединения
Необходимо вспомнить. Положение химического элемента в таблице Д.И.Менделеева. Электронная формула атома углерода. Какие высшую и низшую степени окисления ...Железо и его соединения
С О Д Е Р Ж А Н И Е. Положение В периодической системе. НАХОЖДЕНИЕ В ПРИРОДЕ. ОТКРЫТИЕ И ПОЛУЧЕНИЕ. ХИМИЧЕСКИЕ СВОЙСТВА. ЖЕЛЕЗО В ОРГАНИЗМЕ И ЕГО ...Основные соединения кальция и их применение – вчера, сегодня, завтра
5 МЕСТО ПО РАСПРОСТРАНЕННОСТИ В ПРИРОДЕ. 100 кг кальция !!! Кальцит. Мел Мрамор Известняк. Владимирский собор. Нижегородский собор. Церковь Покрова ...Алюминий и его свойства
Алюминий и его свойства. ППС. Химическая активность. Взаимодействие с простыми веществами. Взаимодействие с сложными веществами. получение лабораторное ...Железо и его соединения
Закрепление и обобщение материала по теме: «Железо и его соединения». 9 класс. Путешествие по стране химических вопросов. ЗНАНИЯ - ЭТО ИСТИННЫЕ СОКРОВИЩА, ...Железо и его соединения
Желе́зо — элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером ...Алюминий и его характеристика
Цель урока. Рассмотрение характеристики алюминия по трем формам существования химических элементов: атомов, простых и сложных веществ. Задачи урока. ...Марганец и его соединения
История открытия. 1774 г. шведский химик К. Шееле Ю. Ганн «манганум» (от немецкого Manganerz — марганцевая руда). Шееле Карл Вильгельм. Карл Вильгельм ...Железо и его соединения
Загадка Очень древний я металл, Счёт столетьям потерял. Был нескромным я не в меру, Тысячи лет до нашей эры. А за блеск, мерцавший холодом, Люди там ...Кобальт и его соединения
Аннотация. Кобальт – это белый, слегка желтоватый металл с розоватым или синеватым отливом. Существует в двух кристаллических модификациях:. α-Co ...Кремний и его соединения
Короткова Фаина Алексеевна, учитель химии и биологии МБОУ Летуновской СОШ. Контактная информация: - e-mail: korotkova_faina@mail.ru - тел. +7 903 ...Кремний и его соединения
Нахождение в природе. SiO2 кремнезём (песок). Al2O3∙ 2SiO2∙2H2O каолинит (глина). По распространенности занимает второе место после кислорода (26%). ...Конспекты
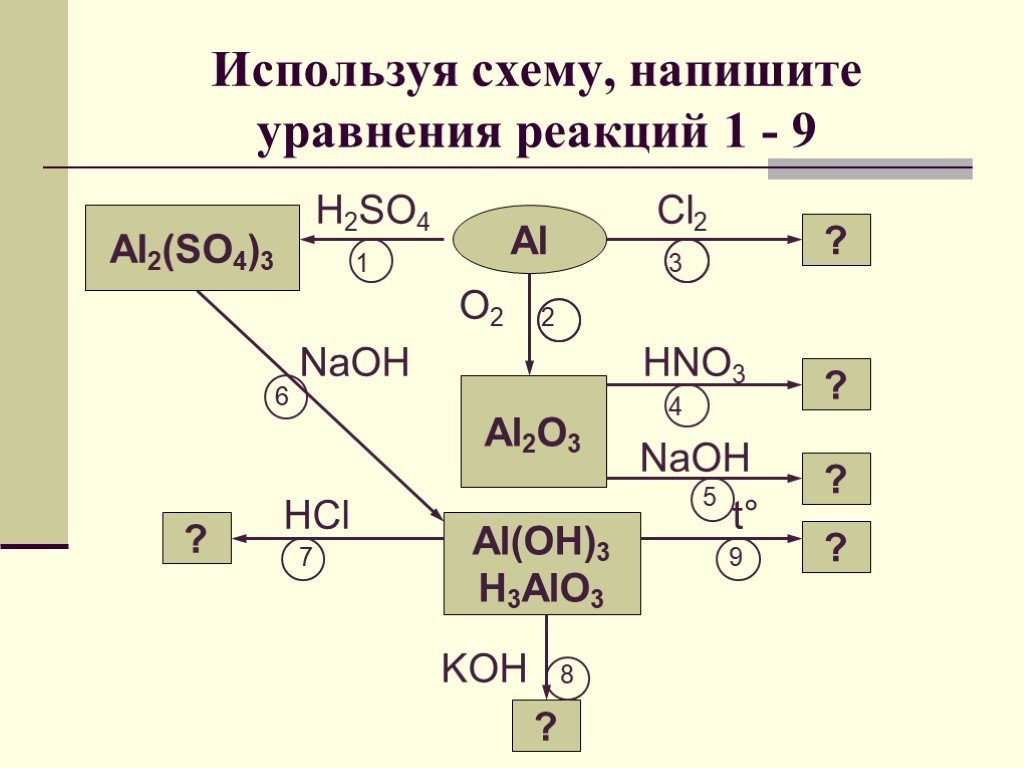
Алюминий и его соединения
Технологическая карта урока по химии. подготовила учитель химии МБОУ СОШ № 1 г.Тимашевск. . ИСПАЛОВА НАТАЛЬЯ СЕРГЕЕВНА. Тема урока. . Алюминий ...Алюминий и его соединения
Урок по теме "Алюминий и его соединения". Цели урока:. Общеобразовательные:. через систему познавательных задач расширить и углубить знания ...Алюминий и его соединения
А.К. 11 класс. 1 вариант. 1. По формуле 1S. 2. 2S. 2. 2P. 6. 3S. 2. 3P. 6. 4S. 2. 3d. 10. 4P. 2. укажите местоположение элемента в периодической ...Алюминий и его соединения
КГУ "Общеобразовательная школа-лицей при ПГК им. М. Жумабаева". Урок химии. Тема:. Алюминий и его соединения. 9 ...Кальций и его соединения
Дата_____________ Класс_______________. Тема: Кальций и его соединения. . Цели урока:. познакомить с важнейшими соединениями кальция, свойствами ...Фосфор и его соединения
Предлагаю разработку урока с использованием проектной деятельности. Тема урока «Фосфор и его соединения». Цель урока:. на основе базовых знаний ...Фосфор и его соединения
ТЕМА. . УРОКА:. «Фосфор и его соединения» (9 класс). . Цель. : выяснение общей характеристики фосфора на основании. положения в периодической ...Фосфор и его соединения
Тема урока: «Фосфор и его соединения». . Цель урока:. . • продолжить формирование понятий «элемент» и «вещество», а также показать многообразие ...Алюминий – металл будущего
План-конспект урока химии 9класс. Алюминий – металл будущего. Цели урока:. . . - изучить свойства металлов 3 А группы на примере алюминия,. ...Углерод и его соединения
Автор: . Абакумова Любовь Игоревна. Место работы, должность: . МБОУ СОШ №55 г. Воронеж. Учитель химии. Регион: . Город Воронеж. Стаж ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:27 октября 2018
Категория:Химия
Содержит:13 слайд(ов)
Поделись с друзьями:
Скачать презентацию