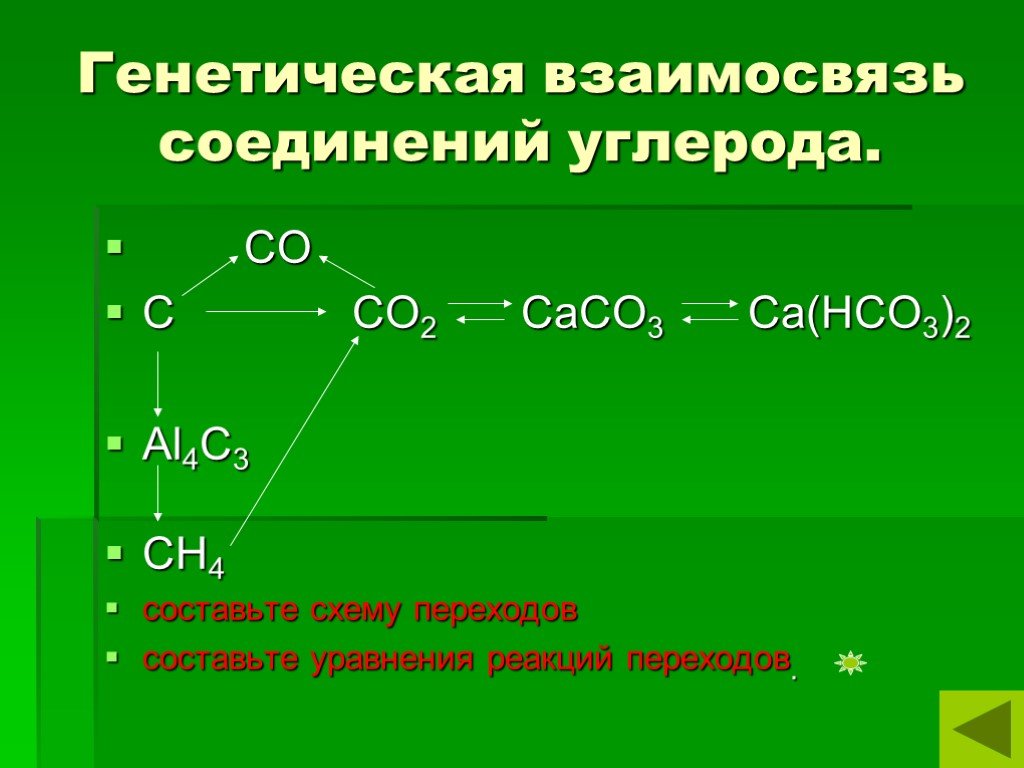
Презентация "Углерод и его соединения" по химии – проект, доклад
Презентацию на тему "Углерод и его соединения" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 10 слайд(ов).
Слайды презентации
Список похожих презентаций
Углерод и его соединения
Урок ведёт Шаркова Г. М. Присутствуют учащиеся 9 «а» класса. Цель Урока. • Повторить, систематизировать и расширить знания учащихся по данной теме ...Азот и его соединения
Содержание. Открытие Происхождение названия Круговорот азота в природе Азот в природе Получение Свойства Соединения азота Применение. Открытие. В ...Кобальт и его соединения
Аннотация. Кобальт – это белый, слегка желтоватый металл с розоватым или синеватым отливом. Существует в двух кристаллических модификациях:. α-Co ...Фосфор и его соединения и их свойства
Аллотропные модификации фосфора. Чёрный фосфор Красный фосфор Белый фосфор. Химические свойства фосфора. Горение фосфора. Оксиды фосфора. Взаимодействие ...Алюминий и его соединения
Стартовое задание. Выполнение задания А оценивается одним баллом. Выполнение задания В оценивается 2 баллами. Выполнение задания С оценивается 3 баллами. ...Алюминий и его соединения
Учителя химии: Гершановская Евгения Владимировна ГБОУ СОШ № 880 Город Москва Попова Светлана Анатольевна ГБОУ СОШ № 1465 Город Москва. СОДЕРЖАНИЕ. ...Алюминий и его соединения
Положение в Периодической системе. Алюминий располагается в 3 периоде, в главной подгруппе 3 группы. Порядковый номер элемента – 13 Относительная ...Фосфор и его соединения
Цель: исследовать влияние фосфора на рост и развитие растений. Задачи исследования: 1. Изучить влияние фосфора на рост и развитие растений; 2. Рассмотреть ...Цинк и его соединения
30Zn 1s22s22p63s23p64s23d10. d-элемент IV-го периода второй группы побочной подгруппы. Zn Строение. Нахождение в природе. По содержанию в земной коре ...Фосфор и его соединения
Строение атома. Символ элемента: P. Атомный номер: 15. Положение в таблице: 3-й период, группа - VA (2) Относительная атомная масса: 30.973761 Степени ...Углерод, соединения углерода
Цель занятия: обобщение, систематизация и углубление знаний по теме «Углерод и его соединения». Вопросник:. Элементы, содержащиеся в живых организмах. ...Кислородные соединения углерода
Взаимопроверка. Отметка: 10 правильных ответов – «5» 8-9 правильных ответов – «4» 5-7 правильных ответов – «3» Менее 5 – «2». Урок химии в 9 классе ...Углерод и его свойства
Строение атома углерода. Углерод (лат. Carboneum) С – химический элемент IV группы периодической системы Менделеева: атомный номер 6, атомная масса ...Кислородные соединения углерода
Угарный газ (СО)содержится в выхлопных газах автомобилей. Воздух, окутывающий Землю, содержит около 3 млрд. т. СО2. План изучения веществ. Состав ...Углерод и его свойства
Строение атома. В периодической таблице химических элементов углерод (С) расположен во втором периоде, в IV группе главной подгруппы. Углерод (С) ...Основные соединения кальция и их применение – вчера, сегодня, завтра
5 МЕСТО ПО РАСПРОСТРАНЕННОСТИ В ПРИРОДЕ. 100 кг кальция !!! Кальцит. Мел Мрамор Известняк. Владимирский собор. Нижегородский собор. Церковь Покрова ...Кислородные соединения углерода
Без углерода не существует ни одного растения или животного... Кристаллическая решетка графита (плоскостная). Кристаллическая решетка алмаза (тетраэдрическая). ...Железо, его соединения и их свойства
Задачи:. Проверить знание основных теоретических вопросов темы “Железо и его соединения”; Развивать умения составлять электронный баланс и уравнения, ...Кремний и его соединения
Короткова Фаина Алексеевна, учитель химии и биологии МБОУ Летуновской СОШ. Контактная информация: - e-mail: korotkova_faina@mail.ru - тел. +7 903 ...Кремний и его соединения
Дать общую характеристику элементу кремний. Рассмотреть природные соединения кремния. Провести сравнительный анализ с соединениями углерода. Изучить ...Конспекты
Углерод и его соединения
Автор: . Абакумова Любовь Игоревна. Место работы, должность: . МБОУ СОШ №55 г. Воронеж. Учитель химии. Регион: . Город Воронеж. Стаж ...Углерод и его соединения
МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «КУЛУНДИНСКАЯ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №1» , учитель химии высшей квалификационной категории ...Алюминий и его соединения
КГУ "Общеобразовательная школа-лицей при ПГК им. М. Жумабаева". Урок химии. Тема:. Алюминий и его соединения. 9 ...Алюминий и его соединения
Урок по теме "Алюминий и его соединения". Цели урока:. Общеобразовательные:. через систему познавательных задач расширить и углубить знания ...Алюминий и его соединения
Технологическая карта урока по химии. подготовила учитель химии МБОУ СОШ № 1 г.Тимашевск. . ИСПАЛОВА НАТАЛЬЯ СЕРГЕЕВНА. Тема урока. . Алюминий ...Алюминий и его соединения
А.К. 11 класс. 1 вариант. 1. По формуле 1S. 2. 2S. 2. 2P. 6. 3S. 2. 3P. 6. 4S. 2. 3d. 10. 4P. 2. укажите местоположение элемента в периодической ...Фосфор и его соединения
Предлагаю разработку урока с использованием проектной деятельности. Тема урока «Фосфор и его соединения». Цель урока:. на основе базовых знаний ...Фосфор и его соединения
Тема урока: «Фосфор и его соединения». . Цель урока:. . • продолжить формирование понятий «элемент» и «вещество», а также показать многообразие ...Фосфор и его соединения
Урок по химии в 9 классе на тему: «Фосфор и его соединения». Цель урока:. Познакомить учащихся с историей открытия фосфора, его аллотропными ...Фосфор и его соединения
ТЕМА. . УРОКА:. «Фосфор и его соединения» (9 класс). . Цель. : выяснение общей характеристики фосфора на основании. положения в периодической ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:3 марта 2019
Категория:Химия
Содержит:10 слайд(ов)
Поделись с друзьями:
Скачать презентацию