Презентация "Химия наука о веществах" – проект, доклад
Презентацию на тему "Химия наука о веществах" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 16 слайд(ов).
Слайды презентации
Список похожих презентаций
Химия наука о веществах и их превращениях
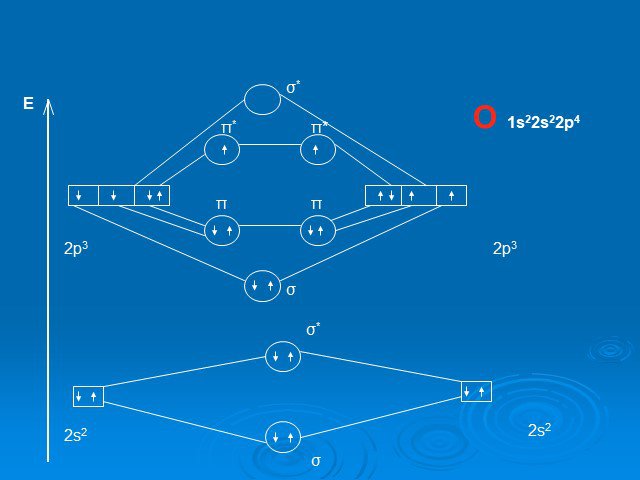
Для полного описания его движения используются 4 квантового числа: n = 1,2,3,... главное квантовое число и определяет общую энергию электрона. L - ...Химия – наука о веществах, их свойствах и превращениях
Техника безопасности в кабинете химии. Вещества хранятся в емкостях с плотно притертыми пробками.. При проведении опытов строго соблюдайте инструкции ...Органическая химия как наука
Содержание. Знакомство с историей возникновения науки органическая химия Органические вещества Схемы реакций Органическая химия Электронное строение ...Биохимия как наука
Биохимия может быть определена как химия живых объектов (клеток и организмов). Структуры живых объектов обычно образуются из простых неорганических ...Химия – наука чудес и превращений
ХИМИЧЕСКИЙ ТУРНИР «Химия- наука чудес и превращений». Девиз: «Химии требуется не такой, который из одного чтения книг понял всю науку, но который ...Химия в разных науках
Химия в географии.Практическая химия.
15 10 30.
Химия в литературе. 5 мая 1821 на Острове Святой Елены скончался император Франции, великий французский ...
Химия как наука
Специфика химии как науки (определение предмета химии). Наука о химических элементах и их соединениях. Наука о веществах и их превращениях. Наука ...Химия и литература. Точки соприкосновения
Цели и задачи исследовательской работы: изучить и проанализировать отрывки из произведений художественной литературы; проделать серию экспериментов, ...Химия и здоровье
Цель: расширить знания учащихся о том, как сохранить и укрепить здоровье. Девиз урока: О, сколько нам открытий чудных Готовят просвещенья дух И опыт, ...Химия здоровья
«Цель химии состоит не в изготовлении золота и серебра, а в изготовлении лекарств». Парацельс (1493-1541), швейцарский врач. Прочитайте текст и выполните ...Химия цвета
металлы. Неорганические вещества. йод. Органические вещества. Техника выполнения опыта. Смочите кусочки фильтровальной бумаги растворами солей натрия, ...Химия на службе искусства(на примере древнерусской живописи)
«Химия и искусство имеют внутреннюю общность, которая коренится в их творческой природе...» Марселен Бертло. Цели и задачи. Цель: показать взаимосвязь ...Химия и реклама
Панфилова А. МОСШ №10. «Жевательная резинка с ксилитом и карбамидом – двойная защита от кариеса». ксилит не защищает от кариеса, но и не является ...Химия и окружающая среда
Задачи: повышение интеллектуального и культурного уровня, расширение кругозора учеников в области химии и экологии; повышение интереса к данным предметам ...Химия и повседневная жизнь человека
Цель: использовать и понимать сущность химических явлений в повседневной жизни. Задача: правильно выбрать различные материалы и пробудить интерес ...Химия - страна чудес
- очень древняя наука. Выдающиеся русские химики. М.В. Ломоносов Д.И.Менделеев А.М.Бутлеров (1834-1907) (1711-1765) (1828-1886). химия физика медицина ...Интерактивная игра "Химия в ребусах: Химические элементы"
НИКЕЛЬ. ИОД. АЗОТ. БОР. МАГНИЙ Й. МАРГАНЕЦ. КРЕМНИЙ Л=й. МЫШЬЯК. УГЛЕРОД О. ЦИРКОНИЙ. АРГОН. МЕДЬ ДВЕ. КРИПТОН. ЗОЛОТО. СЕРА П=А. ВОДОРОД А=О Т=Д. ...Химия - решение задач
В этой презентации представлены материалы из пособия по химии «Решение расчетных задач школьного курса химии 8-11 классов». Решение задач 1-го типа ...Химия
ВУЗы, для поступления в которые нужно сдавать ЕГЭ по химии Медицинский университет Политехнический университет Сельскохозяйственная академия Педагогический ...Химия
Целью данных уроков является:. В занимательной форме повторить и обобщить материал базового курса химии; Научить применять полученые знания для решения ...Конспекты
Химия как наука
Муниципальное бюджетное общеобразовательное учреждение города Новосибирска. "Средняя общеобразовательная школа № 78". . Химия ...Химия на досуге
Внеклассное мероприятие «Химия на досуге». Цель мероприятия: Развивать интерес к предмету химия, смекалку, эрудицию, умение чётко и быстро формулировать ...Химия как часть естествознания
7 класс. Естествознание. . Урок 1 Химия как часть естествознания. Предмет химии. Цель:. знакомство с понятиями тело, вещество, свойства веществ; ...Химия и повседневная жизнь человека
Тема урока в 9 классе. Химия и повседневная жизнь человека. Цель урока:. Определить роль химической науки в современной жизни и доказать, что ...Химия и повседневная жизнь человека
Брусова Татьяна Викторовна. МБОУ « СудогодскаяСОШ №2» г. Судогда. Учитель химии. Урок по химии в 11 классе. . . Тема «Химия и повседневная ...Химия и общество
Бюджетное образовательное учреждение г.Омска. . «Средняя общеобразовательная школа№15». Конспект урока по химии в 9 классе. «ХИМИЯ И ОБЩЕСТВО». ...Химия и повседневная жизнь
Урок химии в 11 классе «Химия и повседневная жизнь». Учитель Зеленкина О.В. Цель: создать условия для изучения темы урока, понимания значения химических ...Химия и кулинария
Методическая разработка внеклассного мероприятия. на тему: «Химия и кулинария». (Аукцион). Автор: учитель химии. . Бижоева Лариса Аскеровна. ...Химия в руках художника
. Муниципальное бюджетное общеобразовательное учреждение. «Гимназия №32». г.Нижнекамск Республика Татарстан. Конспект интегрированного ...Химия в моей жизни
МАОУ СОШ № 170 г. Екатеринбурга. Химия в моей жизни. . . Программа элективного курса. . . . . Дубровина Елена Николаевна,. . ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:15 января 2015
Категория:Химия
Содержит:16 слайд(ов)
Поделись с друзьями:
Скачать презентацию