Презентация "Характеристика щелочных металлов" по химии – проект, доклад
Презентацию на тему "Характеристика щелочных металлов" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 17 слайд(ов).
Слайды презентации
Список похожих презентаций
Характеристика щелочных металлов
Металлы Сu, Au, Ag не взаимодействуют с водой даже при нагревании. Металлы обладают электропроводностью и теплопроводностью. Для металлов характерна ...Сравнительная характеристика металлов и их соединений
Пирит. Берилл. . Корунд (Al2O3). Рубин. Сапфир. Необычные кристаллы поваренной соли - "искусственные кораллы". Кристаллы соли Соляная шахта. Серебро. ...Общая характеристика металлов главных подгрупп I-III
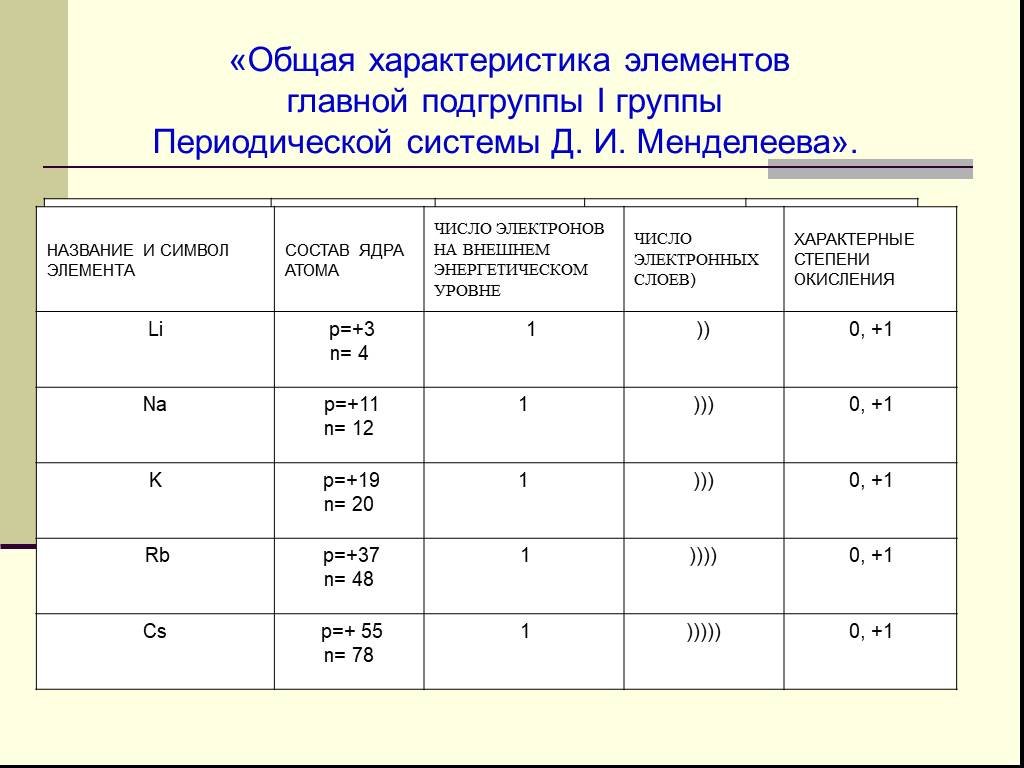
Характеристика металлов главной подгруппы I группы. Щелочны́е мета́ллы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Эти металлы ...Металы. Общая характеристика металлов. Физические свойства и применение металлов
Цели урока: повторить и обобщить сведения о металлической химической связи и кристаллической металлической решетке. Изучить общие физические свойства ...Характеристика неметаллов
Элементы с неметаллическими свойствами находятся в IIIA-VIIA - группах Периодической системы: III IV V VI VII B С N O F Si P S CI As Se Br Te I At. ...Химические свойства металлов
Верите ли вы, что … Металлы занимают верхний левый угол в ПСХЭ. В кристаллах атомы металла связаны металлической связью. Валентные электроны металлов ...Грозит ли миру военный конфликт из-за металлов?
Плотность металлов. Металлы Лёгкие ρ5 гр/см3. Вся авиационная техника построена на основе сплавов лёгких металлов. Ртуть плотность - 14,19 г/см3. ...Изучение свойств оксидов металлов
Цель: определить характер оксидов металлов, имеющихся в школьной лаборатории (оксиды бария, железа, кальция, меди, свинца), изучить их свойства. Задачи: ...Способы получение металлов
Распространенность металлов в природе. Нахождение металлов в природе. Очень активные металлы. Неактивные (благородные). Средней активности. Важнейшие ...Сплавы металлов
Сплавы – это материалы с характерными свойствами, состоящие из двух или более компонентов, из которых по крайней мере один – металл. СПЛАВЫ. однородные ...Свойства черных и цветных металлов
Что такое металлы и сплавы? Металл — это вещество, обладающее ярким блеском и хорошей проводимостью тепла и электричества. Сплав — макроскопически ...Коррозия металлов
Коррозия – от лат. corrodere - разъедать. Ежегодно 1/4 всего произведенного Fe теряется из-за коррозии. Химически чистое железо не ржавеет, т.к. не ...Коррозия металлов
Зачем нужны металлы? Что вы узнаете (план изучения темы). Физические свойства металлов. Химические свойства металлов. Mеталлы в нашей жизни. Металлическая ...Коррозия металлов
Коррозия – рыжая крыса, Грызет металлический лом. В Шефнер. - называют самопроизвольное разрушение металлов и сплавов под влиянием окружающей среды ...Коррозия металлов
Цель. Исследовать действие факторов окружающей среды на степень ржавления металлов. Гипотеза Если поместить железо в щелочную среду, то скорость коррозии ...Качественные реакции на ионы металлов
Проблемный вопрос: каким образом можно определить ионы металлов в растворах. Цель работы: научиться определять ионы металлов Задачи: расширить знания ...История металлов
Цель:. Рассказать об открытии металлов. Гипотеза:. Возможно открытие металлов никак не повлияло на развитие цивилизаций. Медь. История цивилизаций ...Электронная проводимость металлов
Лекция 13. Тема: Классическая теория электропроводности металлов. 13.1.Классическое представление об электропроводности металлов. Экспериментальные ...Свойства металлов
План реферата. Положение металлов в периодической системе Д.И. Менделеева. Строение атомов металлов, кристаллических решеток. Физические свойства ...Коррозия металлов
«Ржа ест железо». . По виду коррозионной среды. газовая; жидкостная: - кислотная, щелочная, - солевая; атмосферная; почвенная. По характеру разрушения. ...Конспекты
Характеристика щелочных металлов
Тема урока: Характеристика щелочных металлов. Цель урока:. . дать общую характеристику щелочных металлов по положению в периодической таблице ...Общая характеристика металлов и неметаллов
П . лан- конспект урока "Общая характеристика металлов и неметаллов". . Девиз урока. : “Зажечь, увлечь и повести”. . Цели. В нетрадиционной ...Химические свойства щелочных металлов
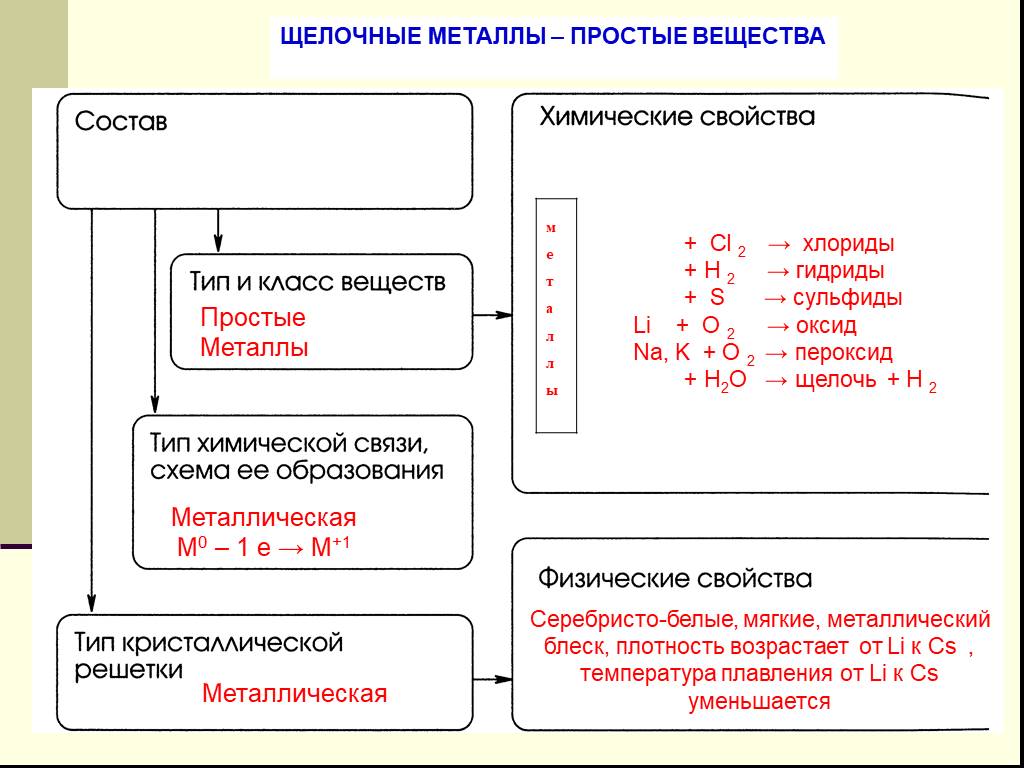
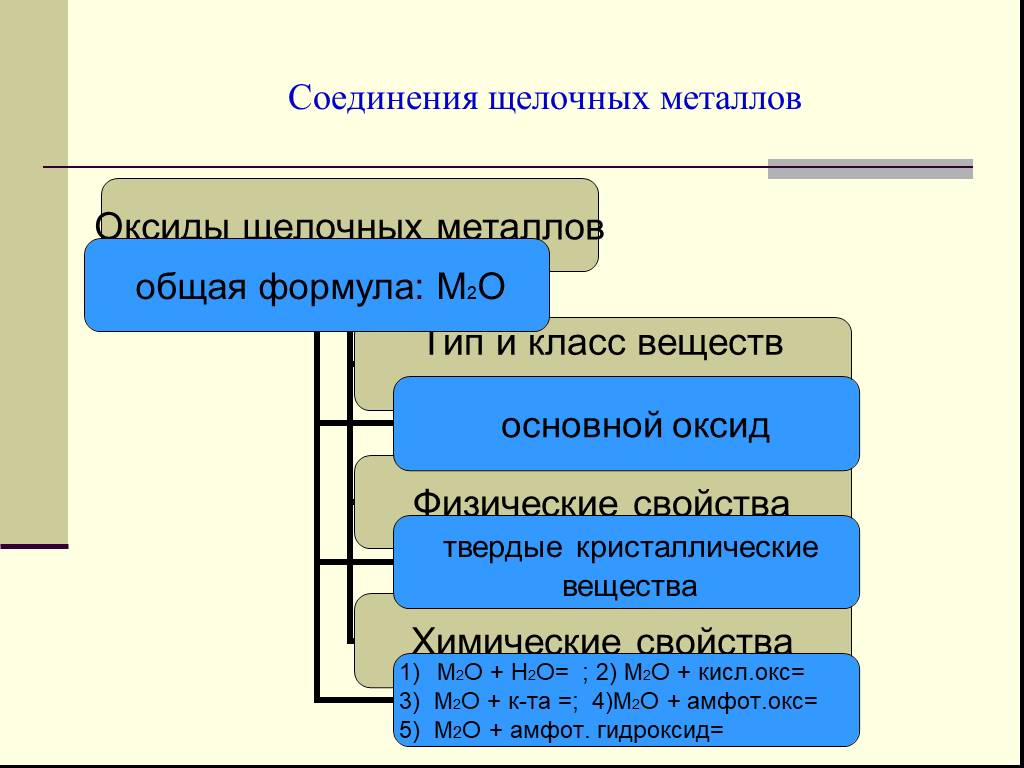
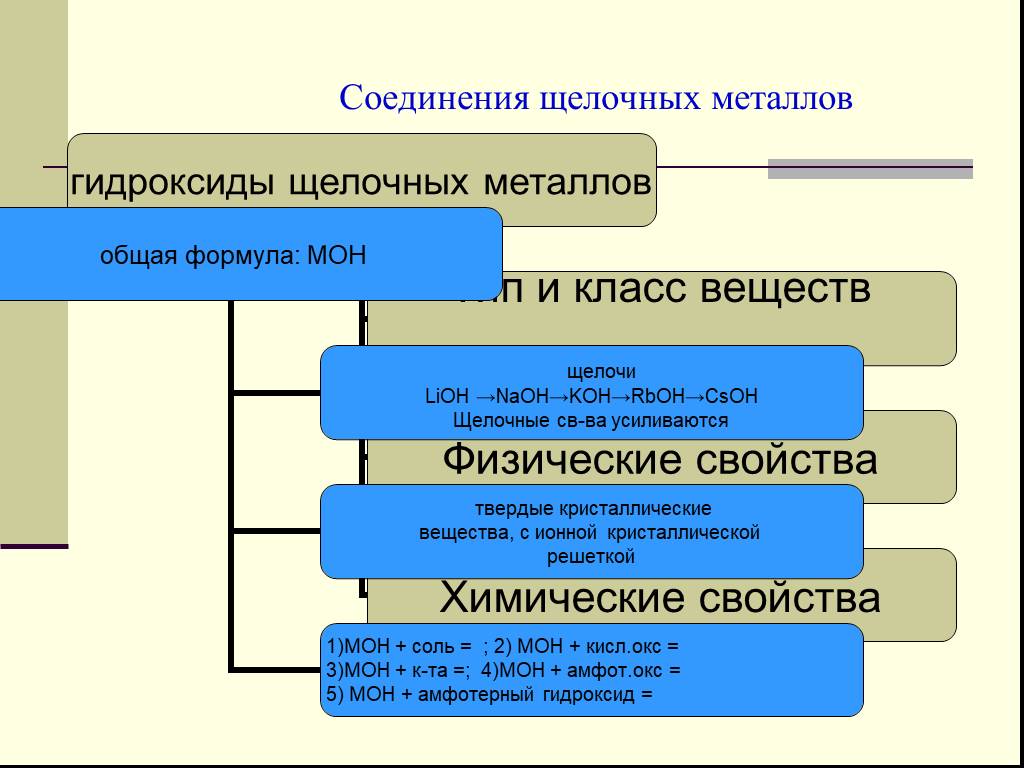
. МБОУ «Леплейская СОШ». Урок на тему:. «Химические свойства щелочных металлов». Класс:9. Продолжительность урока:45 ...Химические свойства соединений щелочных и щелочноземельных металлов. Жесткость воды
Муниципальное общеобразовательное учреждение. Бельская средняя общеобразовательная школа. г. Белый Тверской области. Конспект урока по химии ...Общая характеристика металлов и их значение для человека
Технология развития критического мышления. Интегрированный урок химии - биологии. на тему: «Общая характеристика металлов и их значение для человека». ...Характеристика металлов II группы главной подгруппы
Тема урока:. . Характеристика металлов. II. группы главной подгруппы. Цель урока: дать характеристику металлов II. группы главной подгруппы. ...Химические свойства металлов и их соединений
Муниципальное общеобразовательное автономное учреждение. «Средняя общеобразовательная школа № 5 города Соль – Илецка». Оренбургской области. ...Химические свойства металлов
Губарева Вера Александровна, г.Нижнекамск РТ. . Муниципальное общеобразовательное учреждение. «Средняя общеобразовательная школа №7». Г.Нижнекамск, ...Химические свойства металлов
Химические свойства металлов (9 класс). Заведующий экспериментальной. . площадкой,. учитель химии,. . ГБОУ СОШ № 200. Чупина Н.А. Цель:. ...Химические свойства металлов
Аннотация. Тема урока: Химические свойства металлов. Разработчик: Саляхова Гульгена Габдулловна – учитель биологии. Данный план-конспект урока ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:7 февраля 2019
Категория:Химия
Содержит:17 слайд(ов)
Поделись с друзьями:
Скачать презентацию




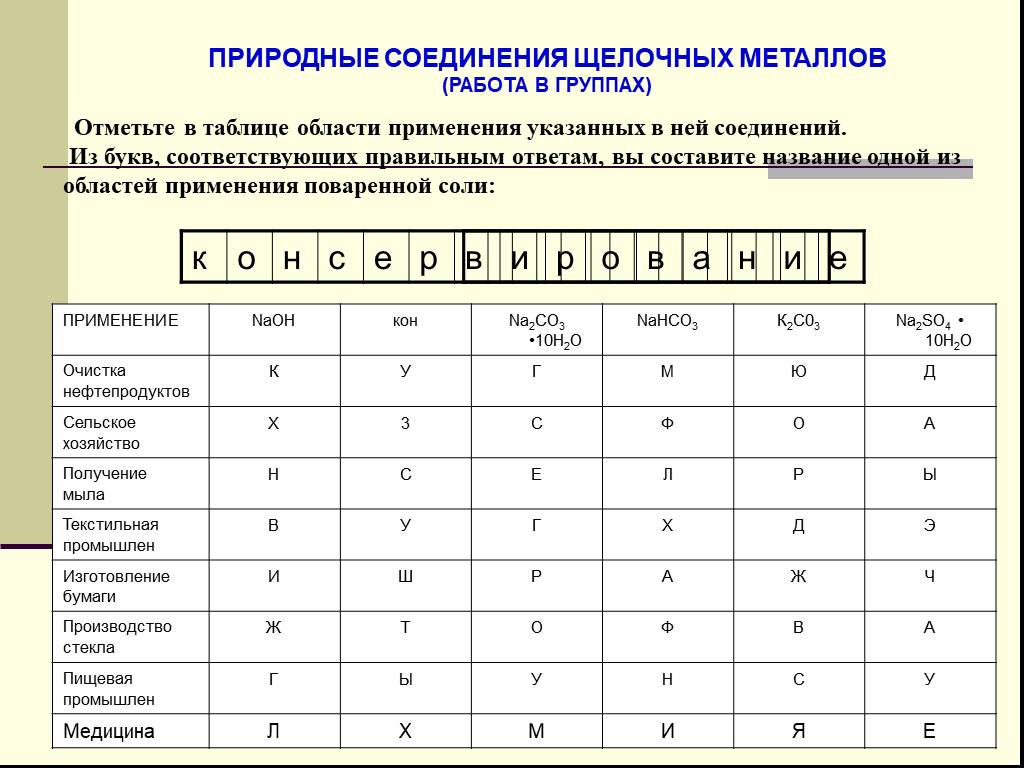














![Литий (Lithium) 3Li. Литий – самый лёгкий серебристо – белый металл. Открыт в 1817 году шведским химиком А.Арфведсоном при анализе минерала петалита LiAl[Si4O10] С греческого «литеос» - означает «камень». Литий (Lithium) 3Li. Литий – самый лёгкий серебристо – белый металл. Открыт в 1817 году шведским химиком А.Арфведсоном при анализе минерала петалита LiAl[Si4O10] С греческого «литеос» - означает «камень».](https://prezentacii.org/upload/cloud/19/02/121299/images/thumbs/screen9.jpg)






































