Конспект урока «Характеристика металлов II группы главной подгруппы» по химии
Тема урока:
Характеристика металлов II группы главной подгруппы.
Цель урока: дать характеристику металлов II группы главной подгруппы.
Задачи:
обучающая: - изучить общую характеристику металлов главной
подгруппы II группы;
- основные физические и
химические свойства простых веществ, образованных
этими элементами;
развивающая: - использовать знания, полученные на уроках, при
подготовке к экзаменам по химии и биологии;
воспитательная: - воспитание осторожности при проведении опытов,
- осознание необходимости использования знаний
разных предметов при подготовке к экзаменам.
Оборудование и реактивы: пробирки, штативы для пробирок,
образцы металлов – магний, кальций;
фенолфталеин, вода.
Ход урока:
-
Проверка домашнего задания:
а) Тестовые задания (из вариантов ГИА по химии)
1. Заряд ядра атома калия равен 1) 39 2) 20 3) 40 4) 19
2. В уравнении реакции натрия с водой коэффициент перед формулой водорода равен: 1) 1 2) 2 3) 3 4) 4
3. К щелочам относится:
1) гидрокарбонат кальция, 3) гидроксид алюминия
2) гидроксид калия 4) оксид натрия
4. Химическая связь в оксиде калия
1) ковалентная полярная 3) ионная
2) ковалентная неполярная 4) металлическая
5. Раствор гидроксида натрия реагирует с
1) оксидом серы ( IV) 3) углеродом
2) нитратом кальция 4) оксидом меди (II)
6. В ряду химических элементов Rb – K – Na
1) уменьшаются радиусы атомов
2) увеличивается электроотрицательность
3) увеличивается число электронов во внешнем электронном слое
4) усиливаются металлические свойства
5) увеличивается число заполненных электронных слоев в атомах
( 1 – 4, 2 – 1, 3 – 2, 4 – 3, 5 – 1, 6 – 1,2 )
б) Составьте уравнения химических реакций, о которых идет
речь в тексте.
Литий активно соединяется с водородом: небольшое количество металла может связать большой объем этого газа. Таблетки гидрида лития используют как портативный источник водорода при авариях над морем: под действием воды они быстро разлагаются, наполняя водородом спасательные лодки и жилеты.
( 2 Li + H2 =2 LiH ; LiH + H2O = LiOH + H2)
в) Запишите формулы или названия веществ: (подобное задание будет в контрольной работе)
1) кристаллическая сода –
2) пищевая сода –
3) каустическая сода –
4) К2СО3 -
5) NaСI –
г) Задания из ГИА по биологии.
1. Процесс свертывания крови у человека может нарушиться при недостатке в организме 1) магния, 2) железа, 3) натрия, 4) кальция ?
2. Какие вещества придают костям твердость?
1) белки и жиры, 3) глюкоза и гликоген
2) соли кальция и фосфора 4) аминокислоты и нуклеиновые кислоты
Уверенно ответить на эти вопросы поможет тема сегодняшнего урока.
II. Изучение новой темы.
Тема урока: Характеристика металлов II группы главной подгруппы.
Цель урока: изучить общую характеристику металлов главной
подгруппы II группы; основные физические и химические
свойства этих элементов.
Учащиеся вспоминают и называют план изучения щелочных металлов:
1) Положение элементов в ПСХЭ. Состав подгруппы.
2) Строение атома.
3) Простые вещества: физические свойства, химические свойства.
4) Важнейшие соединения металлов. (изучим на следующем уроке).
1) Положение элементов в ПСХЭ. Состав подгруппы.
-
Ученики записывают и называют элементы II группы главной подгруппы Ве, Mg, Са, Sr, Ba, Ra.
Учитель сообщает , что в отличии от металлов главной подгруппы 1 группы, которые все относят к группе ЩМ, не все элементы главной подгруппы II группы относят к естественному семейству - ЩЗМ. Причины этого состоят в определенном различии свойств этих элементов. К ЩЗМ относят элементы: Са и следующие за ним элементы в подгруппе (учащиеся перечисляют их сами – Sr, Ba, Ra.) Происхождение названия этого семейства связано с тем, что гидроксиды кальция, стронция, бария, так же, как и гидроксиды натрия и калия, обладают щелочными свойствами, оксиды же этих Ме по их тугоплавкости сходны с оксидами алюминия и тяжелых металлов, носившими прежде общее название земель.
2) Строение атомов
-
Ребята составляют схемы строения атомов Ве, Mg, Са и указывают сходство (одинаковое строение внешнего электронного слоя – 2 электрона). Отсюда можно сделать вывод, что элементы II группы главной подгруппы проявляют постоянную степень окисления +2 (восстановительные свойства).
3) А. Учитель демонстрирует классу образцы металлов магния и кальция (в ампулах). Как видим условия хранения магния и кальция различны. Как это можно объяснить?
-
Учащиеся изучают физические характеристики и условия хранения металлов:
| Физические свойства | Условия хранения | |
| Бериллий | Светло-серый, достаточно твердый, хрупкий металл | На воздухе |
| Магний | Относительно мягкий, пластичный и ковкий металл | |
| Кальций | Достаточно твердый, пластичный металл | Под слоем керосина или же в запаянных ампулах |
| Стронций | Ковкий, имеет золотистый оттенок | |
| Барий | Пластичный, ковкий металл | |
| Радий | Радиоактивный элемент. |
3) Б. Исходя из электронного строения атомов ЩЗМ, охарактеризуйте их химические свойства:
-
Учащиеся составляют схему:
Ме – nе = Ме+n
Восстановители
Ве, Mg, Са, Sr, Ba, Ra.

Восстановительные свойства возрастают
-
Теперь объясните, почему отличаются условия хранения магния и ЩЗМ ? (химическая активность Mg ниже, чем у щелочноземельных металлов).
 Химические свойства металлов
Химические свойства металлов

С простыми веществами Со сложными веществами
О2, Н2, S, СI2, … Н2О, кислоты, соли, оксиды Ме
(ЩЗМ взаимодействуют с Ве не взаимодействует с водой,
кислородом, галогенами при обычной т.к. образуется защитная пленка
температуре. Для реакции с другими на его поверхности.
неметаллами необходимо нагревание.) Са и Mg взаимодействует с
Составить уравнение реакции водой подобно ЩМ.
горения магния. Где применяли эту Составьте уравнения реакций.
реакцию? Учащиеся проводят реакцию
Прочитать с. 61, 2 абзац - учебник. взаимодействия этих Ме с
Учитель демонстрирует реакцию водой в присутствии фенол -
горения магния. фталеина.
-
Составить уравнения реакций, характеризующих свойства ЩЗМ:
Mg + О2 = Ве + Н2О =
 Са + Н2 = Mg + СuSO4 =
Са + Н2 = Mg + СuSO4 =
Са + СI2 = Са + Н2SО4 =
-
Какие свойства проявляют Ме в этих реакциях ?


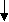 2е
2е
 2Mg0 + О20 = 2Mg+2 О-2
2Mg0 + О20 = 2Mg+2 О-2
восстановитель
Кальций и магний взаимодействуют с оксидами редких металлов ( Ne № 41, Mo № 42, Ti № 22). Эти реакции используют для получения редких металлов: 2Mg + Ti О2 = 2Mg О + Ti – магниетермия,
5Са + V2О5 = 5Са О + 2V – кальциетермия.
4. Значение магния и кальция для живых организмов.
-
Учащиеся изучают самостоятельно по тексту учебника: с. 66.
Кальций : Са2+ - участвует в свертывании крови,
Тело человека содержит – 1,5 % Са,
Кости – 98% Са
Суточная потребность – 1,5 г в день.
Магний : - стимулирует обмен веществ (входит в состав биологических
катализаторов),
- входит в состав хлорофилла – пигмента, участвующего в
фотосинтезе.)
III. Закрепление знаний.
А) Ответить на вопросы заданий из ГИА по биологии.
1. Процесс свертывания крови у человека может нарушиться при недостатке в организме: 1) магния, 2) железа, 3) натрия, 4) кальция ?
2. Какие вещества придают костям твердость?
1) белки и жиры, 3) глюкоза и гликоген
2) соли кальция и фосфора 4) аминокислоты и нуклеиновые кислоты
Б) 1. Расположите металлы в порядке усиления восстановительных свойств:
Са, Ве, Ba, Mg, Sr, Ra.
-
С какими из перечисленных веществ: кислород, сера, хлор, водород, вода, гидроксид натрия, серная кислота, хлорид калия реагирует кальций ?
IV. Домашнее задание:
-
Прочитать § 12 с. 60-62, 66,
-
Выполнить задания № 2, 5.
Литература:
Габриелян О.С. Химия. 9 класс. – М.: Дрофа, 2010
Габриелян О.С., Остроумова И.Г. Настольная книга учителя. Химия. 9 кл.: Методическое пособие. - М.: Дрофа
Здесь представлен конспект к уроку на тему «Характеристика металлов II группы главной подгруппы», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

