Презентация "Щелочные металлы" (9 класс) по химии – проект, доклад
Презентацию на тему "Щелочные металлы" (9 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 41 слайд(ов).
Слайды презентации
Список похожих презентаций
Щелочные металлы
Строение и свойства атомов. Щелочные металлы – это элементы главной подгруппы I группы Периодической системы химических элементов Д.И. Менделеева: ...Щелочные металлы и галогены
Тема урока:. Щелочные металлы, инертные элементы и галогены. Цель урока:. познакомить учащихся с физическими и химическими свойствами щелочных металлов, ...Щелочные металлы - элементы I группы главной подгруппы
Li Na K Rb Cs Fr. Физические свойства щелочных металлов:. Серебристого цвета Мягкие, легко режутся ножом Твердость от Li → Na → K → Rb → Cs → Fr уменьшается: ...Щелочные металлы
Отгадайте фамилию русского ученого, который сказал: «Металлом называется светлое тело, которое ковать можно».Самый тугоплавкий. Самый распространенный ...
Щелочные металлы
В одном царстве-государстве Жили-были, не тужили Галогены удалые И металлы щелочные. Скупых галогенов-окислителей В народе прозвали грабителями. А ...Щелочные металлы
Цель: повторить свойства металлов, систематизировать и углубить знания о щелочных металлах на основании их сравнительной характеристики. Сформировать ...Щелочные металлы
Химические элементы главной подгруппы IА группы периодической системы элементов Д. И. Менделеева: Li, Na, К, Rb, Cs, Fr. Название получили от гидрооксидов ...Щелочные металлы
Щелочны́е мета́ллы — элементы главной подгруппы I группы Периодической системы химических элементов Д. И. Менделеева: литий Li, натрий Na, калий K, ...Щелочные металлы
Цель урока:. Дать общую характеристику щелочным металлам. Рассмотреть их электронное строение, сравнить физические и химические свойства. Узнать о ...Химия. Щелочные металлы
Меню. Строение и свойства атомов. От металла к неметаллу. Добрый Литий. А где выгода? Открытие щелочных металлов. В чем же отличие? Самый известный ...Щелочные металлы
Щелочные металлы. Периодическая система химических элементов Д.И.Менделеева. Группы элементов I III II VIII IV V VI VII 2 1 4 5 6 7 10 F фтор 9 18.9984 ...Металлы IА-группы щелочные металлы
14.11.2018 Что узнаем…. Положение щелочных металлов в Периодической системе Изменение свойств в группе История названия Нахождение в природе Физические ...Щелочные и щелочноземельные металлы
Щелочные металлы – элементы IA группы. Перечислите известные вам щелочные металлы. Сколько электронов на внешнем энергетическом уровне у атомов всех ...Щелочноземельные металлы
Щелочноземельные металлы. Хочу узнать. Физические свойства ЩЗ металлов; Химические свойства ЩЗ металлов; Применение. Цели урока:. Изучить физические, ...Щёлочноземельные металлы
Они живут в семиэтажном доме, На внешнем уровне имея электрона ДВА. В квартирах восстановителей-героев, Вы угадали кто это, друзья? Щёлочноземельные ...Простые вещества металлы
медь. серебро. ртуть. Металлы, простые вещества, обладающие в обычных условиях, характерными физическими и химическими свойствами. 1. Характерные ...Химия металлы
Положение металлов в Периодической системе Строение атомов Кристаллические решётки Общие физические свойства Металлы в природе Способы получения металлов ...Химические элементы металлы и здоровье человека
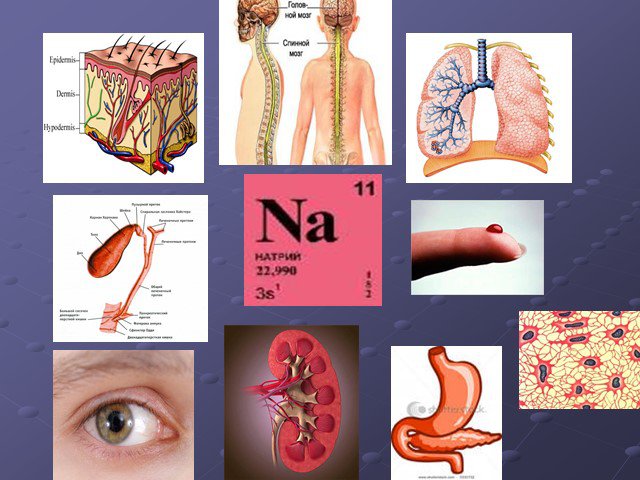
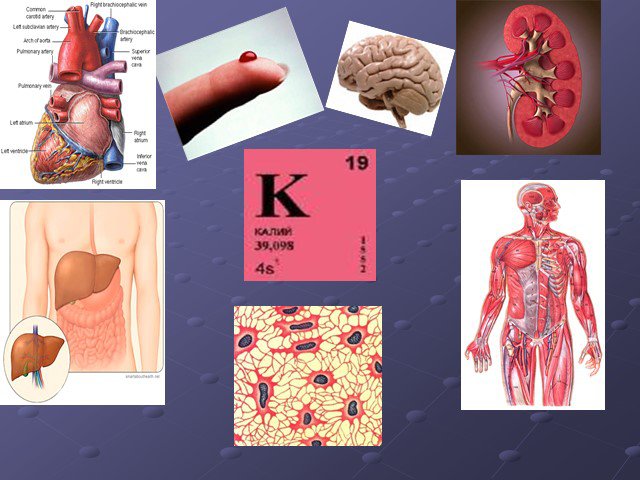
Ионы этого металла входят в состав вещества, употребляемого в пищу и называемого «белой смертью». Существенными источниками этого элемента являются ...Тяжёлые металлы
РАССМОТРЕТЬ ВЛИЯНИЕ ТЯЖЕЛЫХ МЕТАЛЛОВ НА ОРГАНИЗМ ЧЕЛОВЕКА И ИСПОЛЬЗОВАТЬ ПОЛУЧЕННЫЕ ЗНАНИЯ В ДАЛЬНЕЙШЕЙ ЖИЗНИ. ТЯЖЕЛЫЕ МЕТАЛЛЫ. ЦЕЛЬ:. ОБЪЕКТ ИССЛЕДОВАНИЯ:. ...Простые вещества: металлы и неметаллы
I Стадия «Вызова». Верите ли вы в то, что: Среди известных химических элементов большая часть – металлы? (да) Металлы бывают жидкие (да) «Оловянная ...Конспекты
Щелочные металлы
. Урок химии в 9 классе. Щелочные металлы. Цели урока:. Дать общую характеристику ЩМ. Рассмотреть их атомное строение, основные физические, ...Щелочные металлы. Нахождение в природе, свойства и применение
Дата_____________ Класс_______________. Тема: Щелочные металлы. Нахождение в природе, свойства и применение. . Цели урока:. расширить и углубить ...Щелочные металлы
Муниципальное бюджетное общеобразовательное учреждение. «Гимназия №32». Конспект урока по химии в 9 классе. тема урока " Щелочные ...Щелочные металлы
МБОУ «СОШ № 36». учитель химии. . Курган Юлия Сергеевна. Тема урока: Щелочные металлы. Задачи урока:. Образовательная – ознакомить ...Общая характеристика металлов. Металлы главных и побочных подгрупп. Щелочные металлы и их важнейшие соединения
План учебного занятия № 10. Дата Предмет. химия. группа. Ф.И.О. преподавателя. : Кайырбекова И.А. . І. Тема занятия:. Общая характеристика металлов. ...Щелочные металлы
Муниципальное бюджетное общеобразовательное учреждение. «Гимназия №32». Конспект урока по химии в 9 классе. тема урока " Щелочные ...Металлы. Щелочные металлы
ПЛАН-КОНСПЕКТ УРОКА Щелочные металлы. . ФИО (полностью). . . Пономарева Л.Н. . . . Место работы. . . . . . ...Способы классификации химических элементов. Понятие про щелочные металлы и галогены
Тема:. . Способы классификации химических элементов. Понятие про щелочные металлы и галогены. . . Цель:. . Закрепить знания учащихся о ...Удивительные металлы
Удивительные металлы. Цель урока:. Повторить и обобщить сведения о металлах. . как химических элементах , и как простых веществах. Задачи ...Простые вещества – металлы
Нижнекамский муниципальный район. г. Нижнекамск. Муниципальное бюджетное образовательное учреждение. «Средняя общеобразовательная школа №10. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:13 октября 2015
Категория:Химия
Классы:
Содержит:41 слайд(ов)
Поделись с друзьями:
Скачать презентацию




















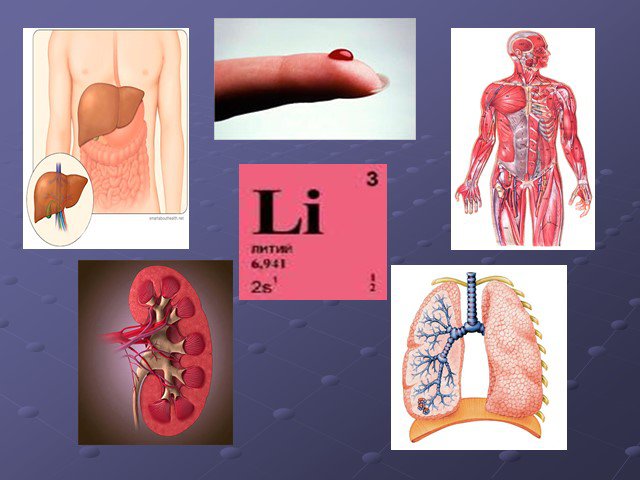






















![ЛИТИЙ (Lithium). 3Li Литий – самый лёгкий серебристо – белый металл. Открыт в 1817 году шведским химиком А.Арфведсоном при анализе минералапеталита LiAl[Si4O10] ЛИТИЙ (Lithium). 3Li Литий – самый лёгкий серебристо – белый металл. Открыт в 1817 году шведским химиком А.Арфведсоном при анализе минералапеталита LiAl[Si4O10]](https://prezentacii.org/upload/cloud/15/10/43758/images/thumbs/screen10.jpg)
![Вскоре Арфведсон обнаружил литий в сподумене LiAl[Si2O6], позже ставшем важнейшим минералом элемента № 3. В 1818 году металлический литий впервые получил английский учёный Гемфри Дэви. В 1855 году немецкому химику Бунзену и независимо от него английскому физику Матиссену удалось получить чистый лити Вскоре Арфведсон обнаружил литий в сподумене LiAl[Si2O6], позже ставшем важнейшим минералом элемента № 3. В 1818 году металлический литий впервые получил английский учёный Гемфри Дэви. В 1855 году немецкому химику Бунзену и независимо от него английскому физику Матиссену удалось получить чистый лити](https://prezentacii.org/upload/cloud/15/10/43758/images/thumbs/screen11.jpg)