Слайд 1Презентация выполнена Ученицами 8 класса “А” Средней школы №3 Посёлка Нахабино Киструль Дарьей Янушкевич Валерией
Инертные газы 900igr.net
Слайд 2Инертные газы – химические элементы восьмой группы периодической системы: гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe, радон Rn.
Слайд 3История названия
Долгое время считалось, что благородные газы не образуют химических соединений. Тогда они были названы инертными, от слова инертность, что означает «бездеятельность, отсутствие активности». Позже учёными было доказано обратное, но название осталось прежним.
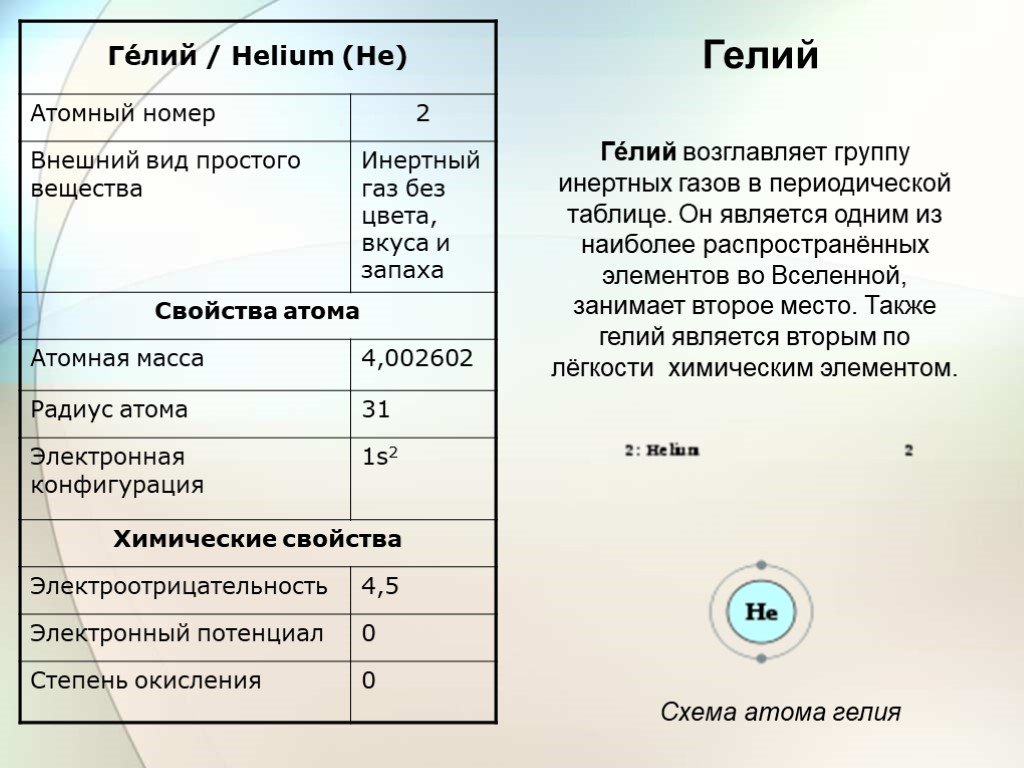
Слайд 4Гелий
Ге́лий возглавляет группу инертных газов в периодической таблице. Он является одним из наиболее распространённых элементов во Вселенной, занимает второе место. Также гелий является вторым по лёгкости химическим элементом.
Схема атома гелия
Слайд 5Символ элемента, выполненный из газоразрядных трубок, наполненных гелием. При пропускании тока через заполненную гелием трубку наблюдаются разряды различных цветов, зависящих главным образом от давления газа в трубке. Обычно видимый свет спектра гелия имеет жёлтую окраску. По мере уменьшения давления происходит смена цветов — розового, оранжевого, жёлтого, ярко-жёлтого, жёлто-зелёного и зелёного.
Спектральные линии гелия

Слайд 6Гелий впервые был идентифицирован как химический элемент в 1868 П.Жансеном при изучении солнечного затмения в Индии. Новый элемент назвали гелием от греч. «гелиос», что означает солнце. В то время не знали, что гелий – инертный газ, и предполагали, что это металл.
Гелий добывается из природного газа процессом низкотемпературного разделения — так называемой фракционной перегонкой
Поскольку гелий обладает низкой плотностью и негорюч, им заполняют метеорологические шары-зонды, аэростаты, дирижабли. Жидкий гелий используется для создания низких температур, близких к абсолютному нулю.
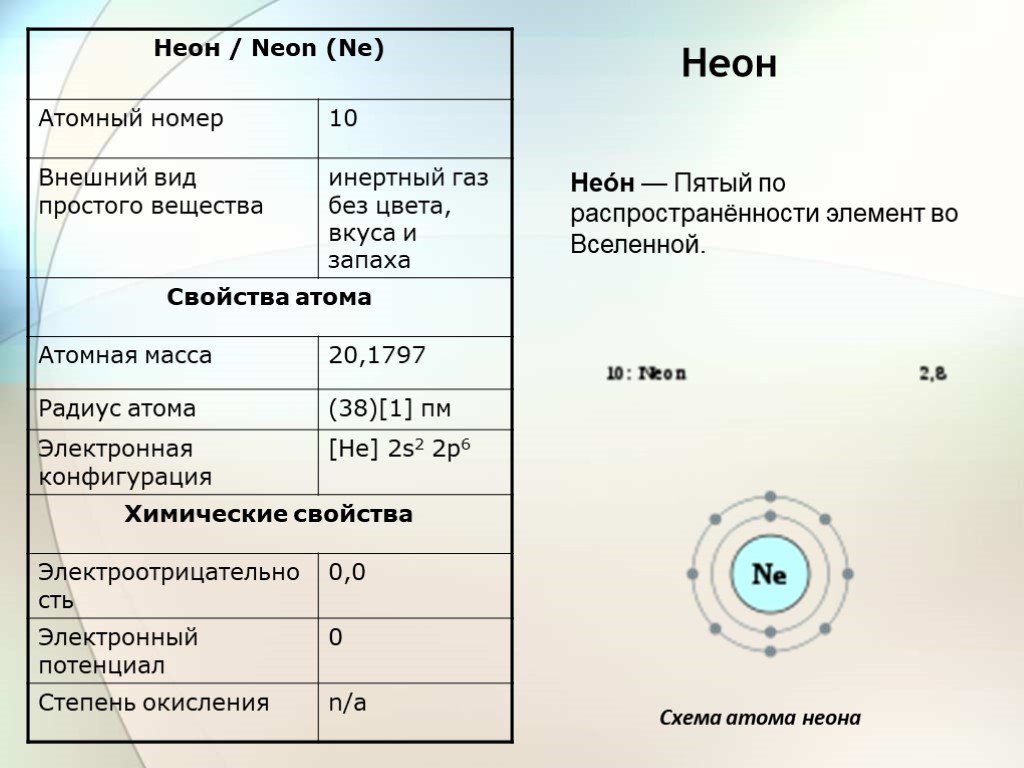
Слайд 7Неон
Нео́н — Пятый по распространённости элемент во Вселенной.
Схема атома неона
Слайд 8Эмиссионный спектр неона (слева направо: от ультрафиолетовых до инфракрасных линий, показанных белым цветом)
Трубки, заполненные смесью неона и азота, при пропускании через них электрического разряда дают красно-оранжевое свечение, в связи с чем они широко используются в рекламе.
Газоразрядные лампы, заполняемые неоном, раньше применялись в рекламе, но в последнее время на смену им пришли люминесцентные лампы.

Слайд 9Неон получают совместно с гелием в качестве побочного продукта в процессе сжижения и разделения воздуха.
Жидкий неон используют в качестве охладителя в криогенных установках. Газоразрядные лампы, заполняемые неоном, раньше применялись в рекламе, но в последнее время на смену им пришли люминесцентные лампы.
Во время исследования в спектре обнаружились новые линии. В момент, когда Рамзай наблюдал спектр только что полученного газа, в лабораторию вошел его двенадцатилетний сын, успевший стать «болельщиком» отцовых работ. Увидев необычное свечение, он воскликнул: «new one!» Так возникло название газа «неон», по-древнегречески значит «новый».
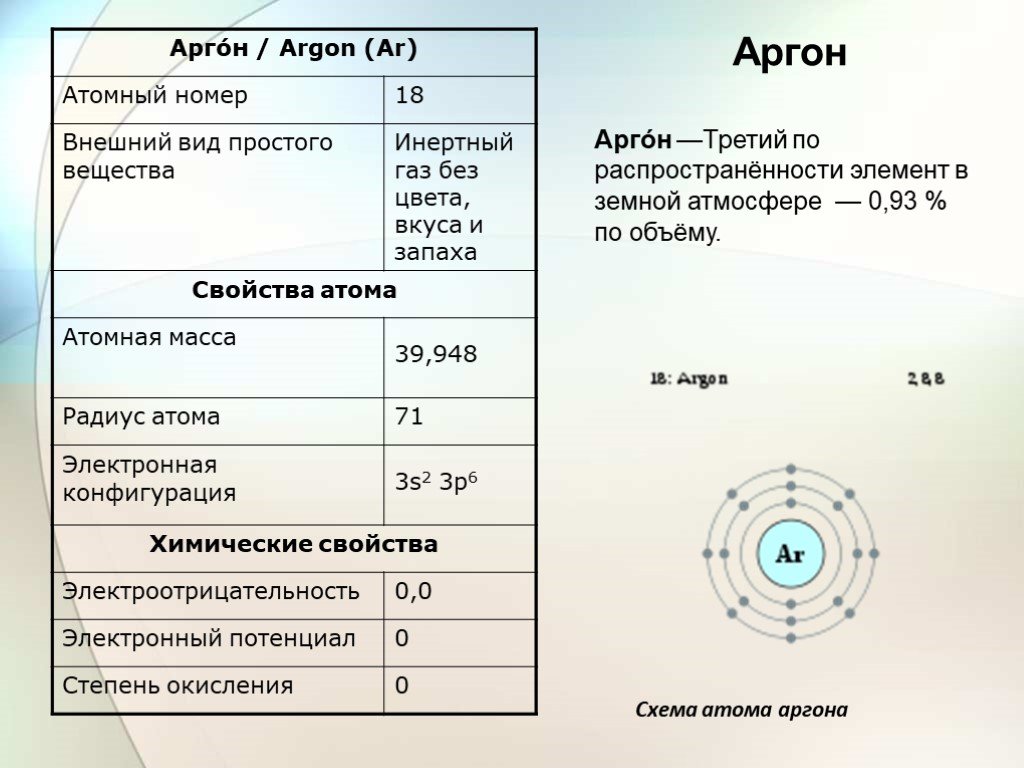
Слайд 10Арго́н —Третий по распространённости элемент в земной атмосфере — 0,93 % по объёму.
Аргон
Схема атома аргона
Слайд 11Аргон служит для создания инертной атмосферы в металлургических процессах, в химическом производстве, при электросварке.
В промышленности аргон получают как побочный продукт при крупномасштабном разделении воздуха на кислород и азот. При температуре −185,9°C аргон конденсируется, при −189,4°С — кристаллизуется
По предложению доктора Медана (председателя заседания, на котором был сделан доклад об открытии) Рэлей и Рамзай дали новому газу имя «аргон» (от греч. αργός — ленивый, медленный, неактивный). Это название подчеркивало важнейшее свойство элемента — его химическую неактивность.
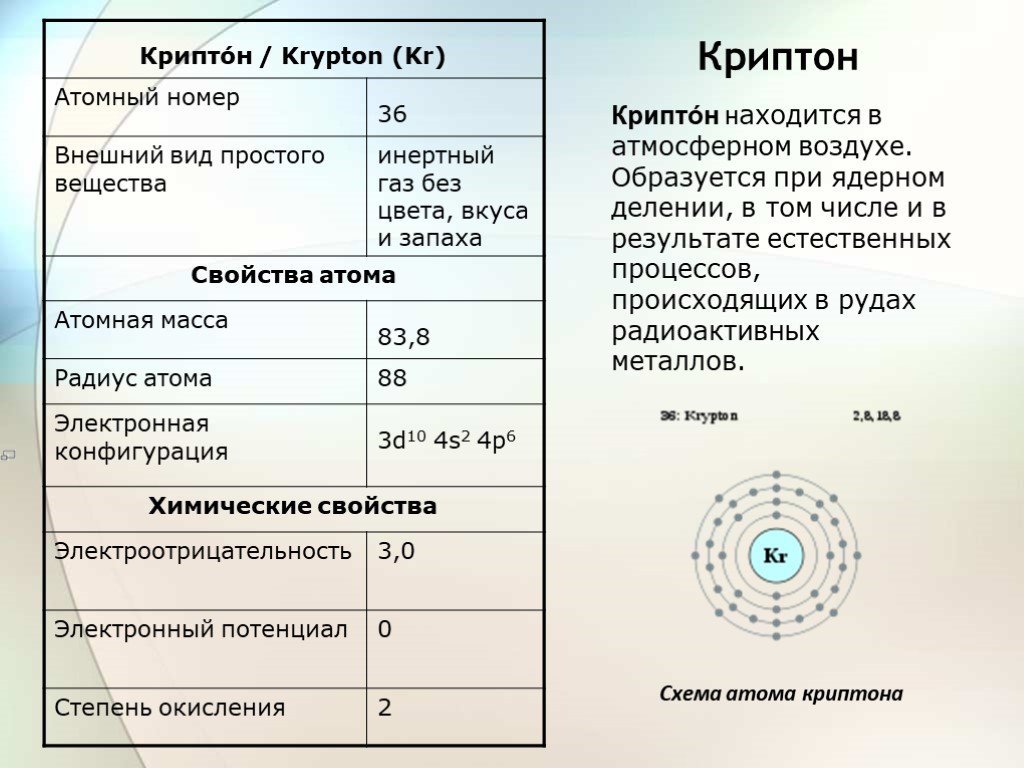
Слайд 12Криптон
Крипто́н находится в атмосферном воздухе. Образуется при ядерном делении, в том числе и в результате естественных процессов, происходящих в рудах радиоактивных металлов.
Схема атома криптона
Слайд 13Фториды криптона предложены в качестве окислителей ракетного топлива и в качестве компоненты для накачки боевых лазеров. Используется в качестве заполнения пространства между стеклами в стеклопакете для придания стеклопакету повышенных теплофизических и звукоизоляционных свойств.
Выделяют ректификацией из жидкого воздуха.
В 1898 году английский учёный Рамзай выделил из жидкого воздуха (предварительно удалив кислород, азот и аргон) смесь, в которой спектральным методом был открыт криптон (От греч. κρυπτός — скрытый, секретный).
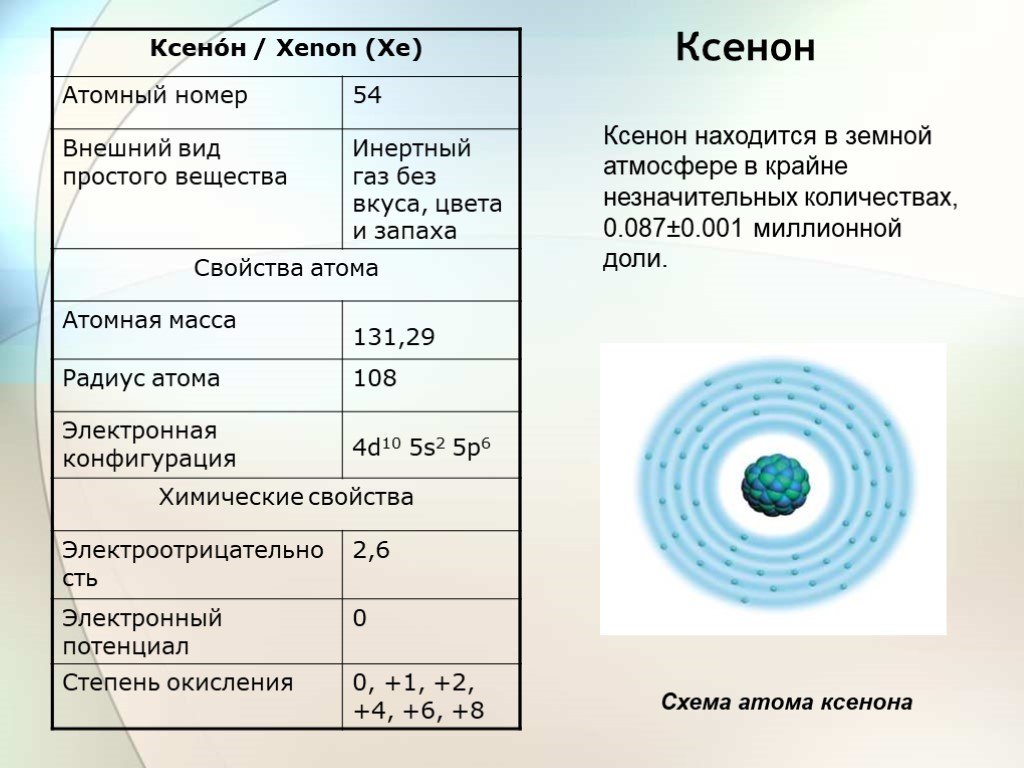
Слайд 14Ксенон
Ксенон находится в земной атмосфере в крайне незначительных количествах, 0.087±0.001 миллионной доли.
Схема атома ксенона
Слайд 15Ксеноновая лампа-вспышка
Ксеноновая лампа
Прототип ионного двигателя на ксеноне.
Физиологическое действие
Газ ксенон безвреден, но способен вызвать наркоз (по физическому механизму), а в больших концентрациях (более 80 %) вызывает асфиксию. Фториды ксенона ядовиты, ПДК в воздухе 0,05 мг/м³.
Слайд 16Ксенон используются для заполнения ламп накаливания и в производстве источников света высокой мощности. Ксенон является высокоэффективным рабочим телом для электрореактивных двигателей космических аппаратов. С конца XX века ксенон стал применяться как средство для общего наркоза
Ксенон получают как побочный продукт производства жидкого кислорода на металлургических предприятиях.
В 1898 году учёные У. Рамзай и У. Рэлей открыли новый газ (тем же способом, которым был обнаружен криптон) и назвали его ксенон, что в переводе с греческого значит «чужой»: в спектре он очень отличался по цвету от ксеноновой фракции воздуха.
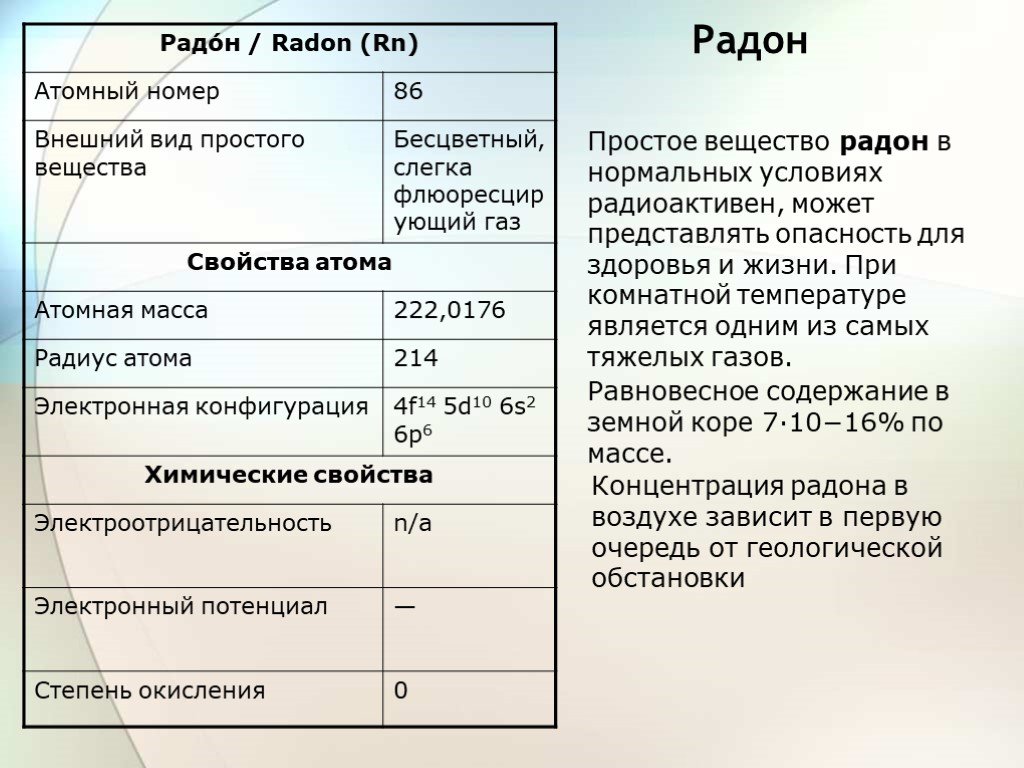
Слайд 17Радон
Простое вещество радон в нормальных условиях радиоактивен, может представлять опасность для здоровья и жизни. При комнатной температуре является одним из самых тяжелых газов.
Равновесное содержание в земной коре 7·10−16% по массе.
Концентрация радона в воздухе зависит в первую очередь от геологической обстановки

Слайд 18Радон используют в медицине для приготовления радоновых ванн, в сельском хозяйстве для активации кормов домашних животных, также он используется в геологии, гидрологии и т.д.
Радон получают способом продувки воздуха через раствор любой соли радия, а затем из этого воздуха удаляют химически активные вещества. Остаток конденсируют жидким азотом, а из него уже выделяют радон.
Э. Резерфорд в 1899 году отметил, что препараты тория испускают некое неизвестное ранее вещество. Это вещество он предложил назвать эмана́цией (от латинского emanatio — истечение) тория и дать ему символ Em. Первоначально эманацию тория называли торо́ном, а эманацию радия — радо́ном. Впервые её выделили в чистом виде Рамзай и Грей в 1908 году. В 1923 году газ получил окончательное название радон и символ Em был сменен на Rn.

Слайд 19Список использованной литературы
Петров М.М., Михилев Л.А., Кукушкин Ю.Н. “Неорганическая химия” Гузей Л.С. Лекции по общей химии” Ахметов Н.С. “Общая и неорганическая химия” Некрасов Б.В. “Учебник общей химии” Глинка Н.Л. “Общая химия Ходаков Ю.В. “Общая и неорганическая химия”