Презентация "Химия - решение задач" (8 класс) – проект, доклад
Презентацию на тему "Химия - решение задач" (8 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 9 слайд(ов).
Слайды презентации
Список похожих презентаций
Решение задач «Биохимия клетки»
Необходимые пояснения. Один шаг это полный виток спирали ДНК–поворот на 360o Один шаг составляют 10 пар нуклеотидов Длина одного шага – 3,4 нм Расстояние ...Решение расчетных задач на сплавы, смеси и растворы различными методами.
Актуальность темы:. В курсе химии в результате сокращения часов, на решение задач отводится недостаточное количество времени, происходит неполноценное ...Углеводы. Решение задач
1 Задача. Какой объём водорода необходимо использовать для гидрирования 18 г глюкозы? Какова масса полученного сорбита. 2 Задача. Определите массу ...Решение задач с использованием массовой доли выхода продукта
В реальных химических реакциях масса продукта всегда оказывается меньше расчетной. ПОЧЕМУ? Многие химические реакции обратимы и не доходят до конца. ...Решение задач с использованием понятия «Молярный объем»
? Дано: N(N2) =6*1027 Найти: n - ? m - ? V - ? Решение: M (N2)= 28кг/кмоль m (N2)=10 кмоль*28кг/кмоль = 280 кг V(N2) = 10кмоль* 22.4м3/кмоль= 224м3 ...Решение задач "выход продукта от теоретически возможного"
Массовая доля выхода продукта реакции (ω - «омега»). - это отношение массы полученного вещества к массе, которая должна была бы получиться в соответствии ...Решение задач
1. В результате реакции 4 г. смеси кремния и углерода с фтороводородом выделилось 4,48 л водорода (н.у). Вычислите массовую долю кремния в этой смеси. ...Решение задач по уравнениям химических реакций
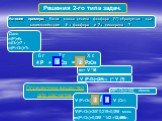
Основные физические величины. 8 класс. 1. Нахождение количества одного вещества по количеству другого вещества: ν1 → ν2. Дано: ν (O2) = 4 моль Найти: ...Решение задач по химической формуле
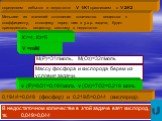
Определение. Химическая формула – это условная запись состава вещества с помощью химических знаков и математических индексов. Химическая формула отражает ...Решение задач по теме: «Электролиз»
А. В процессе электролиза расплава хлорида алюминия проводимого в течение 245 мин. при силе тока 15 А, получили алюминий. Сколько граммов железа можно ...Решение задач на смеси, сплавы, растворы
1%−это сотая часть рассматриваемой величины (52% от х кг − это 0,52х кг); Если в смеси растворов объемом V (массой m) нас интересует компонент объемом ...Решение задач на смеси, растворы и сплавы
Задача № 1. Задача № 2. Имеются сплавы золота и серебра. В одном эти металлы находятся в отношении 2: 3, а в другом в отношении 3: 7. Сколько нужно ...Решение задач на смеси
5 г хлорида магния получено при обработке 6,5 г смеси оксида и бромида магния соляной кислотой. Определить состав смеси. ДАНО: m(MgO+MgBr2)= m(MgCl2)= ...Химия и пища
План. Вступление Пищевые добавки Классификация пищевых добавок Виды пищевых добавок Ароматизаторы Консерванты Витамины Эмульгаторы Антиокислители ...Химия и наркотические вещества
Спирт как универсальный растворитель, или К чему ведет выпивка? 2. Перегонка табака, или Что мы курим? 3. Все наркотики убивают по-разному 4. Растворение ...Химия и космос
Космос в популярном сознании представляется царством холода и пустоты. Однако примерно с середины XIX века исследователи стали понимать, что пространство ...Химия и жизнь человека
Содержание. Химия и пища Химические средства гигиены и косметики Химические вещества в быту Химия и производство Химия и сельское хозяйство Химия ...Использование комбинаторных задач для подсчета вероятностей
Решить уравнение. ПРИМЕР 1. Из колоды в 36 карт случайным образом вытаскивают три карты. Какова вероятность того, что среди них: нет пиковой дамы? ...Химия вокруг нас
окружающий нас мир. тела вещества молекулы атомы И так далее…. Что мы изучаем в школе? место химии среди наук. математика химия физика биология. неживые ...Путешествие по континенту Химия, познавательная игра по химии, 8 класс
“Наши знания не могут иметь конца именно потому, что предмет познания бесконечен” (Паскаль). Государство № 1 «Врата учёности». Ответ Be N Si Al P ...Конспекты
Решение расчетных задач на вывод химической формулы органического вещества
Муниципальное бюджетное общеобразовательное учреждение. «Средняя общеобразовательная школа №55» г. Брянска. Урок по теме:. «Решение ...Решение задач по уравнениям химических реакций
Северо-Казахстанская область, Уалихановский район, Бидайыкская средняя школа. Учитель: Иманова Асель Нурмухамедовна. Предмет: химия. Класс: ...Решение задач с экологическим содержанием
УРОК. № 40. ТЕМА УРОКА:. . Решение задач с экологическим содержанием. ЦЕЛЬ УРОКА:. . . Научить учащихся решать задачи по химическим формулам ...Решение задач на растворы
Урок №38. . . Тема урока:. Решение задач на растворы. Цели и задачи урока:. Закрепить понятие доля компонента;. . Научить делать расчеты, ...Решение задач по воде
Дата:. 14.03.14 г. Класс: 8 «А». Учитель:. Рощина Н.В. Роспись зам директора по УВР. __________________. Тема занятия № 4. Решение задач ...Решение задач на определение молекулярной формулы вещества
Муниципальное бюджетное общеобразовательное учреждение. «Средняя общеобразовательная школа №17» г. Брянска. Урок на тему: «Решение задач ...Решение задач на применение закона ЭДС индукции и определение энергии магнитного поля тока
Урок №39 9 класс. Тема: Решение задач на применение закона ЭДС индукции и определение энергии магнитного поля тока. Цель урока: проверить знания ...Решение задач на определение выхода продукта реакции
Тема урока: Решение задач на определение выхода продукта реакции. Алгоритм решения задач. Составьте краткое условие задачи. . Составьте ...Решение задач на молярный объем и относительную плотность газов
ГОСУДАРСТВЕННОЕ УЧРЕЖДЕНИЕ СРЕДНЯЯ ШКОЛА №18. План конспект. открытого урока по химии. 8 класс. Тема урока:. . Решение задач на молярный ...Решение задач на вычисления, связанные с участием веществ, содержащих примеси
Тема: Решение задач на вычисления, связанные с участием веществ,. содержащих примеси. Цели: 1) Формировать умения решения расчетных задач на вычисления,. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:24 июня 2018
Категория:Химия
Классы:
Содержит:9 слайд(ов)
Поделись с друзьями:
Скачать презентацию