Презентация "Кислоты" (8 класс) по химии – проект, доклад
Презентацию на тему "Кислоты" (8 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 8 слайд(ов).
Слайды презентации
Список похожих презентаций
Классификация сложных неорганических веществ. Кислоты
Сложные вещества неорганические органические оксиды кислоты основания соли. дать определение кислотам, рассмотреть состав кислот, классифицировать ...Кислоты органические и неорганические
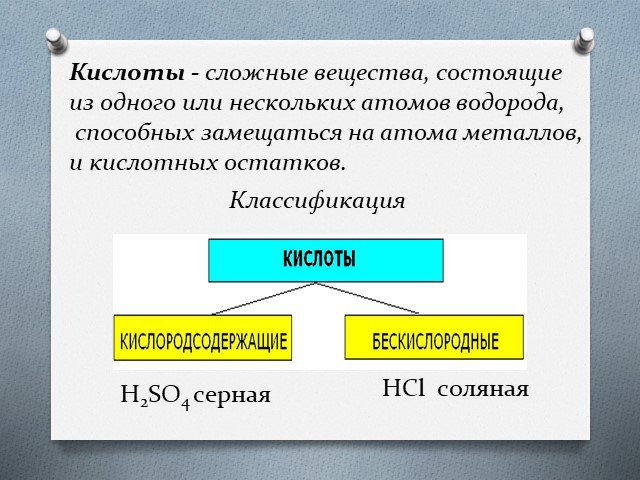
Кисло́ты — сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков. Они получили своё название ...Кислоты, их классификация и свойства
images.yandex.ru. Дайте характеристику оксидам. Металла(неметалла) Солеобразующий (несолеобразующий) Кислотный (основный). MgO CO SiO2 CO2 N2O5 Li2O. ...Кислоты и вода
Задачи урока:. Изучить состав и классификацию кислот Дать начальные сведения о кислотах. Определение. это сложные вещества, состоящие их ионов водорода ...Кислоты и соли
В средних солях все атомы водорода соответствующей кислоты замещены на металлы, в кислых солях они замещены только частично, в основных солях группы ...Кислоты
Кислоты – это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Диссоциация: HCl = H+ + Cl- НNO3 = H+ + ...Кислоты вокруг нас
кислоты. Кислоты в нашей жизни:. Лимонная кислота Яблочная кислота. Щавелевая кислота. Муравьиная кислота. Кислоты в природе:. Винная кислота. Уксусная ...Кислоты 3
1вопрос. Какие кислоты вы знаете? (уксусная, лимонная, муравьиная, щавелевая, аскорбиновая и ацетилсалициловая кислота). 2вопрос. Что объединяет все ...Кислоты 9-10 класс
Кислоты – вещества, диссоциирующие в воде на катионы водорода и анионы кислотного остатка. Основность кислоты определяется числом атомов водорода, ...Кислоты
Что такое кислоты? Слова "кислота" и "кислый" не зря имеют общий корень. Растворы всех кислот на вкус кислые. Это не означает, что раствор любой кислоты ...Кислоты 2
Цель урока. Дать сравнительную характеристику нуклеиновых кислот Выявить биологическую роль нуклеиновых кислот. История открытия. 1868г. - немецкий ...Кислоты
H Cl = H+ + Cl – H2 SO 4 = 2 H+ + SO42-. Кислоты – это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. ...Кислоты
Как же химики судят о том, является ли данное вещество кислотой? Растворы всех кислот на вкус кислые. Но ни один химик не будет распознавать кислоты ...Кислоты
Кислоты- электролиты, при диссоциации которых образуются катионы водорода и анионы кислотных остатков HCL H++CL- H2SO4 3H++PO43-. Классификация кислот. ...Оксиды. Основания. Кислоты
Тема урока: «Оксиды. Основания. Кислоты.». План урока: Повторение опорных знаний о классификации оксидов, оснований, кислот. Закрепление материала. ...Кислоты взаимодействие
Сложные вещества, состоящие из атомов водорода, соединенных с кислотным остатком Электролиты, диссоциирующие с образованием катионов водорода и анионов ...Химия Кислоты
Кислоты. Сложные вещества, молекулы которых состоят из атомов водорода Н и кислотных остатков. Классификация кислот по содержанию кислорода. Классификация ..."Кислоты
Что общего изображено ? Кислоты в природе Яблочная кислота. Щавелевая кислота. Муравьиная кислота. Аскорбиновая кислота. Лимонная кислота. Немного ...Конспекты
Кислоты и их свойства
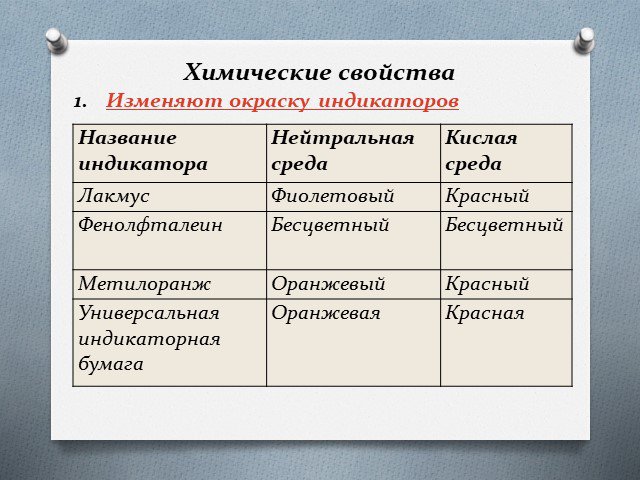
Тема урока:. Кислоты и их свойства. Цель урока:. Знание состава, формул, определение кислот, индикаторов, физические и химические свойства кислот, ...Кислоты и основания в повседневной жизни
Предмет:. . химия. Учитель:. . Копрова Ольга Сергеевна. Тема:. «Кислоты и основания в повседневной жизни». Тип урока:. . . обобщения и ...Основные классы неорганических веществ. Кислоты
План – конспект. урока химии в 8 классе. Основные классы неорганических веществ. Кислоты. Самигуллина Татьяна Леонидовна. МБОУ « Средняя ...Кислоты
Развёрнутый план-конспект урока по теме: «Кислоты». 8 класс. Тип урока:. комбинированный, с использованием презентации «Кислоты». Образовательные ...Кислоты, их состав и названия
Тема урока. :. Кислоты, их состав и названия. . . Учитель:. Жалнова Валентина Николаевна. Цели урока:. познакомить учащихся с составом, названиями, ...Кислоты, их состав, классификация, общие свойства
Информационный план-проспект урока. №. . Описание. . . . Тип урока. . Урок изучения нового материала с использованием химического ...Кислоты
Урок химии по теме "Кислоты". Тема: . Кислоты. Цель: . познакомить учащихся с составом, классификацией кислот и названиями основных представителей ...Кислоты, их классификация и свойства
Муниципальное образование Новокубанский район. . муниципальное общеобразовательное бюджетное учреждение основная общеобразовательная школа № 21 х. ...Кислоты
Конспект урока химии в 8 классе по теме: «Кислоты». Тема урока:. «Кислоты». Цели и задачи:. Обучающие:. сформировать представления учащихся ...Кислоты
Тема: Кислоты. . . Образовательные задачи:. Главная:. Познакомить учащихся с новым классом неорганических веществ – кислотами. . . Сопутствующие:. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:17 мая 2016
Категория:Химия
Классы:
Содержит:8 слайд(ов)
Поделись с друзьями:
Скачать презентацию