Презентация "Кислоты" по химии – проект, доклад
Презентацию на тему "Кислоты" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 16 слайд(ов).
Слайды презентации
Список похожих презентаций
Классификация сложных неорганических веществ. Кислоты
Сложные вещества неорганические органические оксиды кислоты основания соли. дать определение кислотам, рассмотреть состав кислот, классифицировать ...Кислоты органические и неорганические
Кисло́ты — сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков. Они получили своё название ...Кислоты, их классификация и свойства
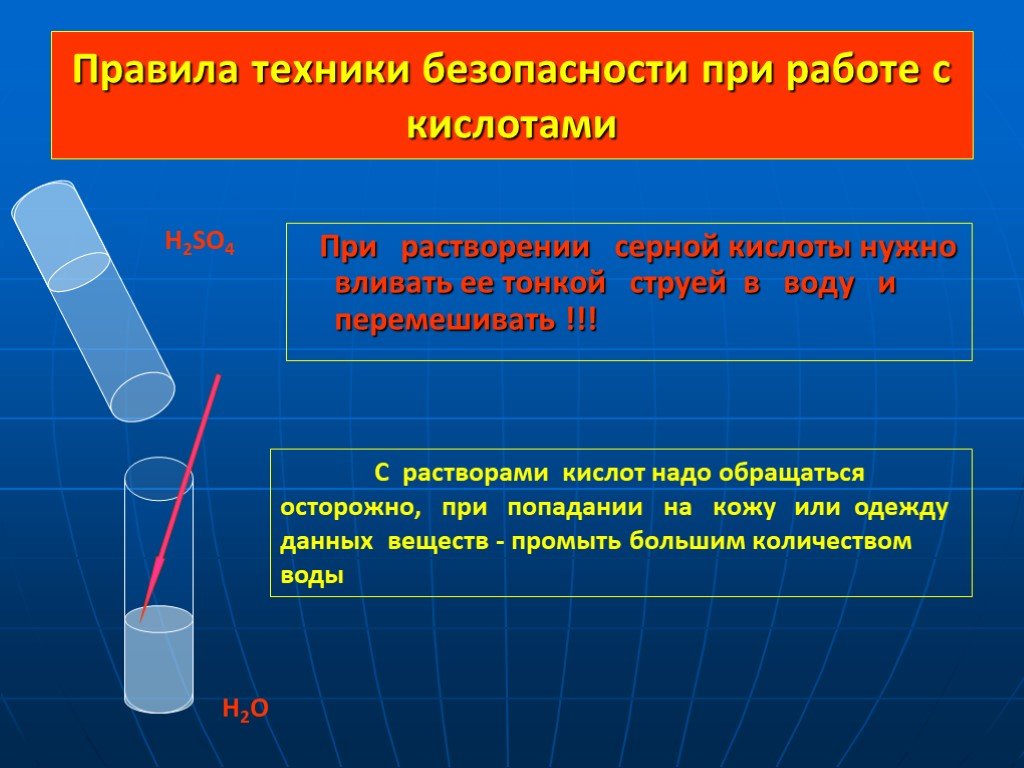
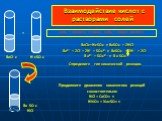
images.yandex.ru. Дайте характеристику оксидам. Металла(неметалла) Солеобразующий (несолеобразующий) Кислотный (основный). MgO CO SiO2 CO2 N2O5 Li2O. ...Кислоты и вода
Задачи урока:. Изучить состав и классификацию кислот Дать начальные сведения о кислотах. Определение. это сложные вещества, состоящие их ионов водорода ...Кислоты и соли
В средних солях все атомы водорода соответствующей кислоты замещены на металлы, в кислых солях они замещены только частично, в основных солях группы ...Кислоты
Кислоты - сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков. Классификация ...Кислоты вокруг нас
кислоты. Кислоты в нашей жизни:. Лимонная кислота Яблочная кислота. Щавелевая кислота. Муравьиная кислота. Кислоты в природе:. Винная кислота. Уксусная ...Кислоты 3
1вопрос. Какие кислоты вы знаете? (уксусная, лимонная, муравьиная, щавелевая, аскорбиновая и ацетилсалициловая кислота). 2вопрос. Что объединяет все ...Кислоты 9-10 класс
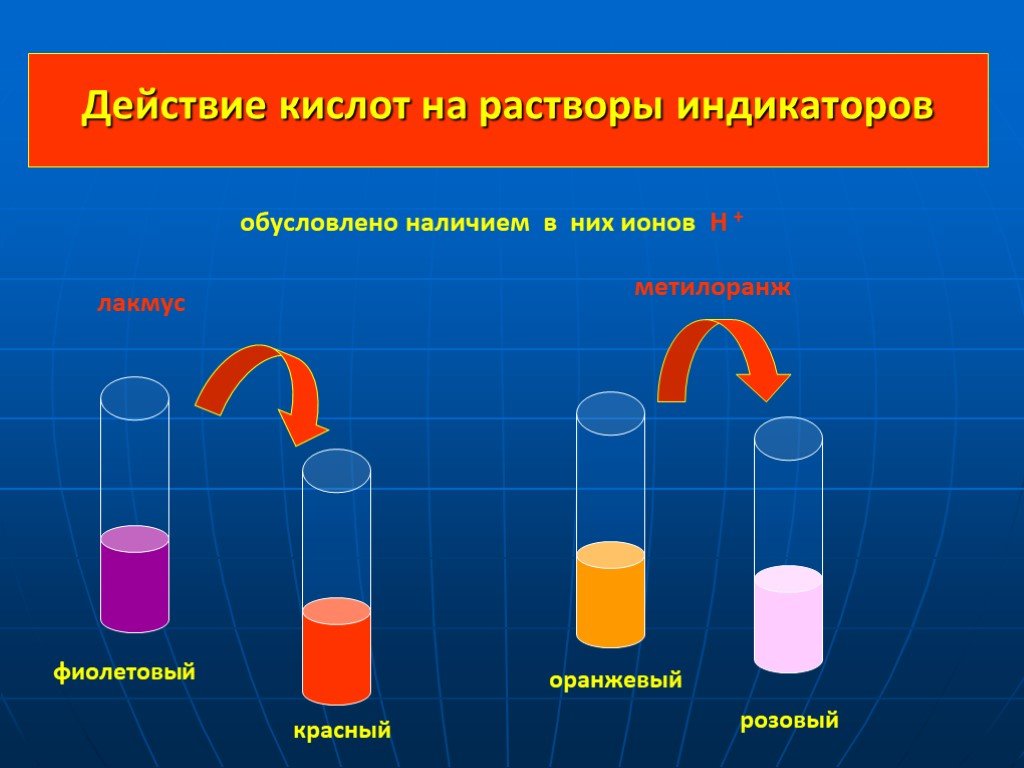
Кислоты – вещества, диссоциирующие в воде на катионы водорода и анионы кислотного остатка. Основность кислоты определяется числом атомов водорода, ...Кислоты
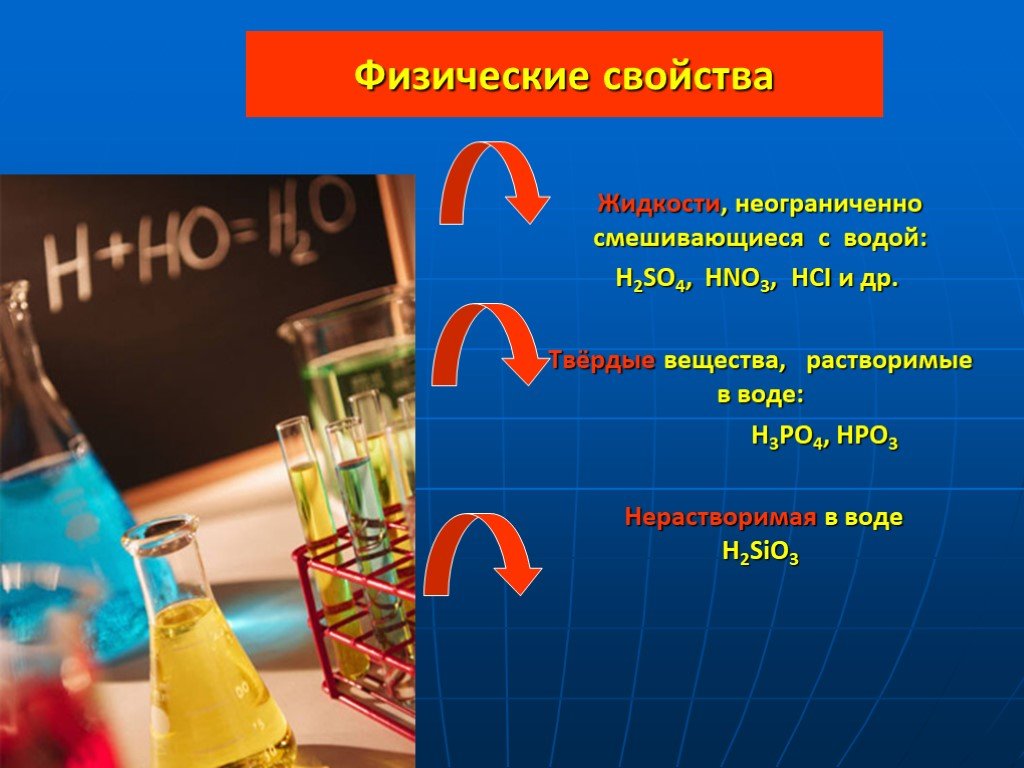
Что такое кислоты? Слова "кислота" и "кислый" не зря имеют общий корень. Растворы всех кислот на вкус кислые. Это не означает, что раствор любой кислоты ...Кислоты 2
Цель урока. Дать сравнительную характеристику нуклеиновых кислот Выявить биологическую роль нуклеиновых кислот. История открытия. 1868г. - немецкий ...Кислоты
Как же химики судят о том, является ли данное вещество кислотой? Растворы всех кислот на вкус кислые. Но ни один химик не будет распознавать кислоты ...Кислоты
Кислоты- электролиты, при диссоциации которых образуются катионы водорода и анионы кислотных остатков HCL H++CL- H2SO4 3H++PO43-. Классификация кислот. ...Кислоты
Кислоты – это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Диссоциация: HCl = H+ + Cl- НNO3 = H+ + ...Оксиды. Основания. Кислоты
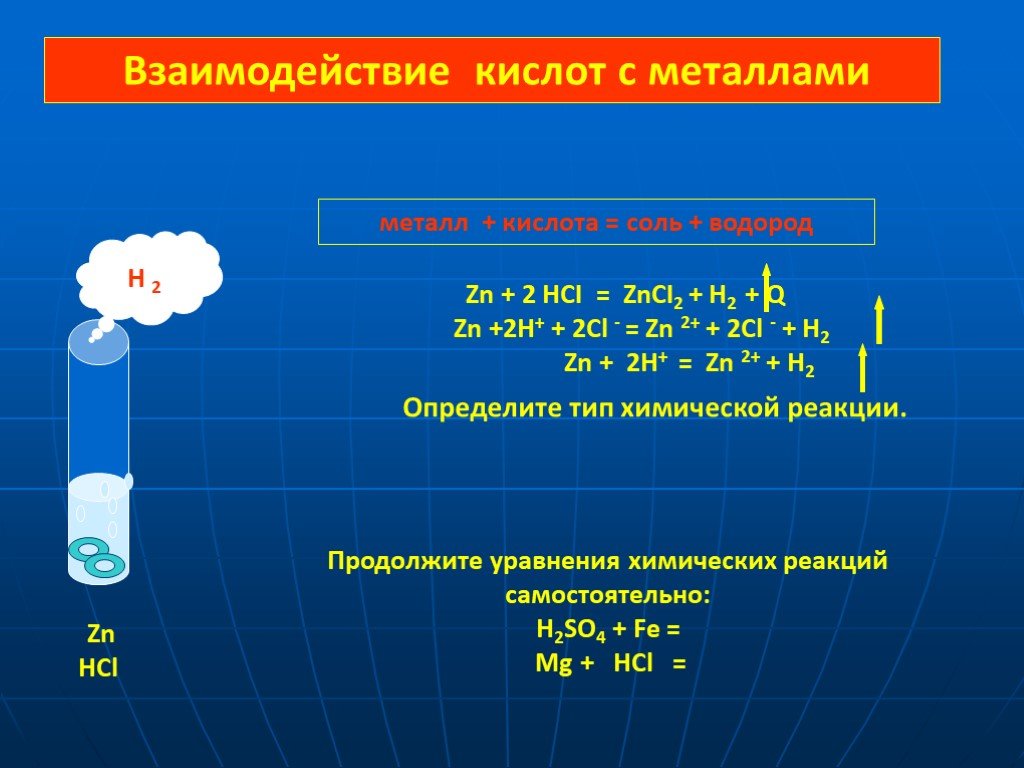
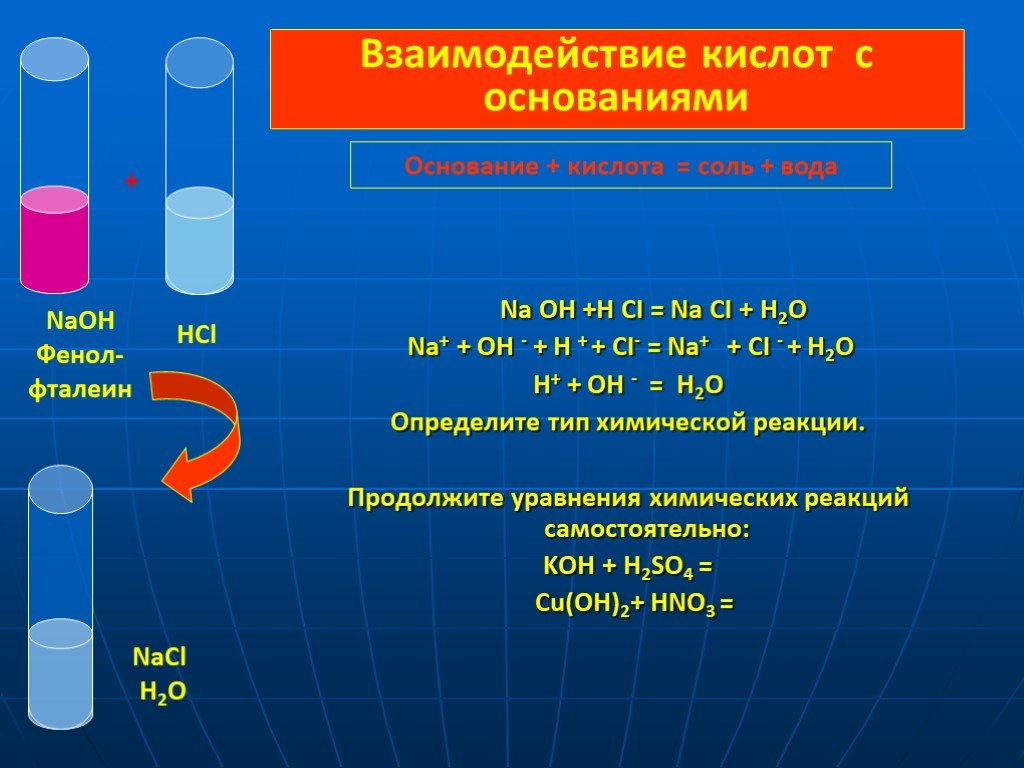
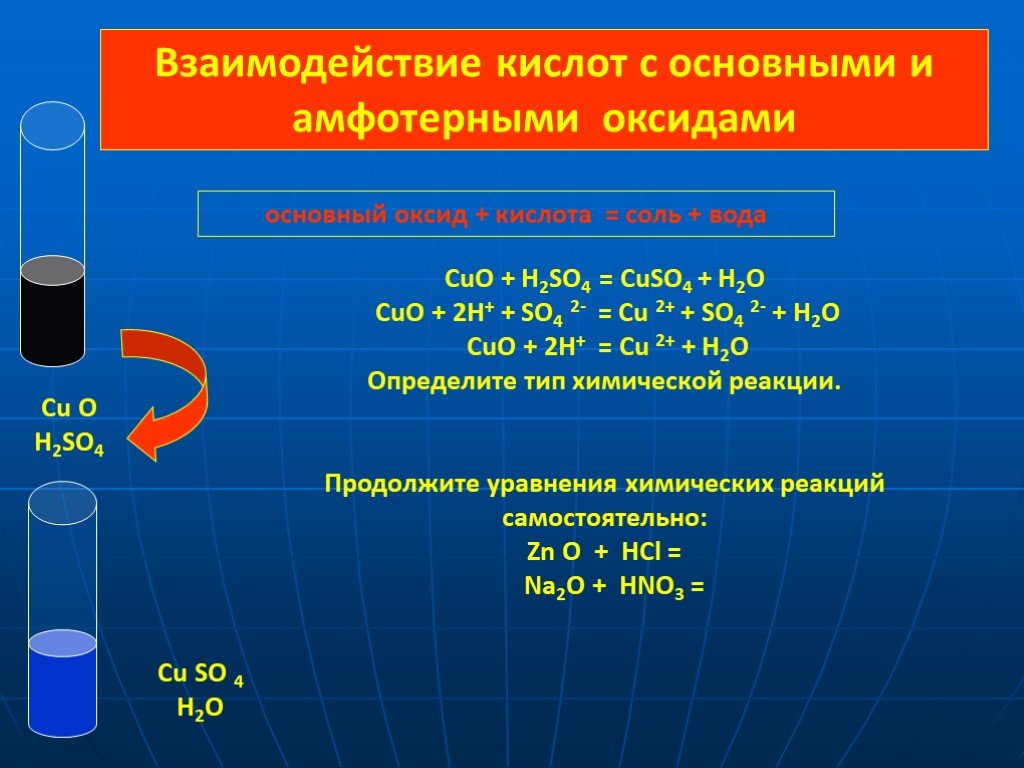
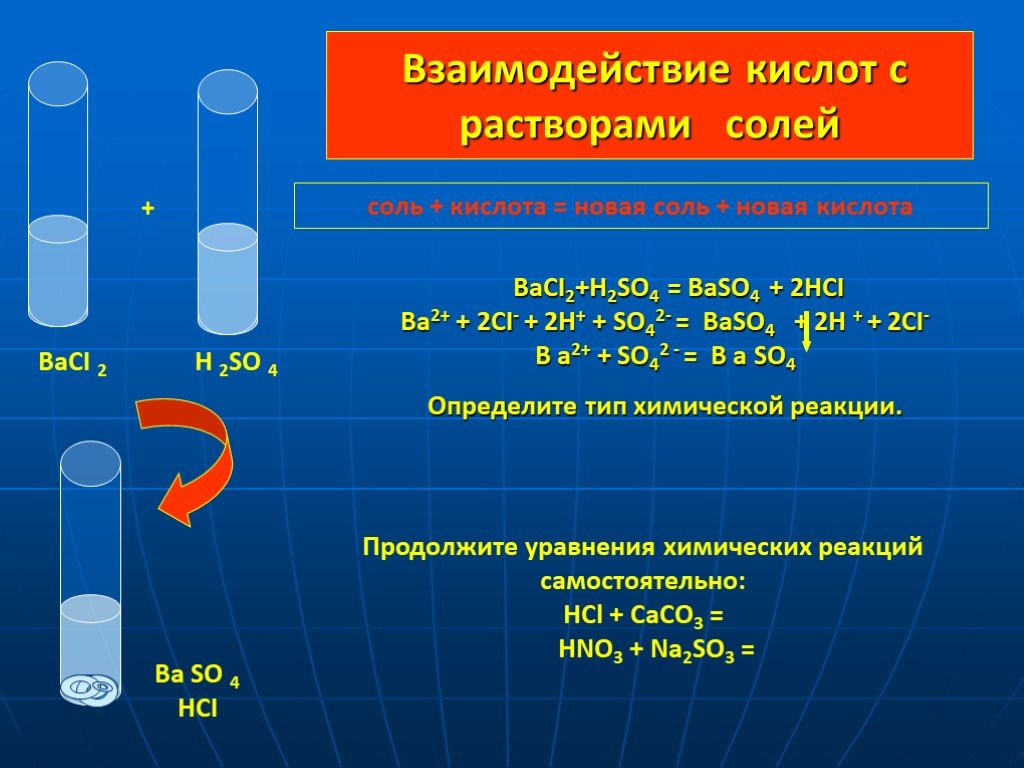
Тема урока: «Оксиды. Основания. Кислоты.». План урока: Повторение опорных знаний о классификации оксидов, оснований, кислот. Закрепление материала. ...Кислоты взаимодействие
Сложные вещества, состоящие из атомов водорода, соединенных с кислотным остатком Электролиты, диссоциирующие с образованием катионов водорода и анионов ...Химия Кислоты
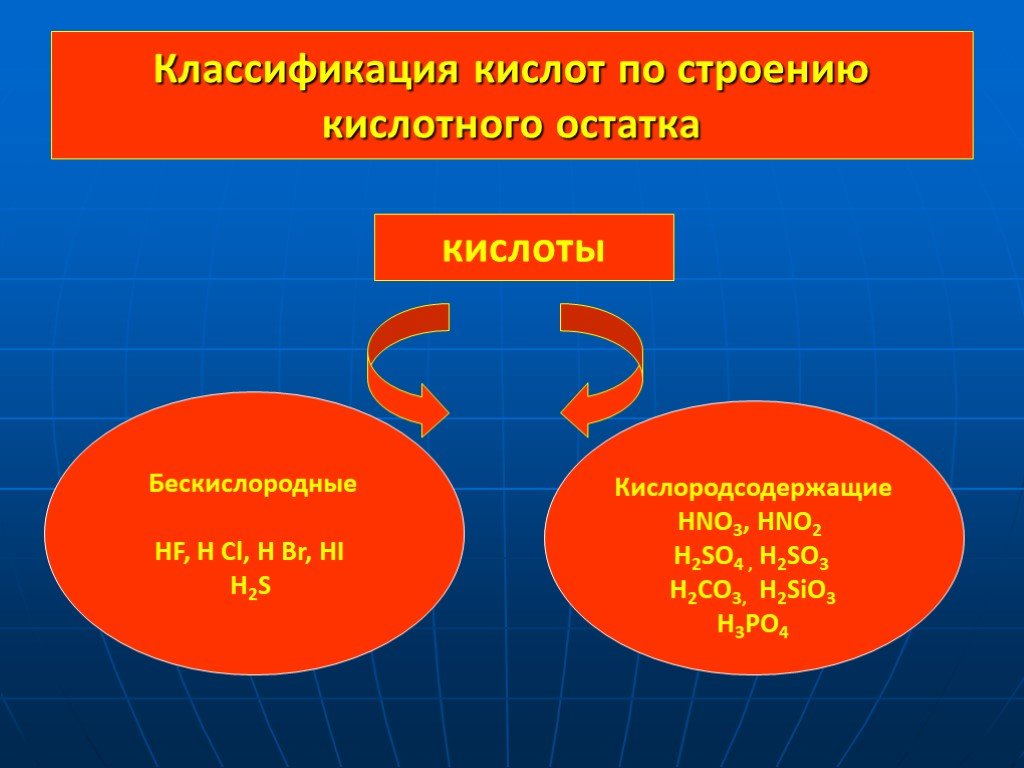
Кислоты. Сложные вещества, молекулы которых состоят из атомов водорода Н и кислотных остатков. Классификация кислот по содержанию кислорода. Классификация ..."Кислоты
Что общего изображено ? Кислоты в природе Яблочная кислота. Щавелевая кислота. Муравьиная кислота. Аскорбиновая кислота. Лимонная кислота. Немного ...«Нуклеиновые кислоты» химия
Цель урока: сформировать у студентов понимание взаимосвязанности и взаимозависимости веществ в клетке. Задачи урока: повторить строение и основные ...«Жиры» химия
жиры. Оглавление. Определение и общая формула Физические свойства Химические свойства Классификация жиров Животные жиры Растительные жиры Роль жиров ...Конспекты
Кислоты и их свойства
Тема урока:. Кислоты и их свойства. Цель урока:. Знание состава, формул, определение кислот, индикаторов, физические и химические свойства кислот, ...Кислоты и основания в повседневной жизни
Предмет:. . химия. Учитель:. . Копрова Ольга Сергеевна. Тема:. «Кислоты и основания в повседневной жизни». Тип урока:. . . обобщения и ...Основные классы неорганических веществ. Кислоты
План – конспект. урока химии в 8 классе. Основные классы неорганических веществ. Кислоты. Самигуллина Татьяна Леонидовна. МБОУ « Средняя ...Кислоты
Развёрнутый план-конспект урока по теме: «Кислоты». 8 класс. Тип урока:. комбинированный, с использованием презентации «Кислоты». Образовательные ...Кислоты, их состав и названия
Тема урока. :. Кислоты, их состав и названия. . . Учитель:. Жалнова Валентина Николаевна. Цели урока:. познакомить учащихся с составом, названиями, ...Кислоты, их состав, классификация, общие свойства
Информационный план-проспект урока. №. . Описание. . . . Тип урока. . Урок изучения нового материала с использованием химического ...Кислоты
Урок химии по теме "Кислоты". Тема: . Кислоты. Цель: . познакомить учащихся с составом, классификацией кислот и названиями основных представителей ...Кислоты, их классификация и свойства
Муниципальное образование Новокубанский район. . муниципальное общеобразовательное бюджетное учреждение основная общеобразовательная школа № 21 х. ...Кислоты
Конспект урока химии в 8 классе по теме: «Кислоты». Тема урока:. «Кислоты». Цели и задачи:. Обучающие:. сформировать представления учащихся ...Кислоты
Тема: Кислоты. . . Образовательные задачи:. Главная:. Познакомить учащихся с новым классом неорганических веществ – кислотами. . . Сопутствующие:. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:31 декабря 2018
Категория:Химия
Содержит:16 слайд(ов)
Поделись с друзьями:
Скачать презентацию