Презентация "Электролиз. удивительный мир гальваники" по химии – проект, доклад
Презентацию на тему "Электролиз. удивительный мир гальваники" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 19 слайд(ов).
Слайды презентации
Список похожих презентаций
Удивительный мир кристаллов
Моя одноклассница представила нам собственно выращенные кристаллы. Я запомнила, что это были кристаллы железного и медного купороса, cульфата кобальта, ...Этот удивительный Мир симметрии
«Симметрия является той идеей, посредством которой человек на протяжении веков пытался постичь и создать порядок, красоту и совершенство». Г. Вейль. ...Удивительный мир кристаллов
Экспериментальная часть проекта. Изучив литературу, я узнал о методике выращивания силикатных «сталактитов» и «сталагмитов». Для этого из плотного ...Электролиз расплавов и растворов
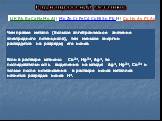
Электролиз расплавов и растворов. Электролиз-это совокупность окислительно-восстановительных процессов,протекающих при прохождении постоянного электрического ...Электролиз .
Электролиз – окислительно-восстановительный процесс, происходящий на электродах при пропускании постоянного электрического тока через раствор или ...Электролиз
Окислительно-восстановительные реакции, протекающие на электродах при пропускании постоянного электрического тока через растворы или расплавы электролитов, ...Электролиз
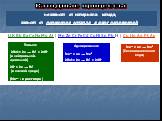
. Области применения электролиза. В основной химической промышленности – получение H2, O2, S, галогенов, щелочей и др. Электрометаллургия – получают ...Электролиз
Как наша прожила б планета? Как люди жили бы на ней Без теплоты, магнита, света И электрических лучей? Адам Мицкевич. Эпиграф урока. Проблемный вопрос. ...Электролиз
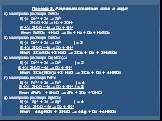
Терминология. Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, ...Электролиз
Определение:. Электро́лиз — физико-химическое явление, состоящее в выделении на электродах составных частей растворённых веществ или других веществ, ...Химия и современный мир профессий
Изучение химии, согласно школьной программе основной школы, должно сформировать представление учащихся о химии не только как одной из областей естествознания, ...Путешествие в мир химии
“Познание начинается с удивления” (Аристотель). Станция № 1 «Разминка». В конце периода стоит, В нём вода и та горит. Загадки Фтор. Давно известно ...Путешествие в мир углеводородов нефти
«МОРЕ ФАКТОВ». Нефть - это черное золото планеты, чудесный дар природы. Человек познакомился с нефтью еще за 5-6 тыс. лет до н. э. «нафата »- просачиваться. ...Анод + Катод = Электролиз
Цель работы:. Изучить сущность процесса электролиза и выяснить области его применение. Содержание: Электролиз расплава Электролиз раствора Схема электролиза ...10 лекарств, которые изменили мир
Содержание. 1.Введение 2.История фармакологии 3.Классификация лекарственных средств 4.10 лекарств, изменивших мир 4.1. Опий 4.2. Вакцина против оспы ...Конспекты
Путешествие в удивительный мир оксидов
Название работы: Урок с использованием презентации. . Автор: Обливанова Светлана Викториновна. . МОУ Сусанинская средняя общеобразовательная ...Этот удивительный углерод
Интегрированный урок по географии и химии на тему. «Этот удивительный углерод». Цели урока. : На основе интеграции географических, химических ...Химические реакции. Электролиз
ПЛАН-КОНСПЕКТ УРОКА Тема урока. : Электролиз. . ФИО. . . Хубиева Людмила Руслановна. . . . Место работы. . МБОУ СОШ ...Путешествие в мир веществ
Балыклинский филиал ГБОУ СОШ с.Камышла. Урок химии в 8 классе. «Путешествие. в мир веществ. ». . Цели:. Отработать умения, ...Путешествие в мир веществ
Разработка урока по химии. Ф.И.О. автора: Макарова Светлана Борисовна. Место работы: Казахстанская интеллектуальная школа «Байтерек». . город ...Путешествие в мир атома
Конспект урока химии в 8 классе. Учитель Сергеева Галина Борисовна. Тема урока « Путешествие в мир атома». Цель: изучение основных сведений о ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:26 мая 2020
Категория:Химия
Содержит:19 слайд(ов)
Поделись с друзьями:
Скачать презентацию