Презентация "Амины (органические производные аммиака)" по химии – проект, доклад
Презентацию на тему "Амины (органические производные аммиака)" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 83 слайд(ов).
Слайды презентации
Список похожих презентаций
Основания органические и неорганические
Тема урока «Основания органические и неорганические». Цель урока:. Обобщить и систематизировать знания об основаниях. Исследовательская работа. Определите ...Подготовка к ЕГЭ: Кислородсодержащие органические соединения. Карбоновые кислоты
Органические карбоновые кислоты характеризуются наличием карбоксильной группы –СООН. По числу групп различают: одно- СН3-СООН – уксусная или этановая ...Амины
Цели урока. Знать строение предельных алифатических аминов Уметь объяснять зависимость свойств органических соединений от их строения на примере аминов ...Органическая химия. Амины
Содержание : - Введение - Номенклатура - Химические свойства - Применение - Получение - Некоторые наиболее известные амины - Вредное воздействие. ...Соли как производные кислот и оснований
Вопросы. 4. Что такое кислоты? 1. Какие классы веществ вы знаете? 2. Что такое оксиды? 3. Что такое основания? 5. Что такое основные оксиды, (кислотные ...Удивительные органические вещества
Задача от мисс Марпл. Какое приспособление использовал злоумышленник ? И какое вещество помогло ему разрезать сталь? А.Блок. Взгляд обольстительной ...Жиры – биологически важные органические соединения
Содержание. Нахождение жиров в природе. История изучения жиров. Строение и разнообразие жиров. Физические свойства жиров. Химические свойства жиров. ...Производство аммиака
Цели работы:. Изучить процесс производства аммиака Изучить условия протекания реакции Изучить пользу и вред производства. Аммиак — NH3, нитрид водорода, ...Амины и анилин
Решите задачу. Органическое вещество содержит 38,7% углерода, 45,15% азота и 16,15% водорода. Относительная плотность его паров по водороду равна ...Амины урок
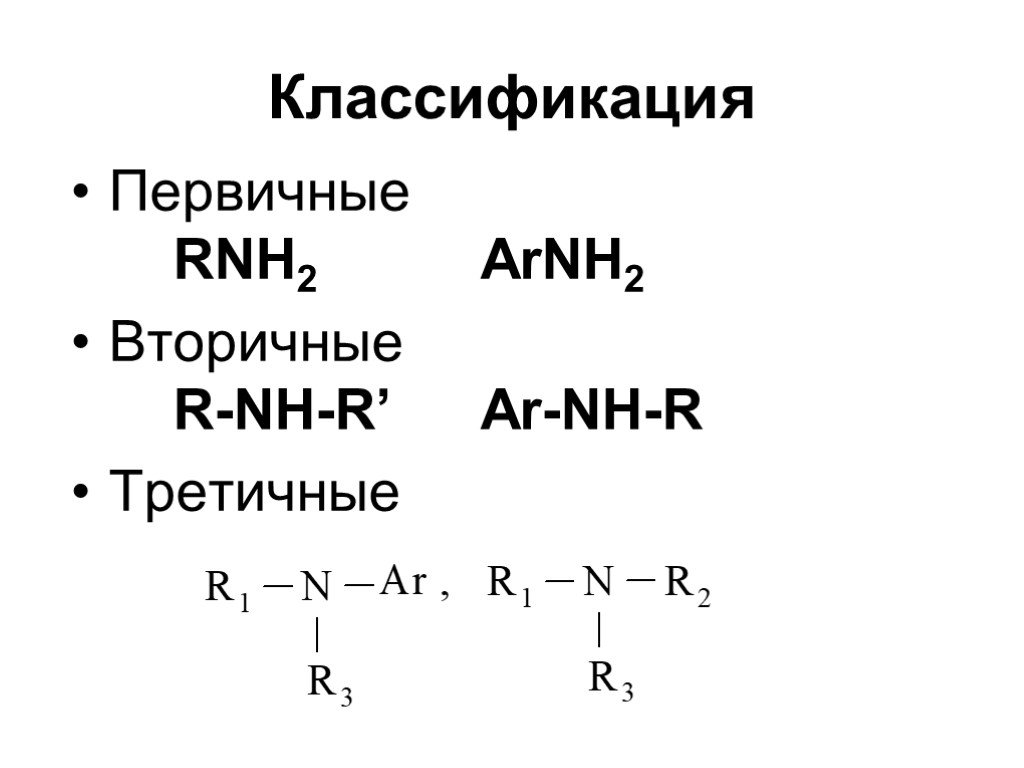
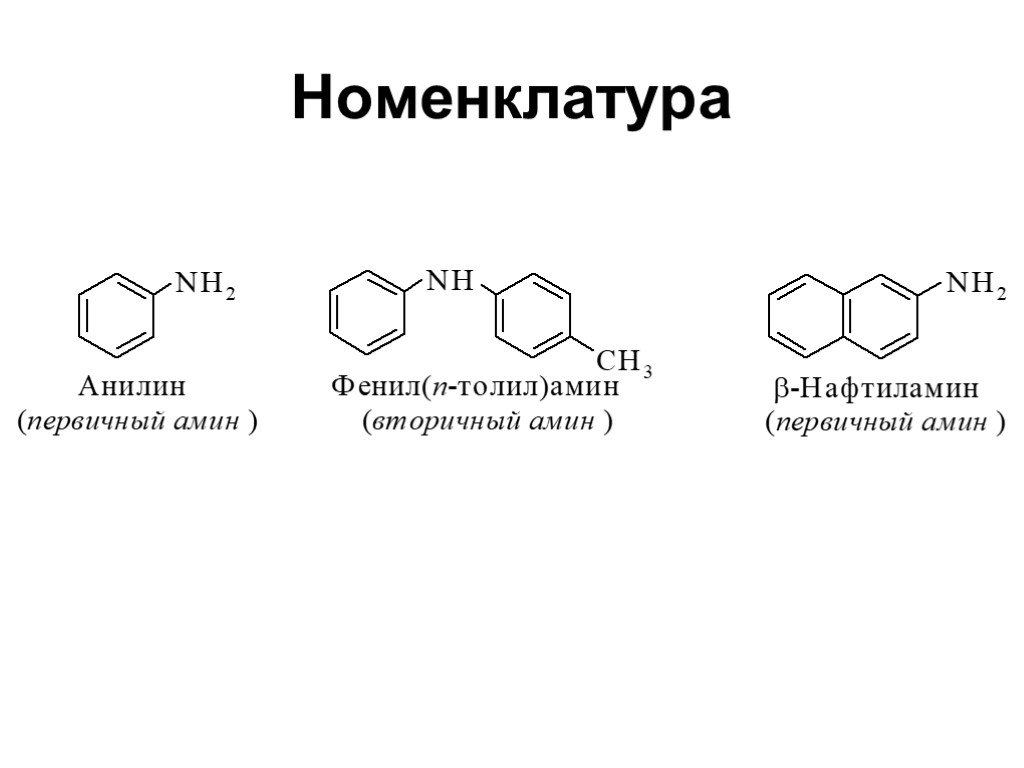
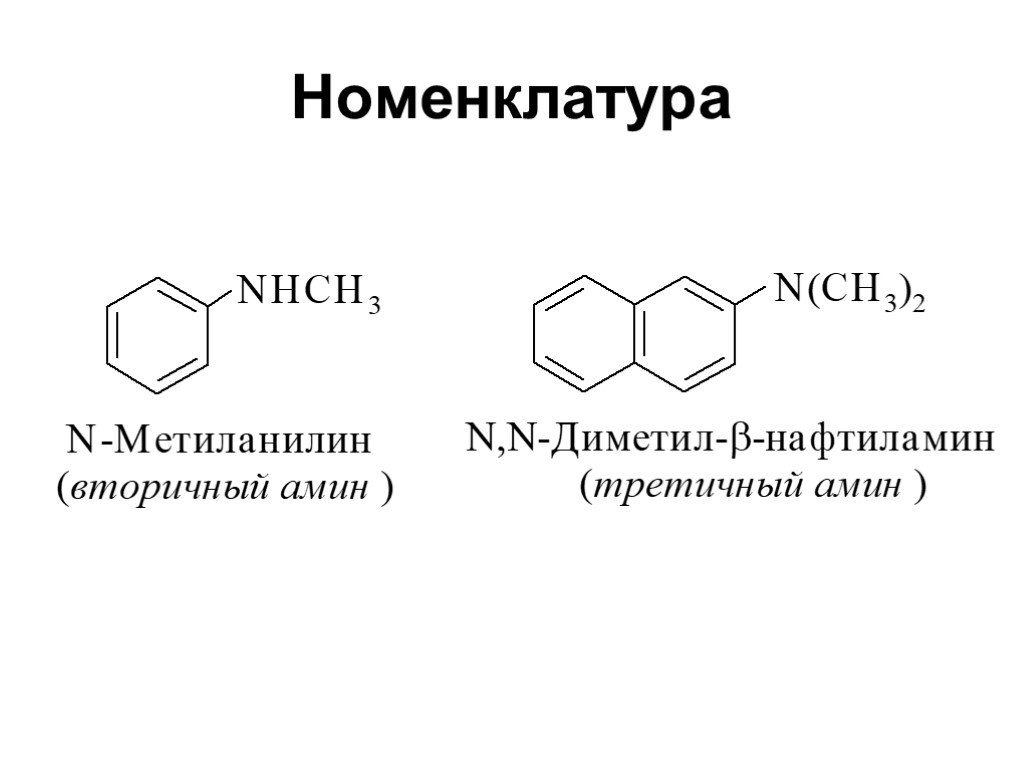
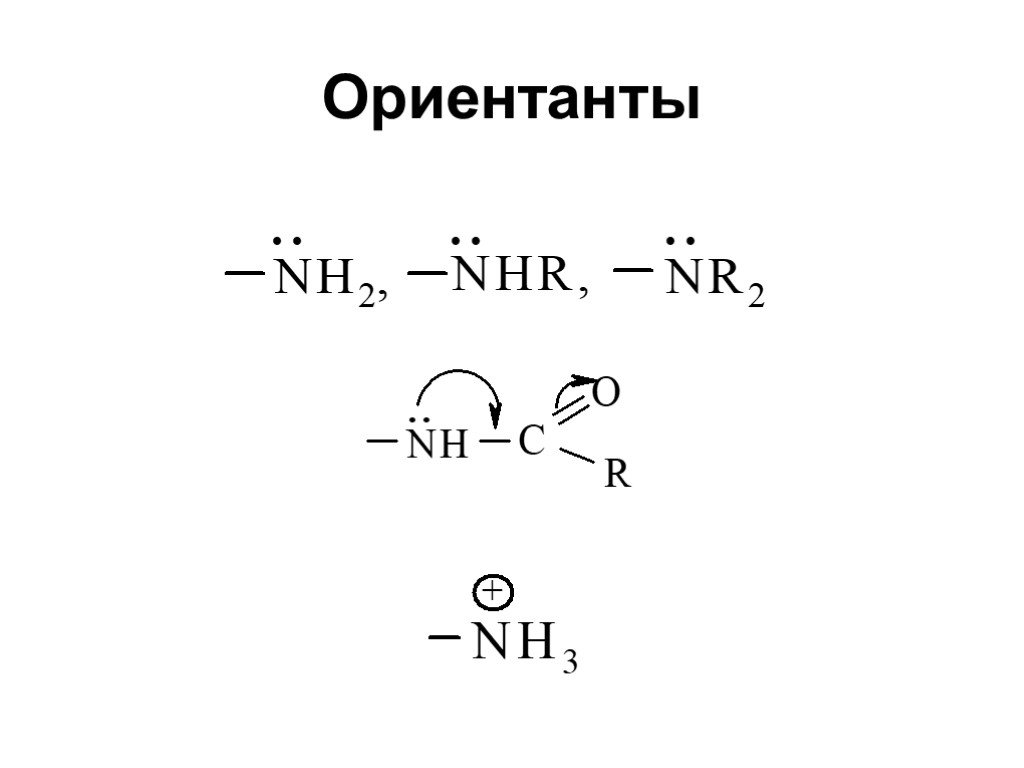
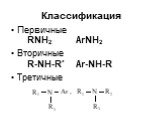
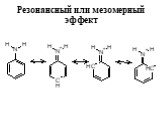
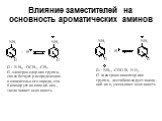
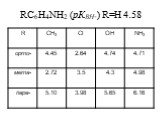
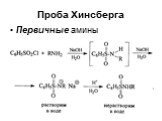
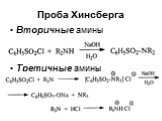
Классификация аминов. Первичные амины. -NH2 аминогруппа СН3-NH2 метиламин С6Н5-NH2 фениламин (анилин). Амины - органические основания. .. .. H : N ...Амины
Разнообразие азотсодержащих органических веществ. Азотсодержащие вещества. Амины R – NH2. Нитросоединения R – NO2. Аминокислоты NH2 - R - COOH. Белки. ...Амины
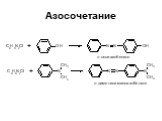
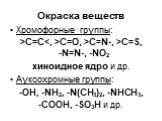
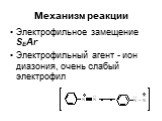
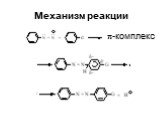
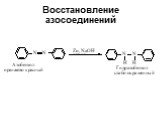
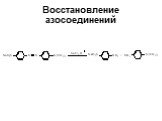
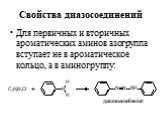
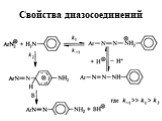
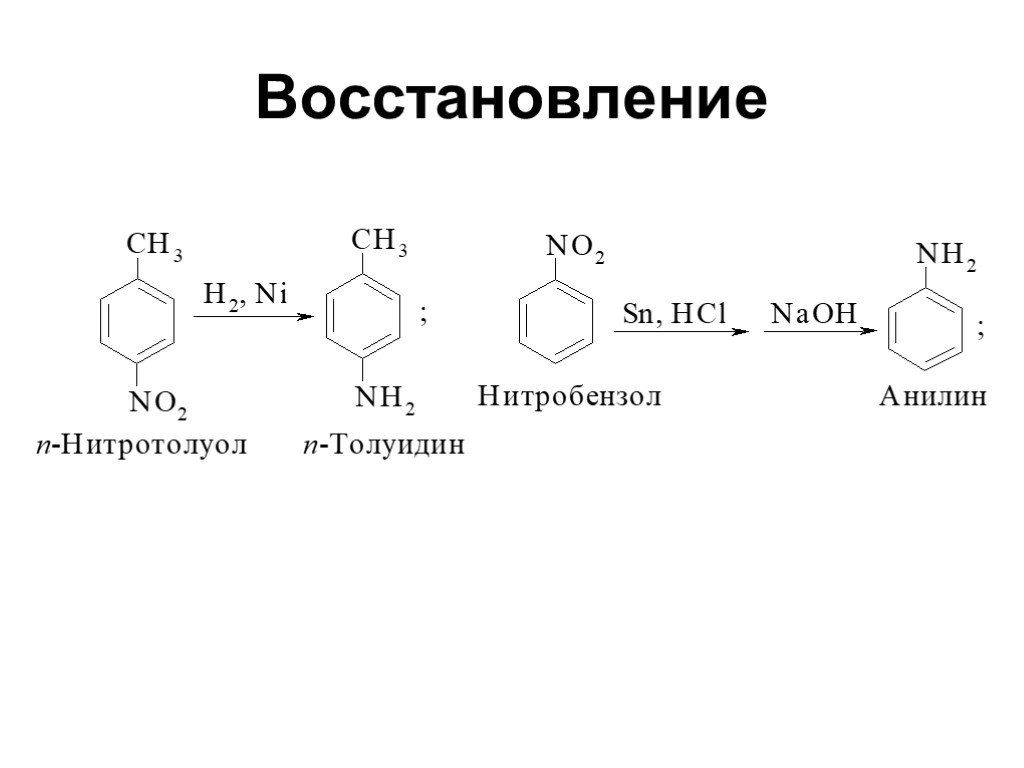
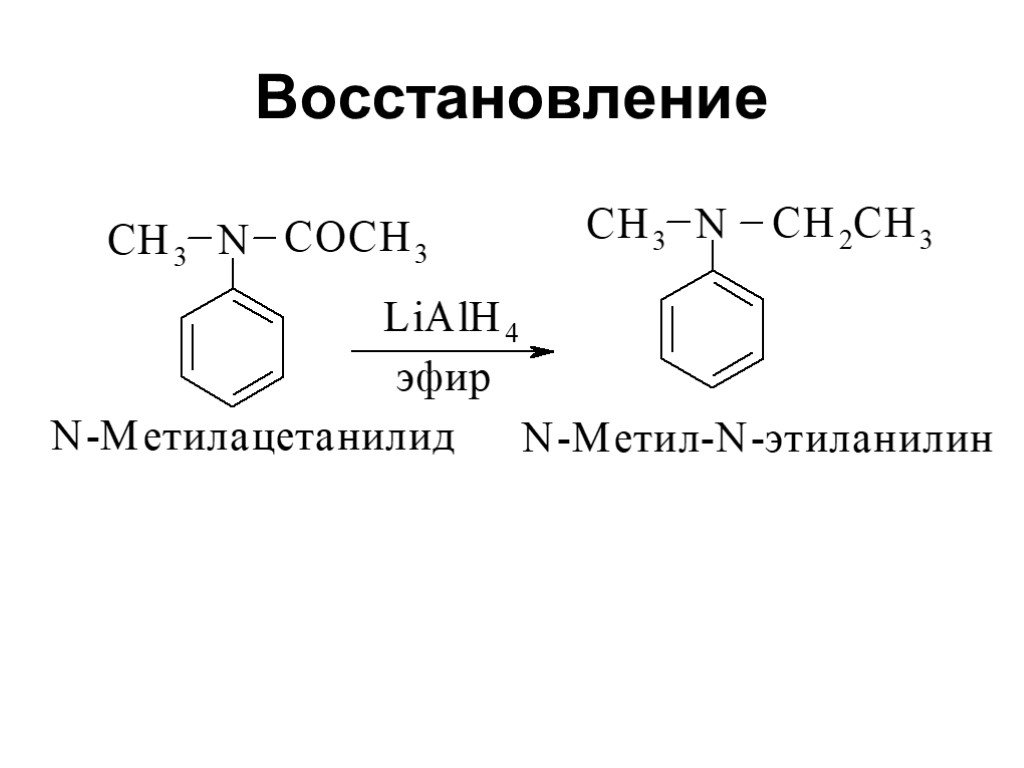
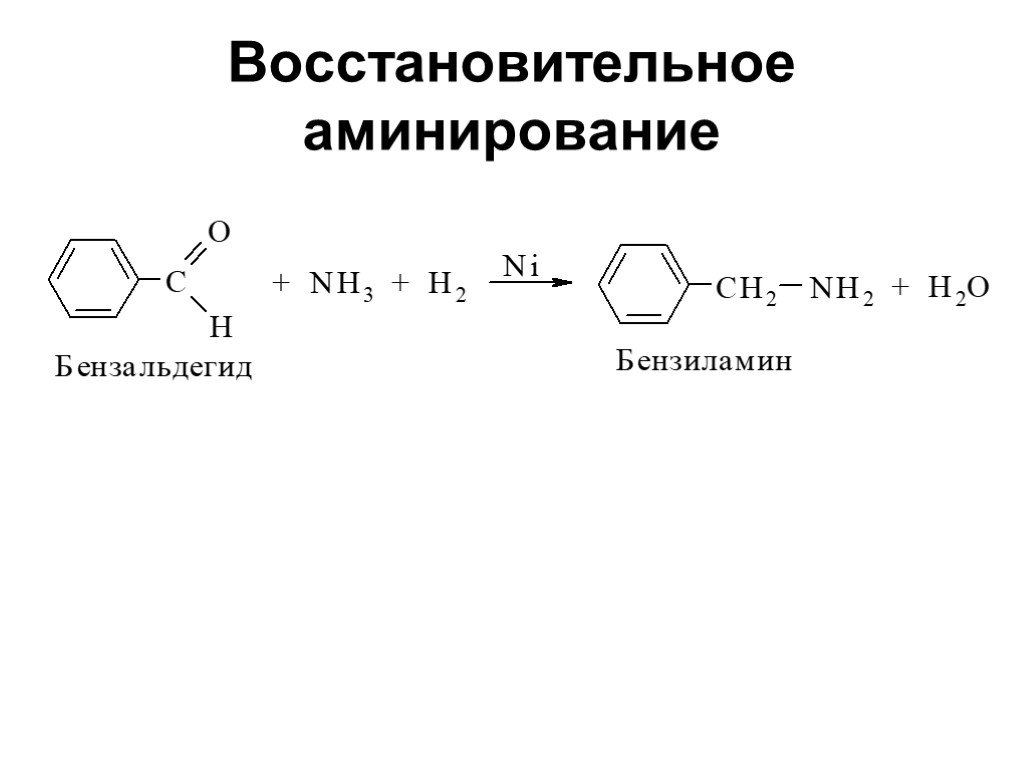
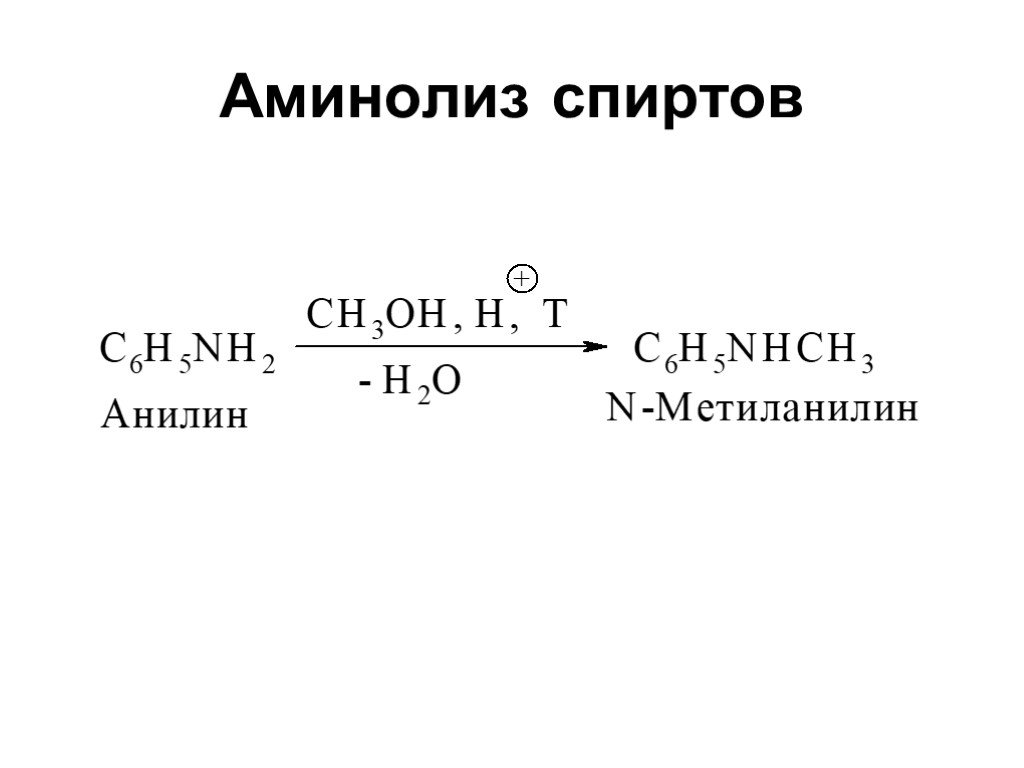
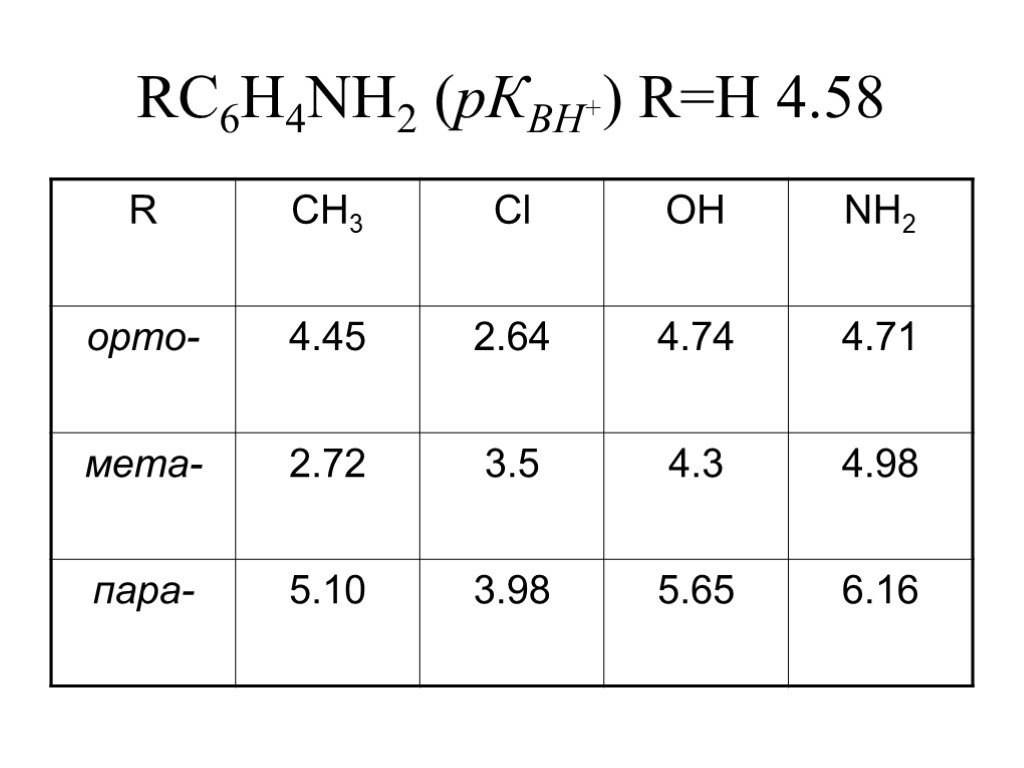
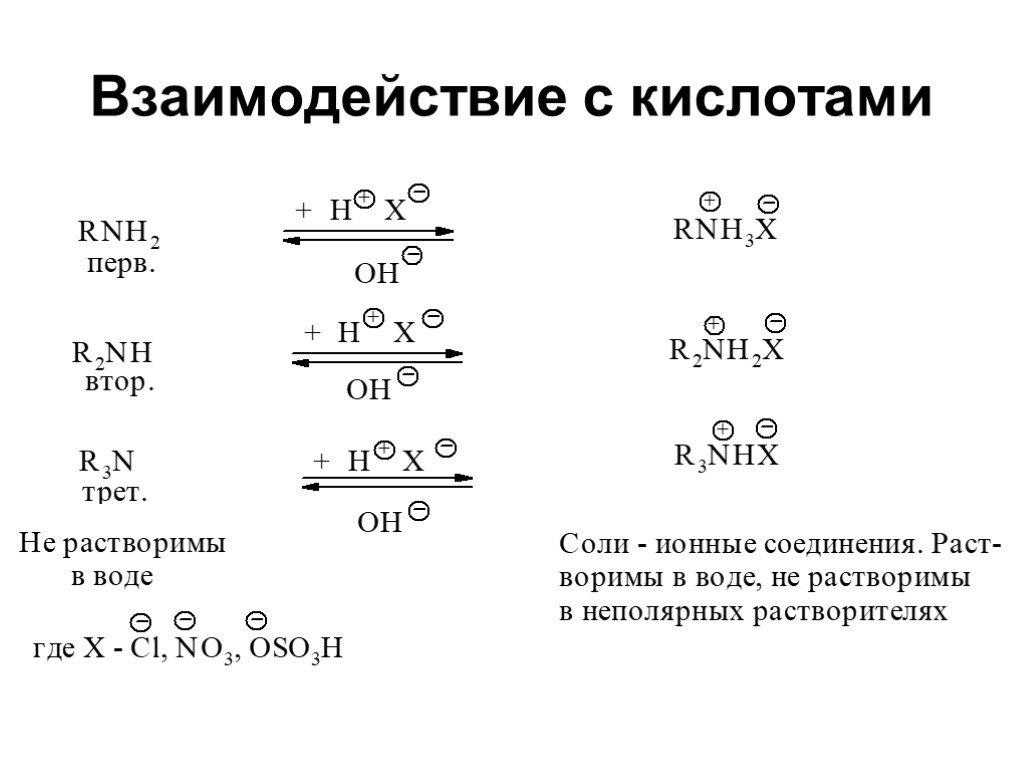
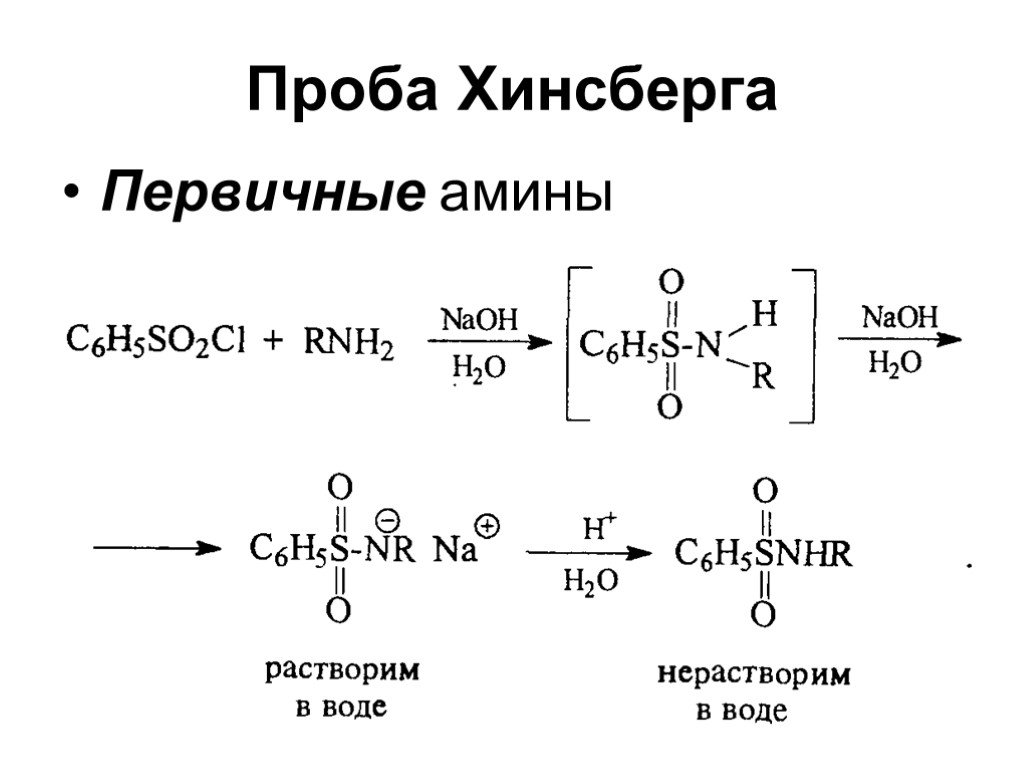
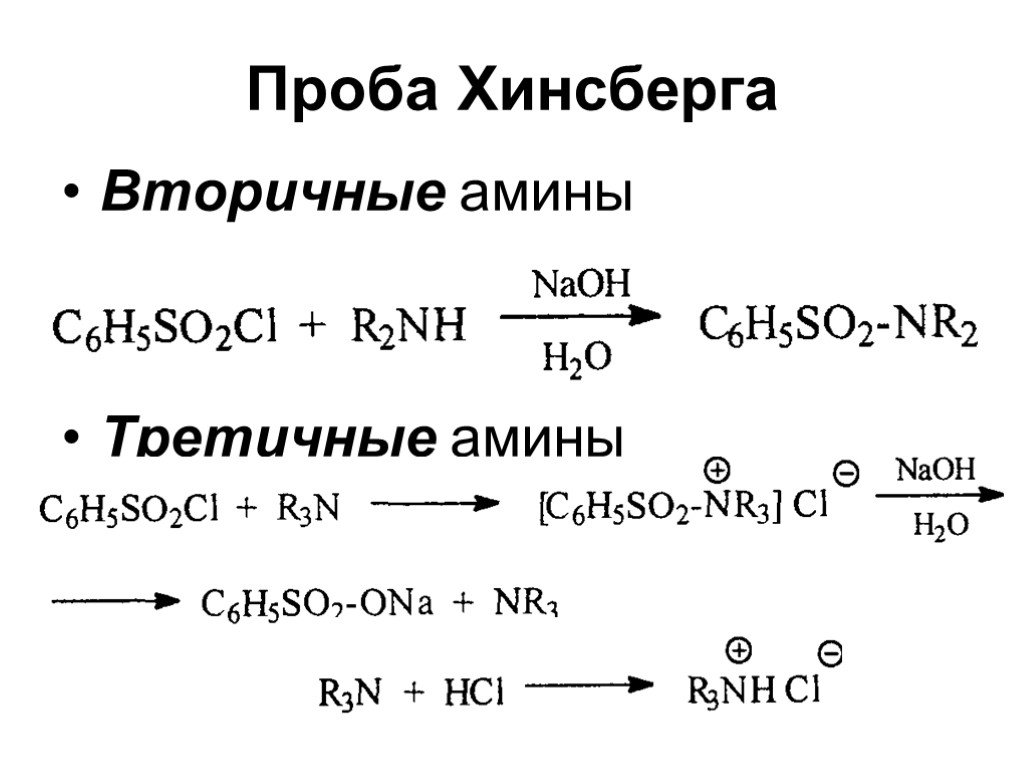
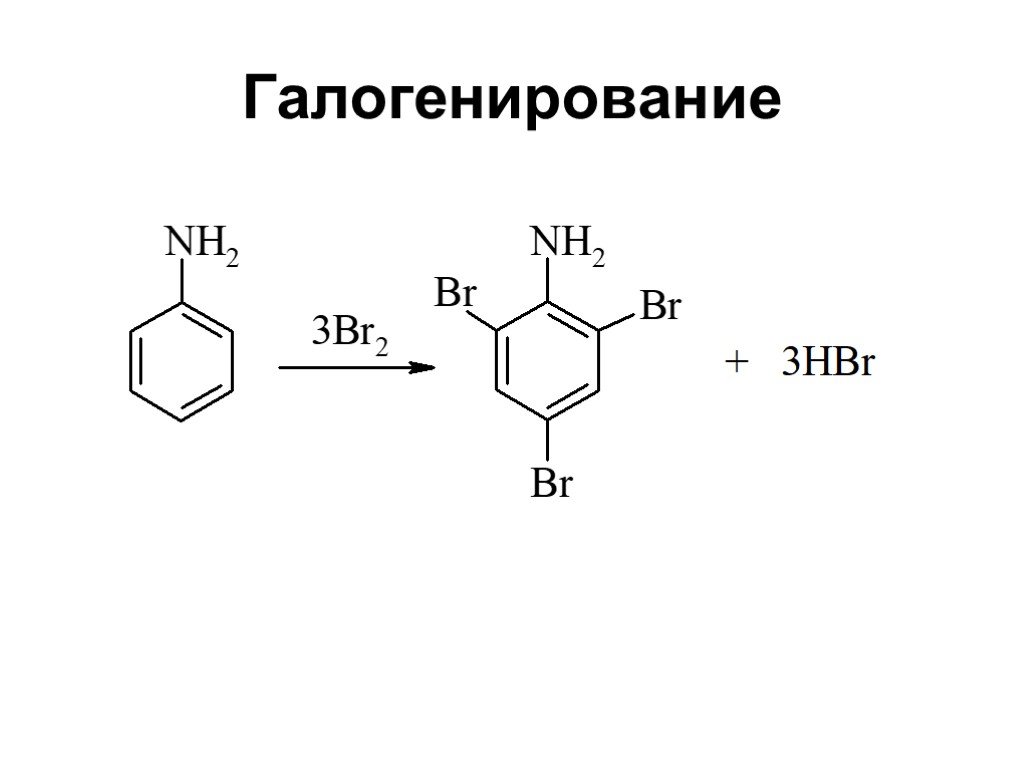
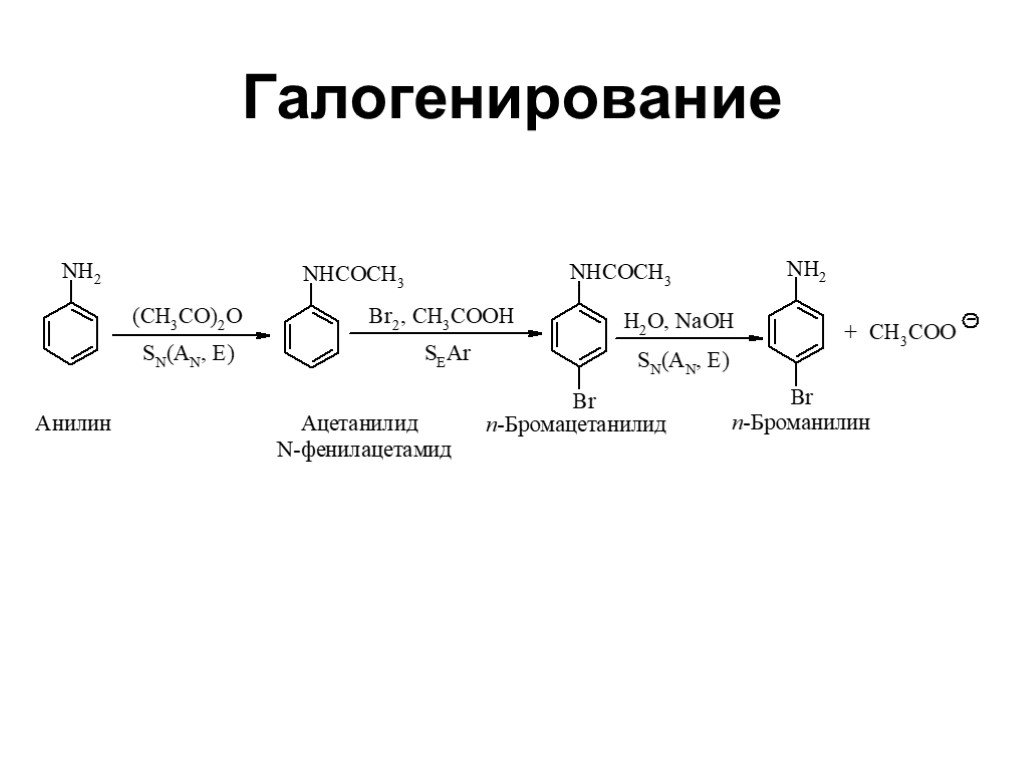
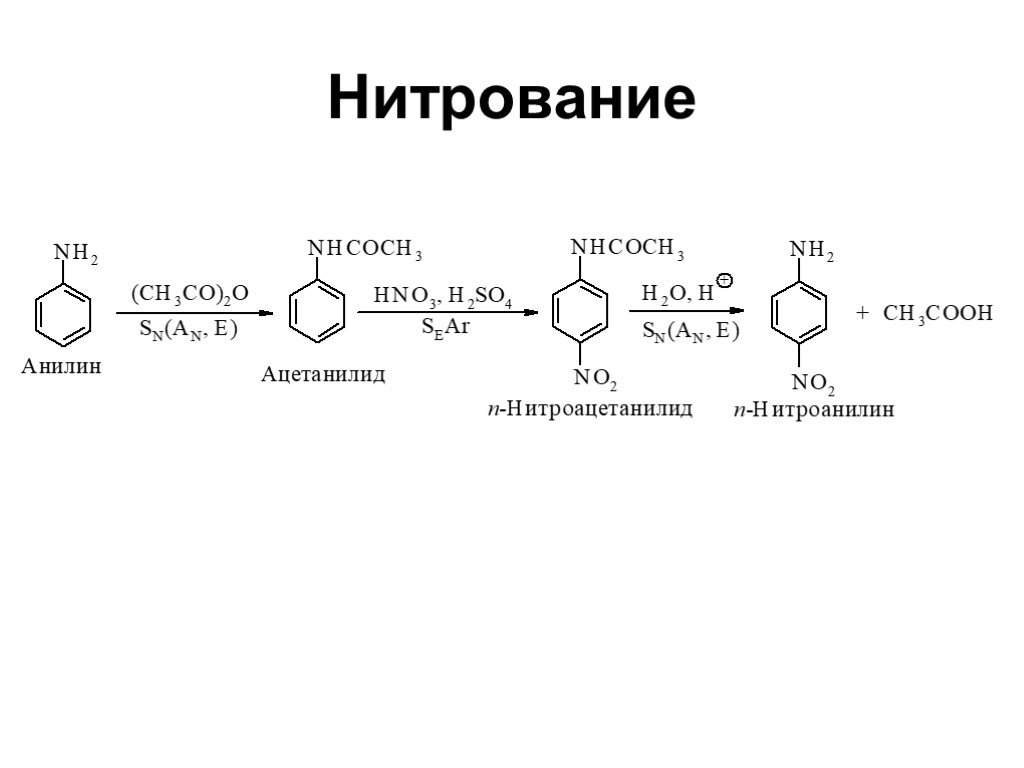
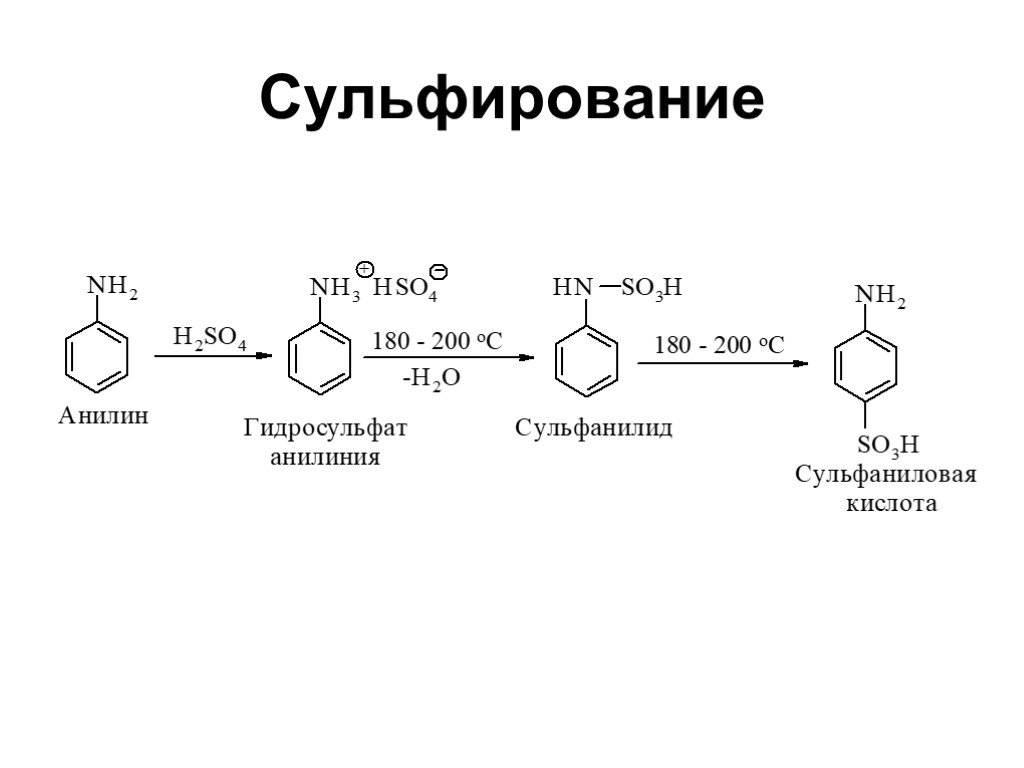
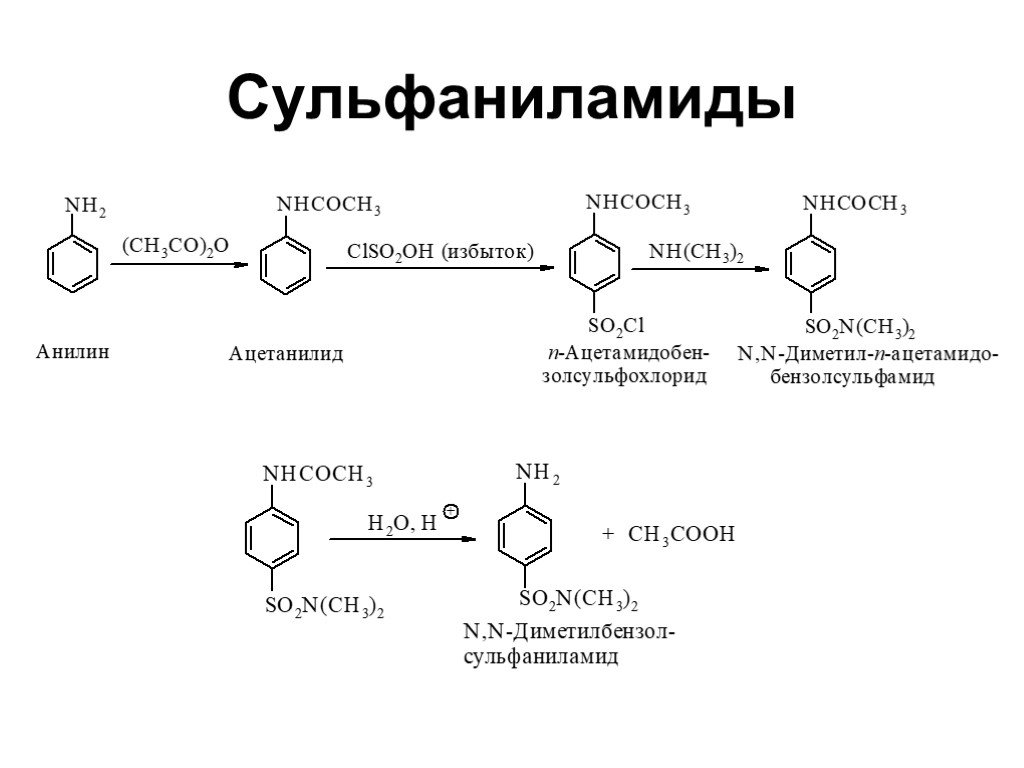
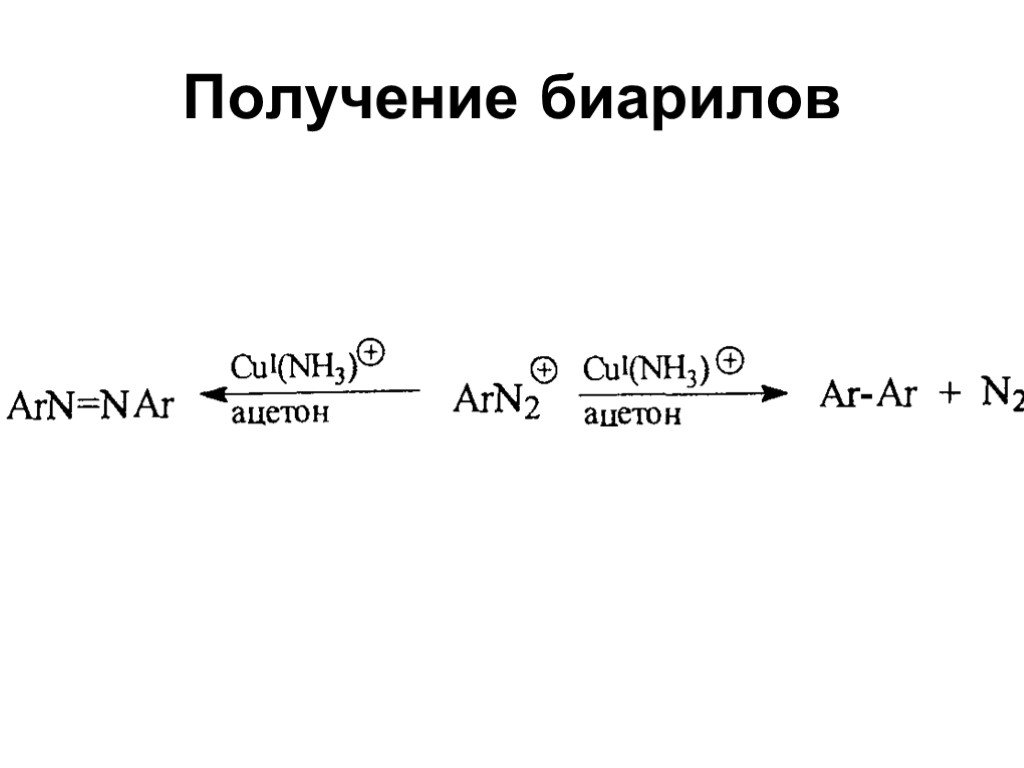
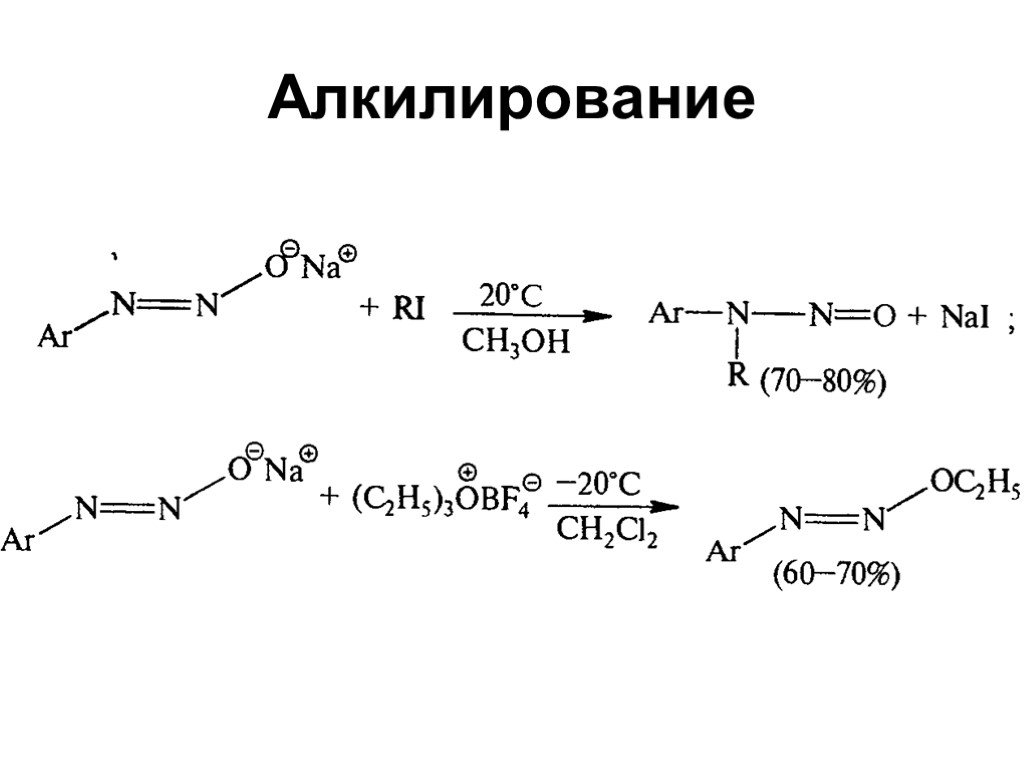
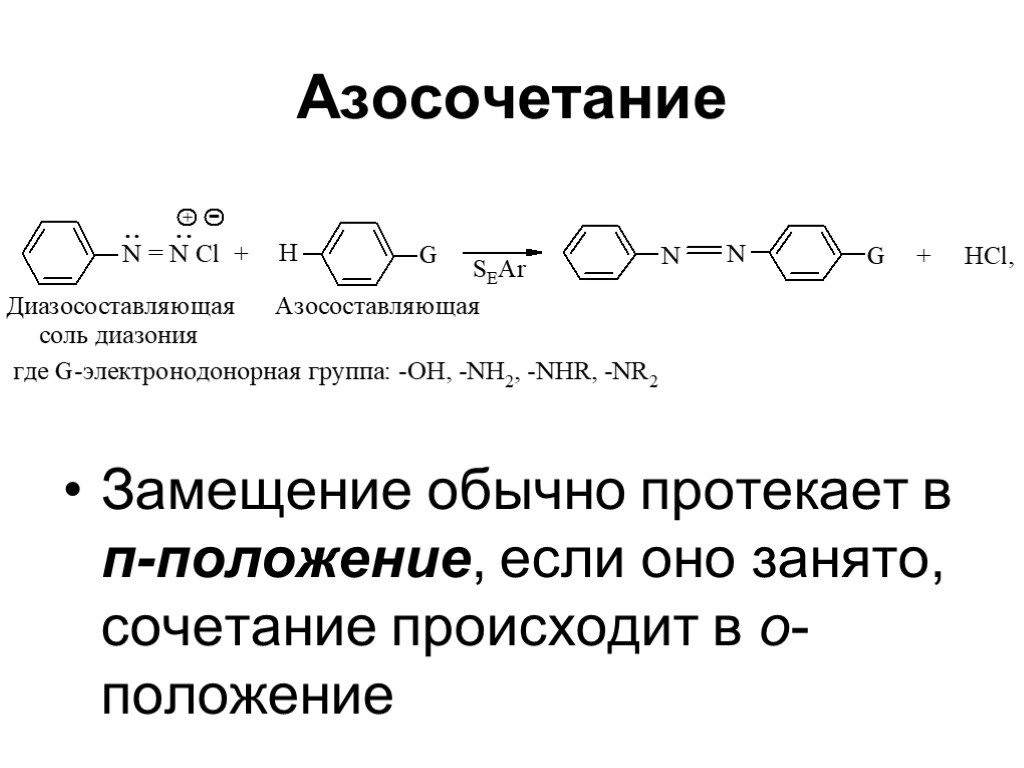
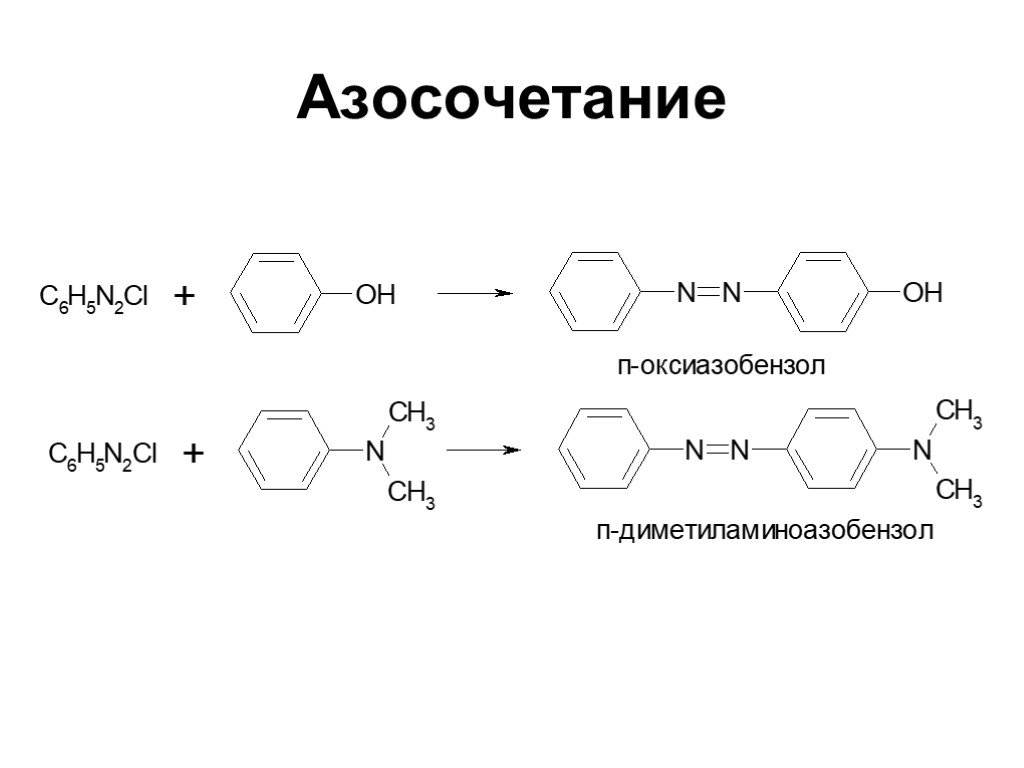
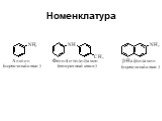
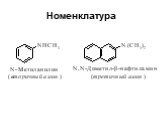
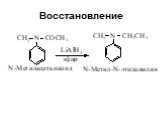
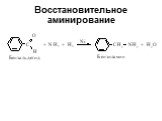
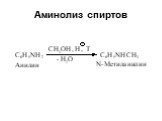
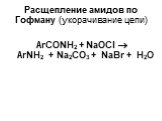
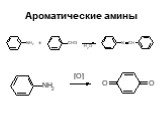
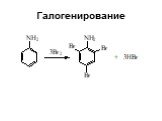
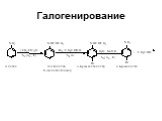
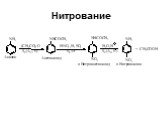
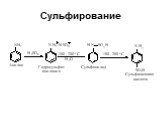
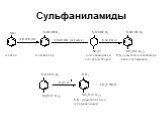
Ами́ны — органические соединения, являющиеся производными аммиака, в молекуле которого один, два или три атома водорода замещены на углеводородные ...Амины
Назовите вещества. а) С3Н8 б)С2Н 4 в) С2Н2 г)С2Н5ОН д)СН3СНО е) СН3СООН ж) СН3NH2 з ) C2H5NH2. Амины. Что хочу узнать? Номенклатура аминов Физические ...Карбоновые кислоты и их производные
Функциональные производные карбоновых кислот. Образование сложных эфиров R'–COOR":. Реакция образования сложного эфира из кислоты и спирта называется ...Применение аммиака
Использование в сельском хозяйстве. Использование. Мировое производство аммиака составило в 1980 году более 90 млн. тонн. До образования Украины на ...Кислородсодержащие органические соединения
КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ. Кафедра ЭПП, к.х.н., доцент Саверченко А.Н. Студент должен: знать строение, номенклатуру, свойства, способы ...Производство аммиака
Изучить научные принципы производства аммиака. Цель. Задачи. Разработать оптимальные условия синтеза аммиака. Составить технологическую схему производства. ...Кислоты органические и неорганические
Кисло́ты — сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков. Они получили своё название ...Строение молекулы аммиака
Строение молекулы аммиака. Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине; Атом азота образует с тремя атомами водорода ...Конспекты
Практическая работа №3 Получение аммиака и изучение его свойств
Дата_____________ Класс_______________. Тема:. . Практическая работа №3 Получение аммиака и изучение его свойств. Цели урока:. закрепить умения ...Соли как производные кислот и оснований
Класс. 8. Тема. Соли как производные кислот и оснований. Тип урока. урок открытия нового знания. Цели:. Образовательная:. способствовать ...Кислоты органические и неорганические. Классификация и общие свойства кислот
Конспект открытого урока химии в 11 классе. «Кислоты органические и неорганические. Классификация и общие свойства кислот». Тема урока. Кислоты. ...Основания: органические и неорганические
Колосова Марина Николаевна. МОУ Тёшинская СОШ. Учитель химии и географии,. . 1 квалификационной категории. Конспект урока химии в 11 классе ...Кислородсодержащие органические соединения. Спирты
Тема:. Кислородсодержащие органические соединения. Спирты. Цель:. изучение нового класса органических веществ «Спирты», формирование знаний о ...Кислородсодержащие органические соединения. Спирты и фенолы
Шайтанова Екатерина Игоревна. Преподаватель химии и биологии. Николаевский-на-Амуре филиал. коренных малочисленных народов Севера. краевого государственного ...Кислородсодержащие органические соединения и их природные источники
ПЛАН-КОНСПЕКТ УРОКА. «Химические свойства спиртов». . ФИО (полностью). . Хочуева Фатима Заурбековна. . . . Место работы. . ...Кислородсодержащие органические соединения. Предельные одноатомные спирты
Государственное общеобразовательное учреждение -. средняя общеобразовательная школа. при Посольстве России в Турции. Конспект урока по химии ...Кислородсодержащие органические соединения
Модульное изучение темы «. Кислородсодержащие органические соединения. ».10 класс. Цель:. создание условий для выявления учащимися взаимосвязи между ...Кислородсодержащие органические соединения
Е.А.Кудравец, учитель химии. МОУ гимназии № 32. . Дидактическая разработка урока. . Тема:. «Кислородосодержащие органические соединения». ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:6 марта 2019
Категория:Химия
Содержит:83 слайд(ов)
Поделись с друзьями:
Скачать презентацию







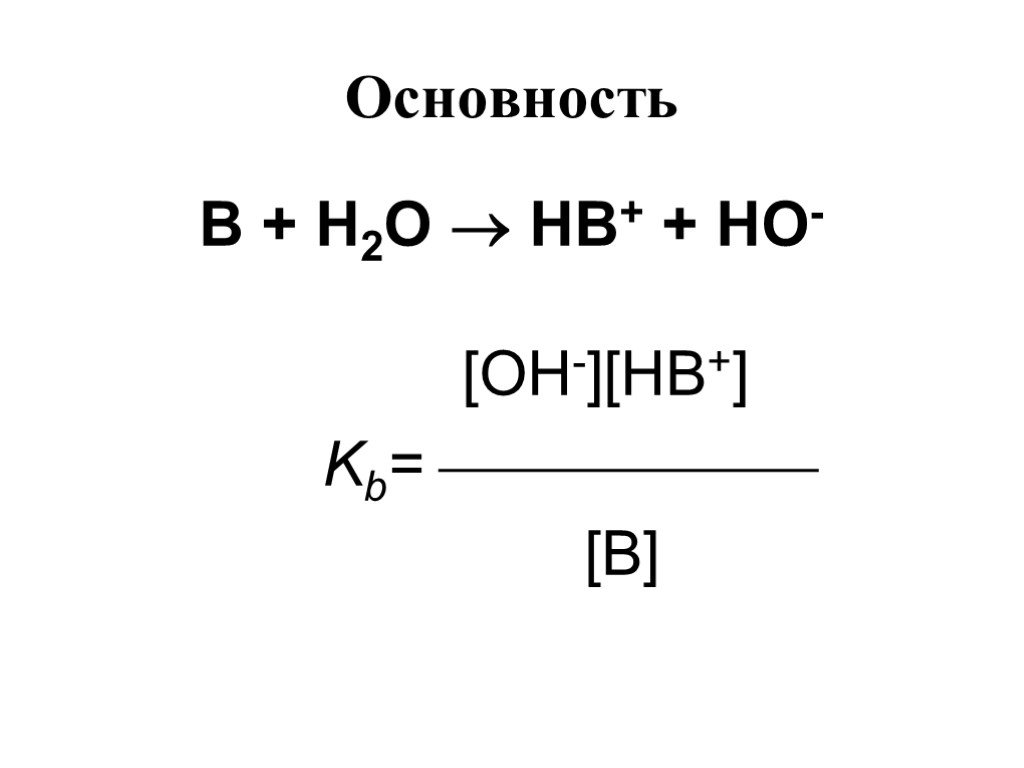







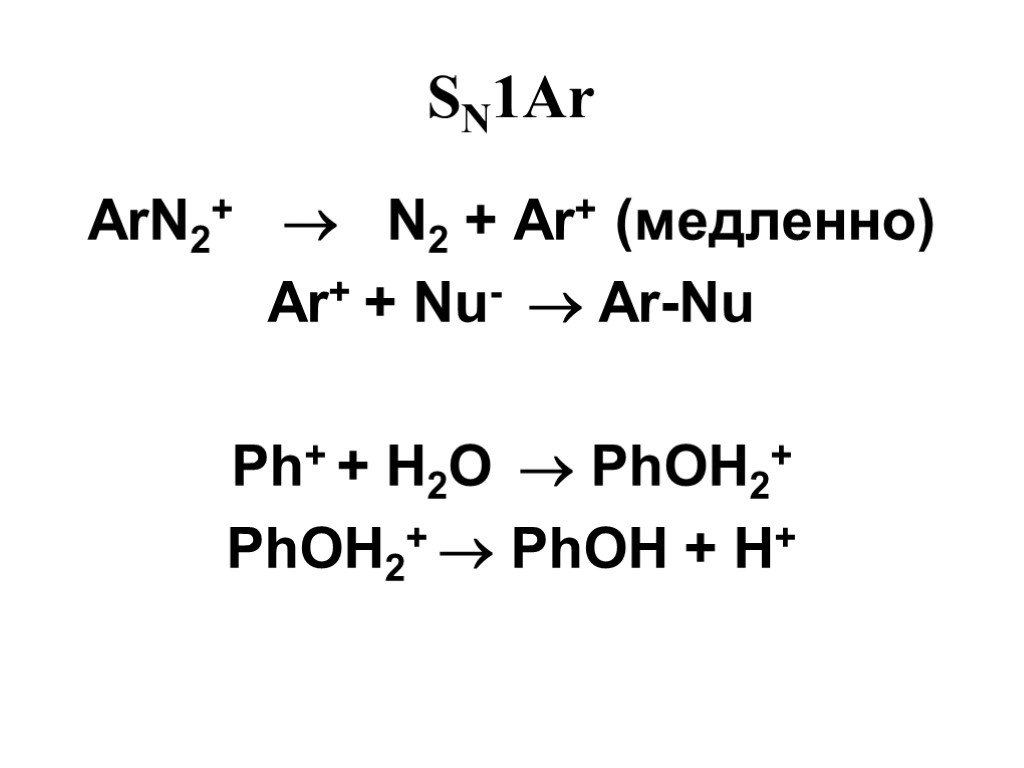













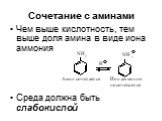
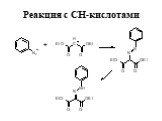
![Основность. В + Н2О НВ+ + НО- [OH-][HB+] Kb= [B] Основность. В + Н2О НВ+ + НО- [OH-][HB+] Kb= [B]](https://prezentacii.org/upload/cloud/19/03/131330/images/thumbs/screen15.jpg)



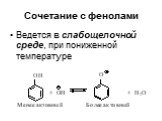
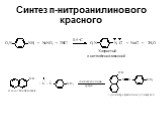
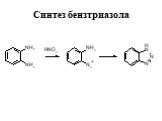
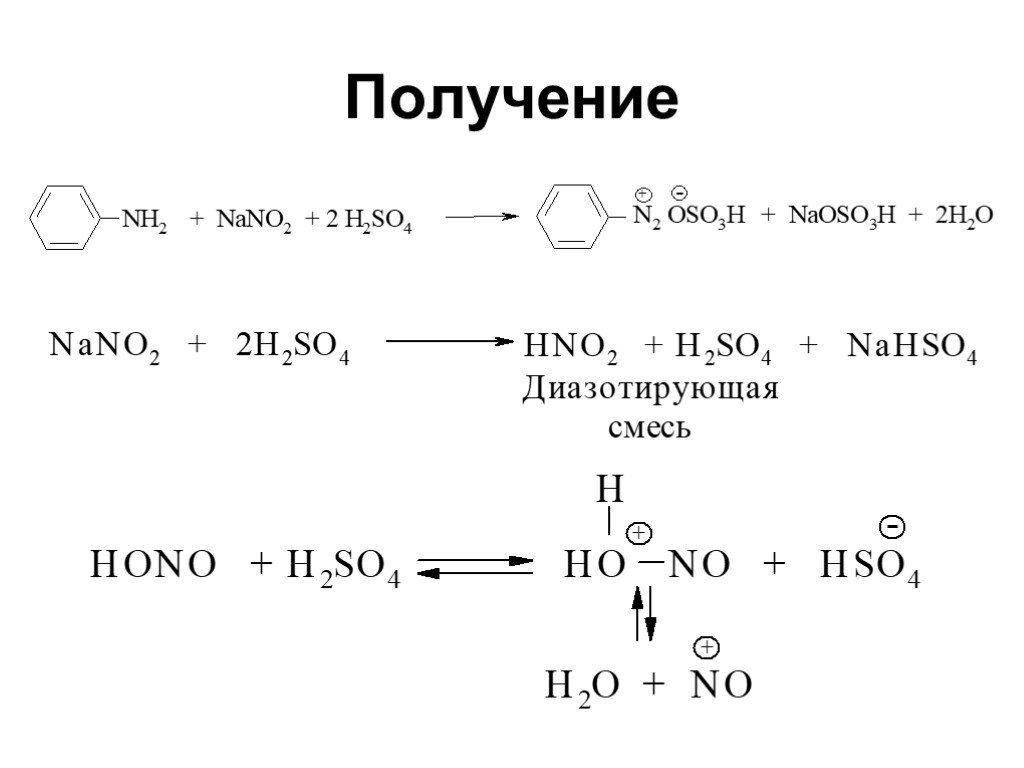
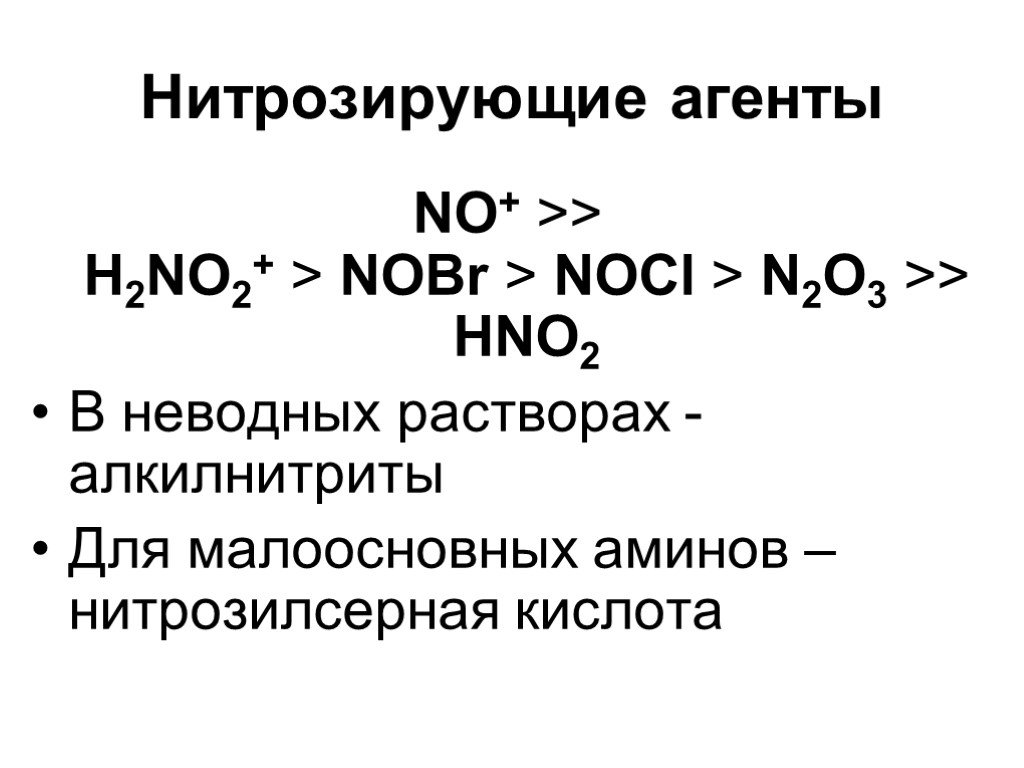
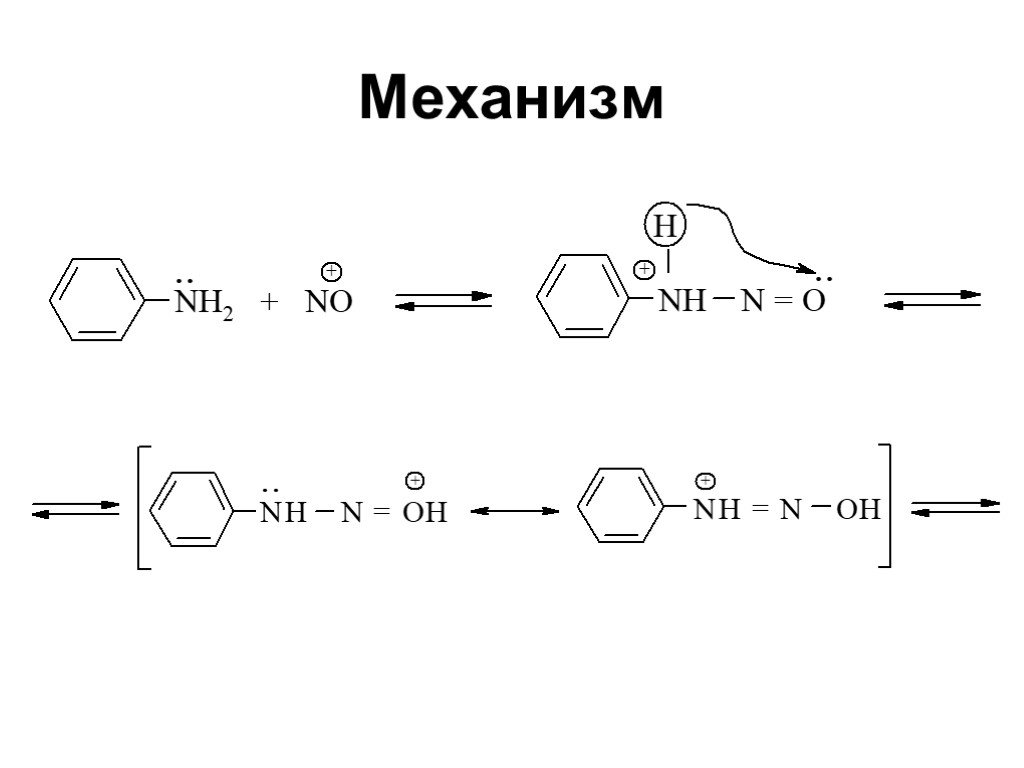
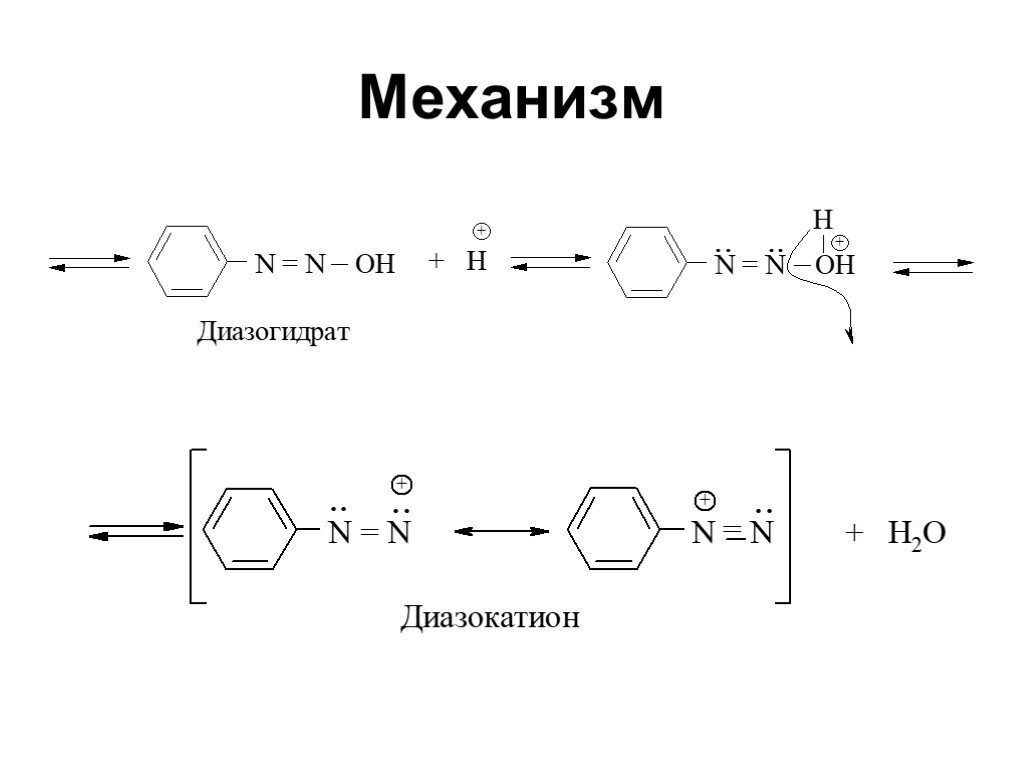
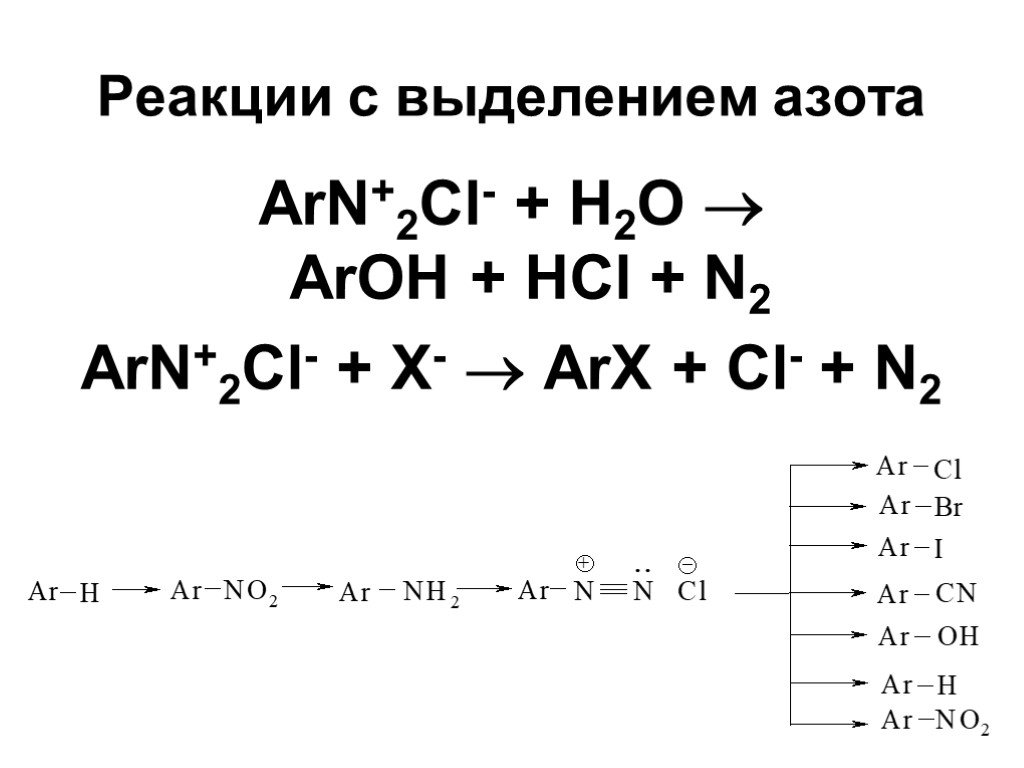
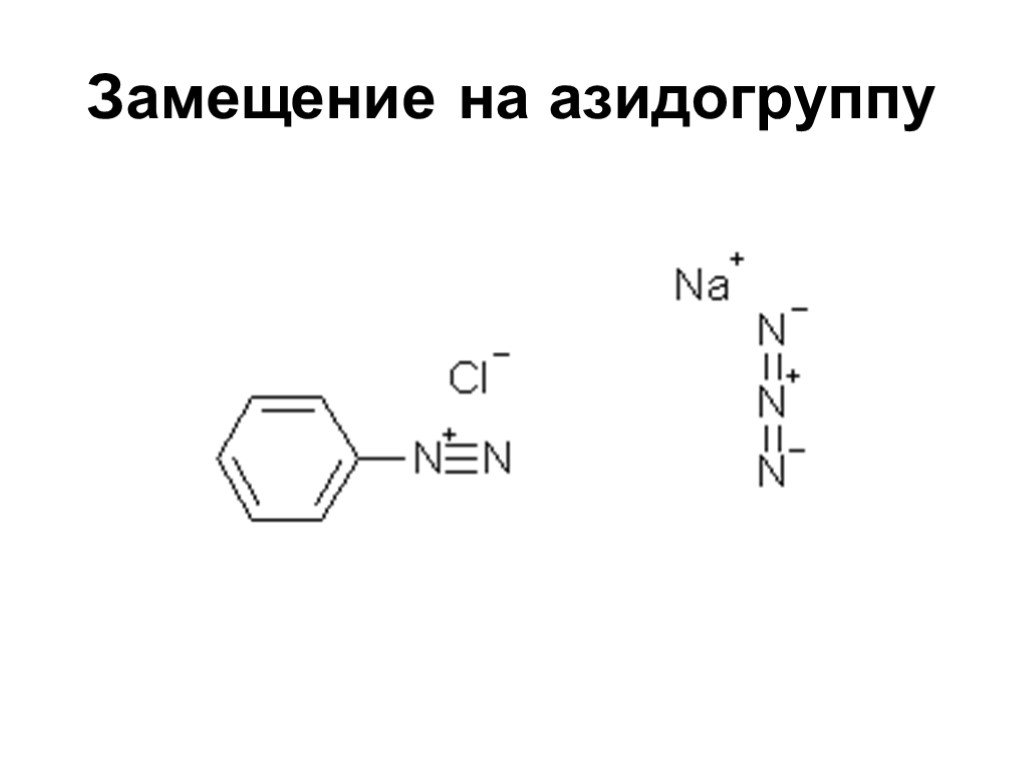
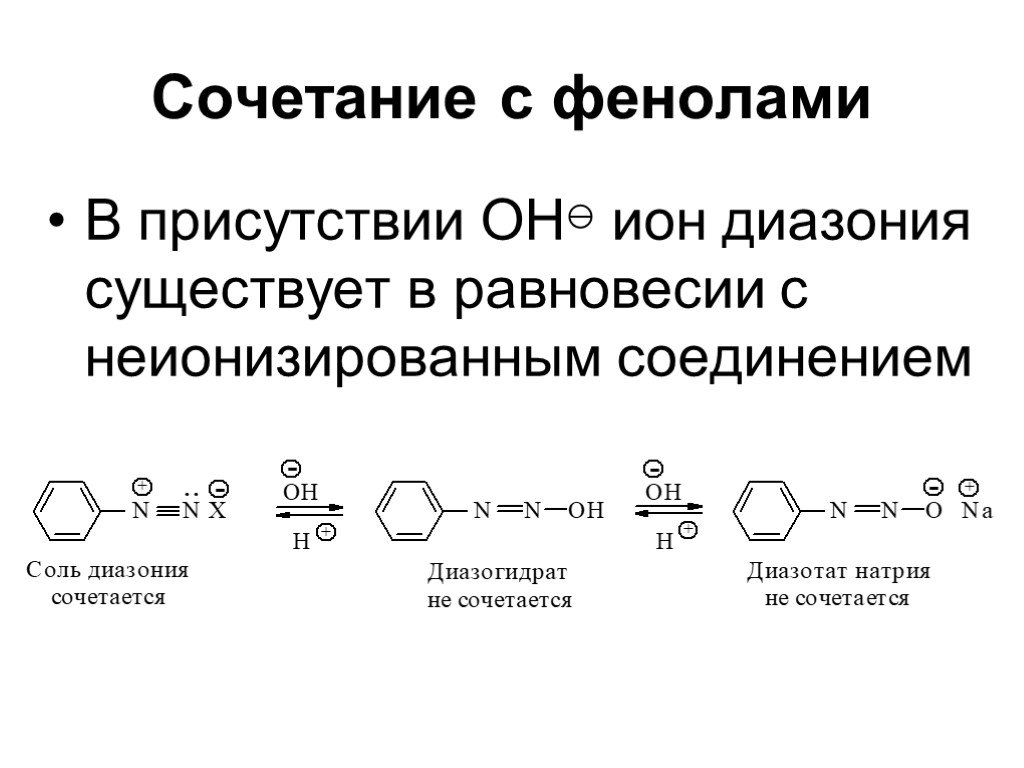
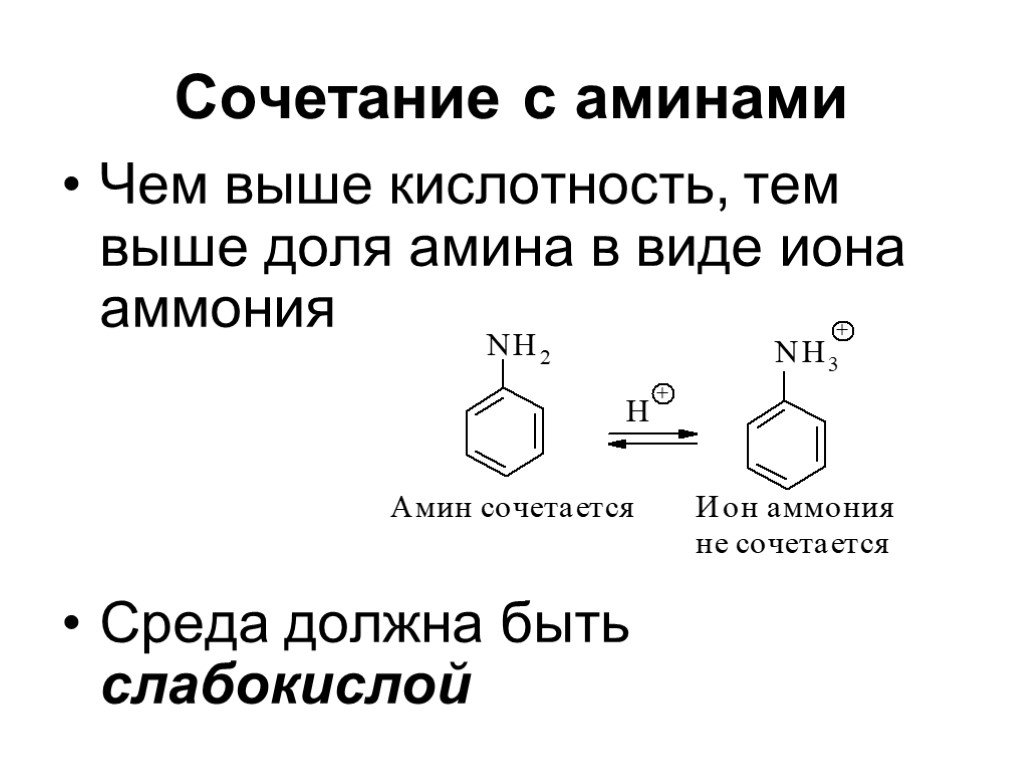
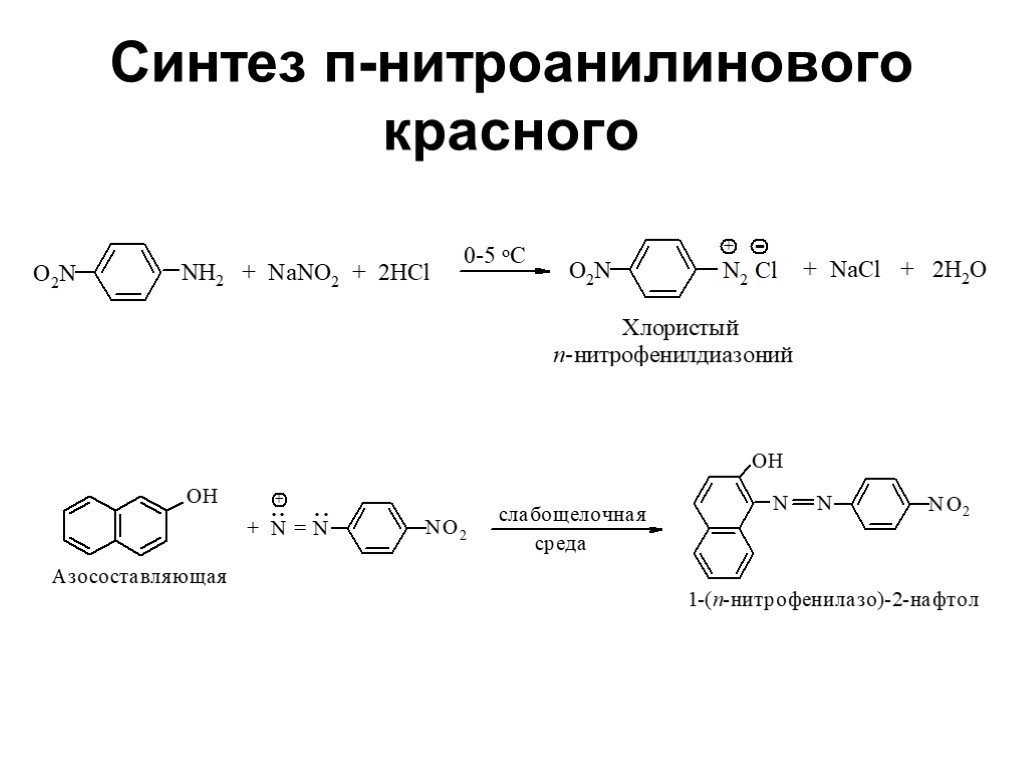
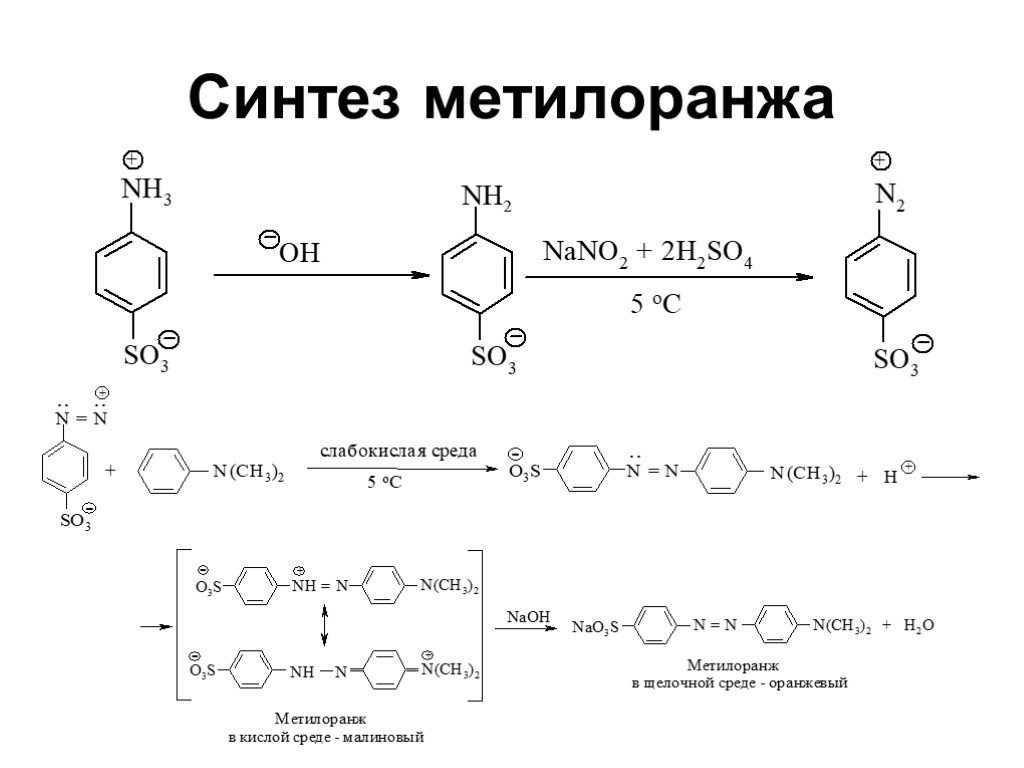
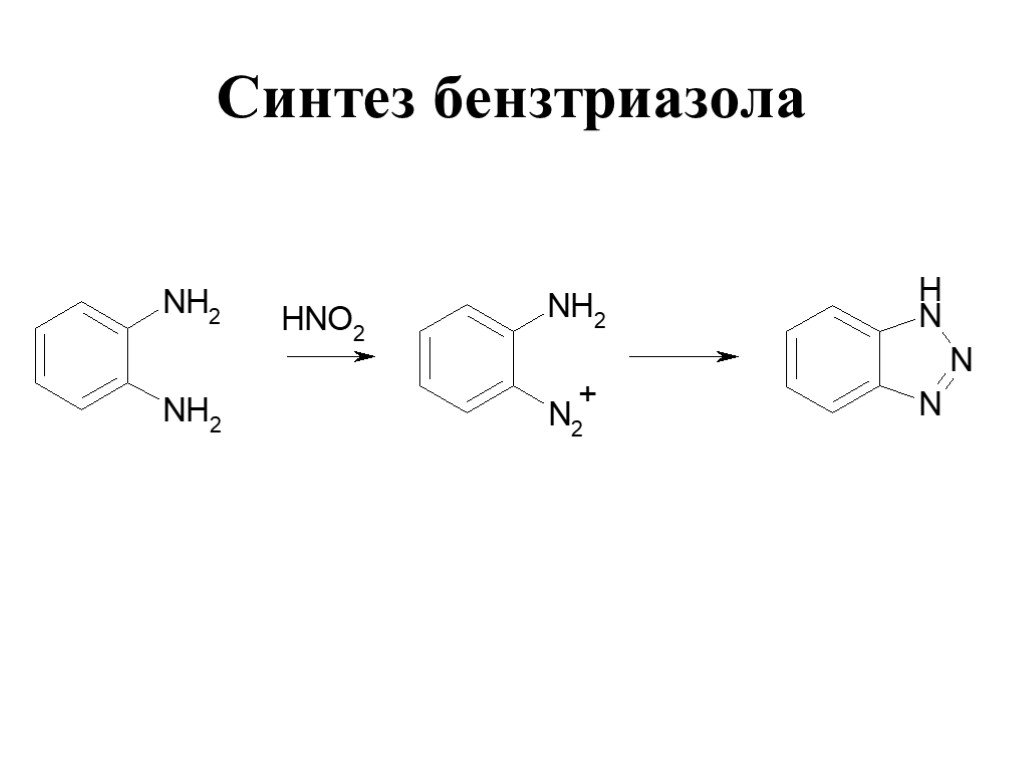
![Ароматические амины. Первичные при взаимодействии с азотистой кислотой дают соли диазония: PhNH2HCl + НОNO [Ph-NN]Cl + 2 Н2О Ароматические амины. Первичные при взаимодействии с азотистой кислотой дают соли диазония: PhNH2HCl + НОNO [Ph-NN]Cl + 2 Н2О](https://prezentacii.org/upload/cloud/19/03/131330/images/thumbs/screen24.jpg)



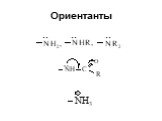


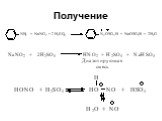

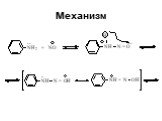
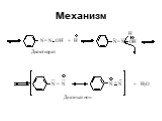
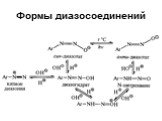


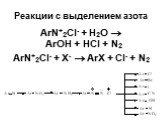
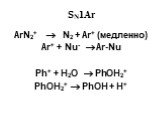
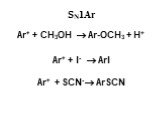
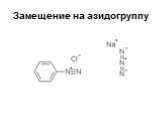

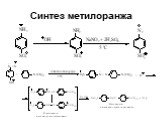
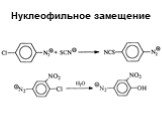
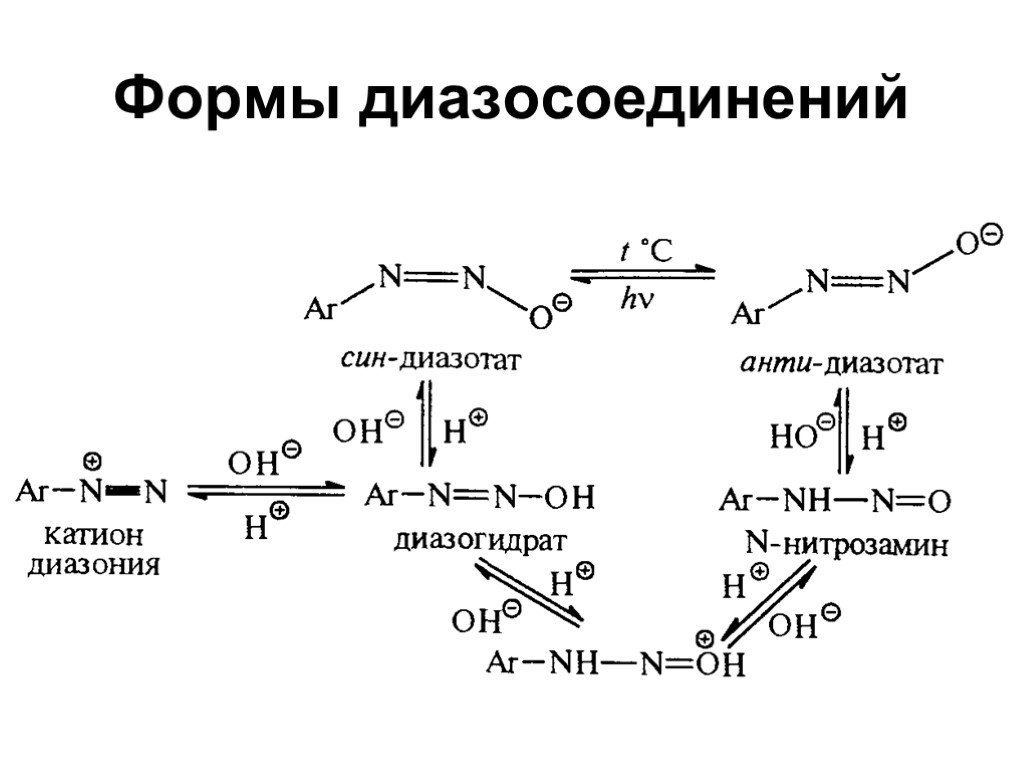
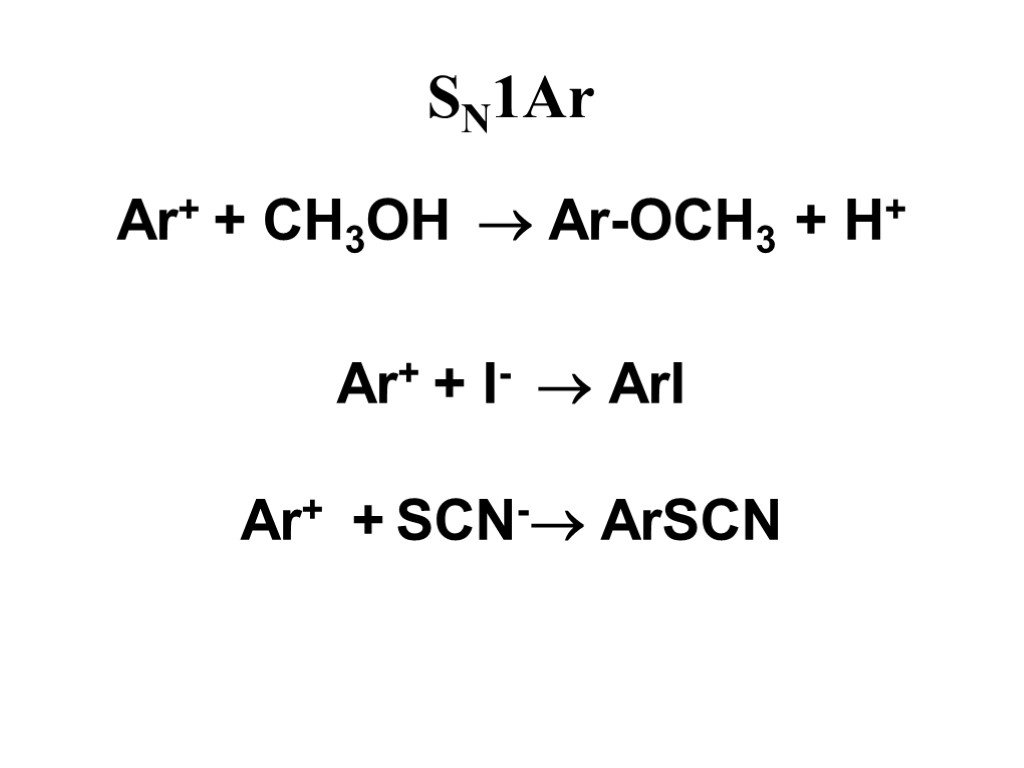
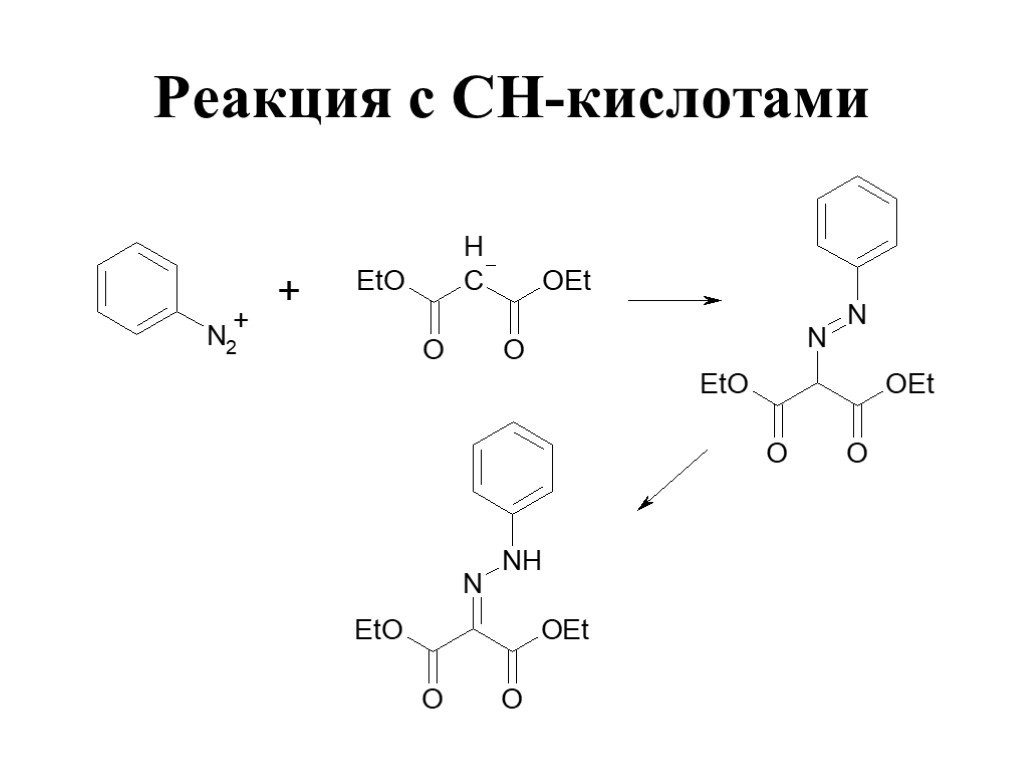
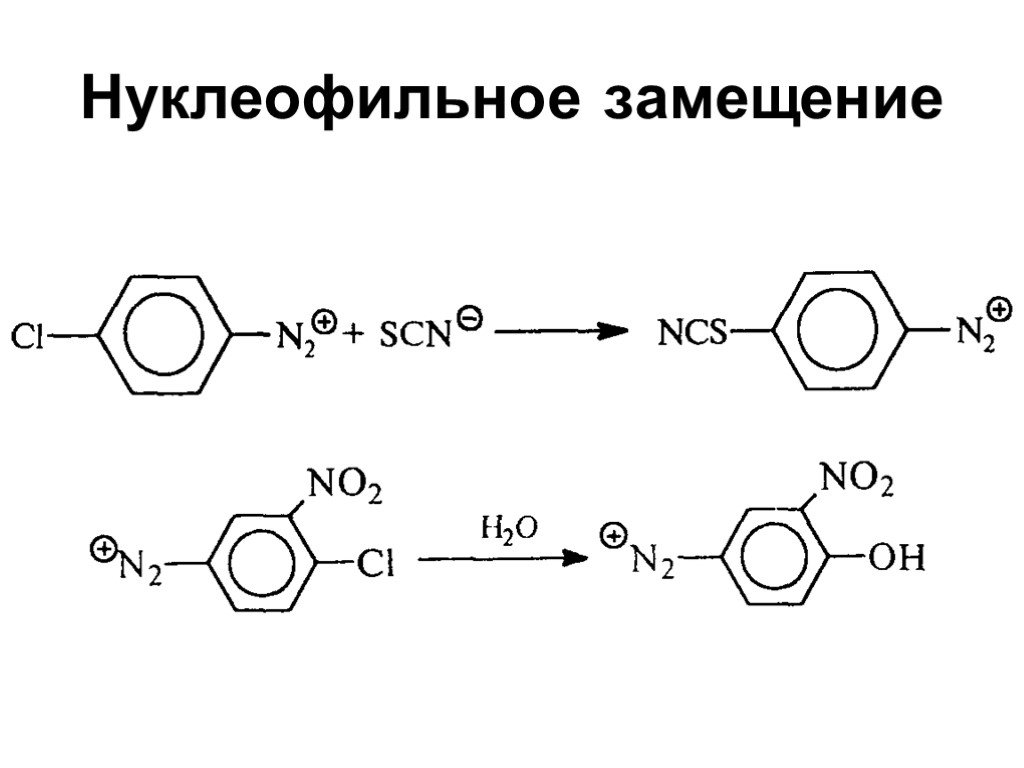
![1) Скорость не зависит от [Nu] 2) Влияние заместителей в ароматическом кольце 3) Ar15N+N ArN+N15 1) Скорость не зависит от [Nu] 2) Влияние заместителей в ароматическом кольце 3) Ar15N+N ArN+N15](https://prezentacii.org/upload/cloud/19/03/131330/images/thumbs/screen50.jpg)
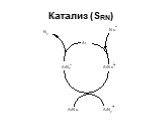

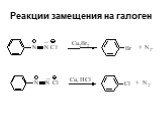

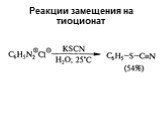
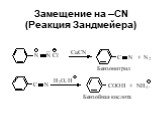


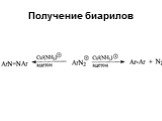

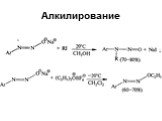
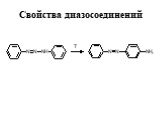
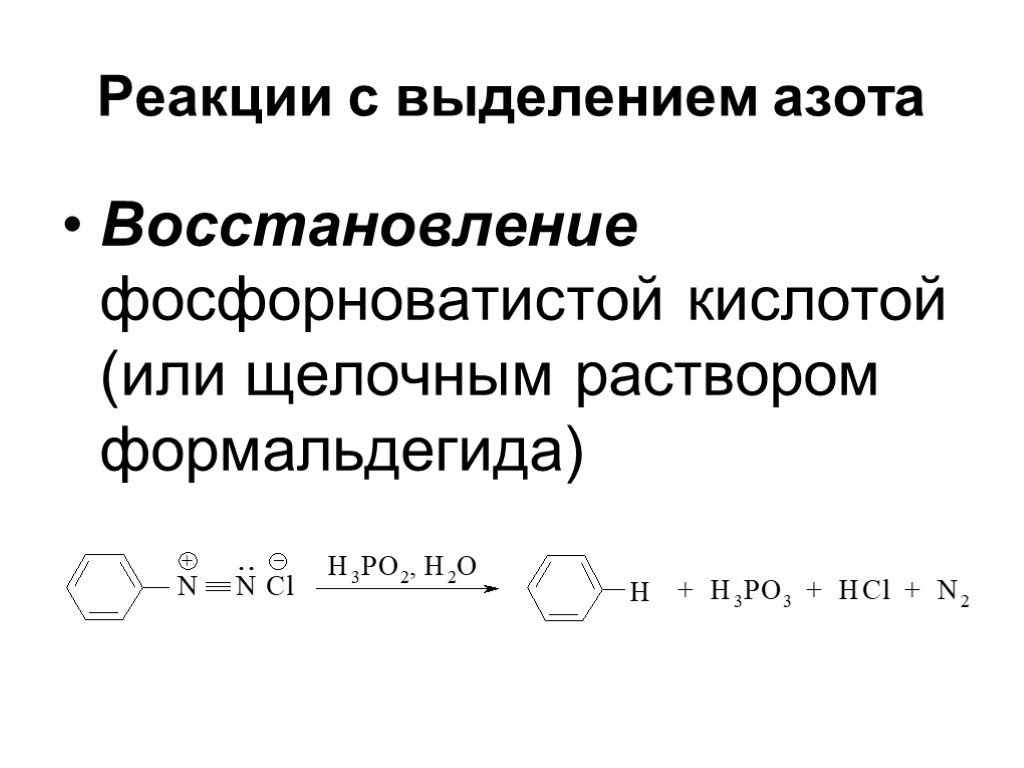
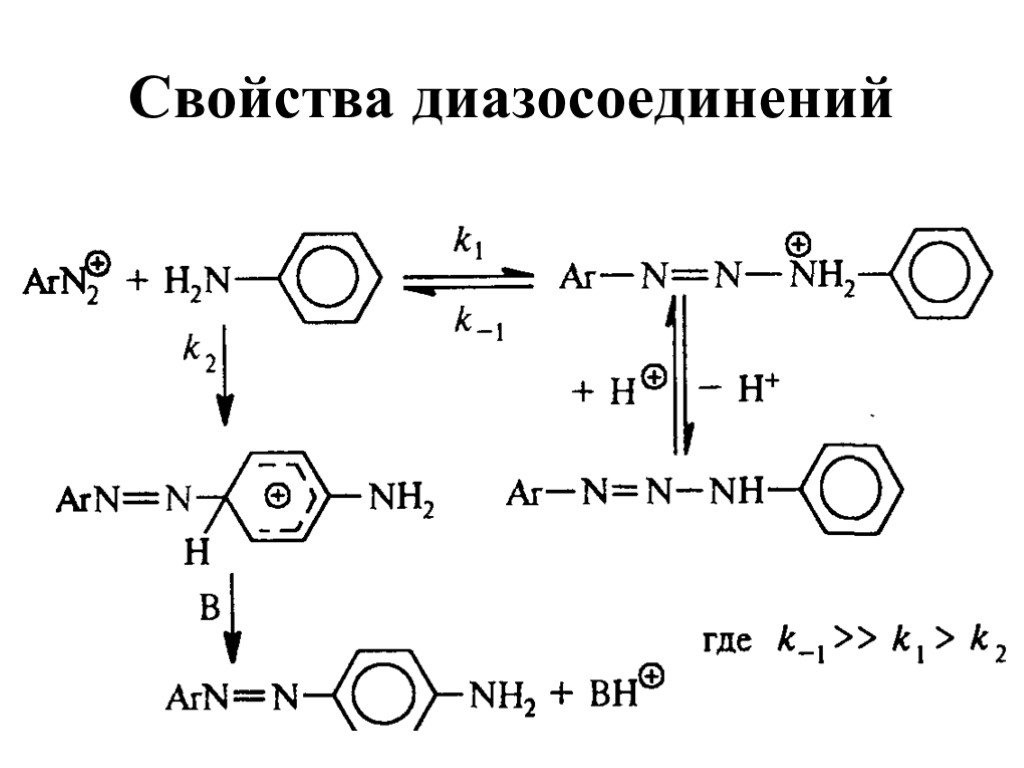
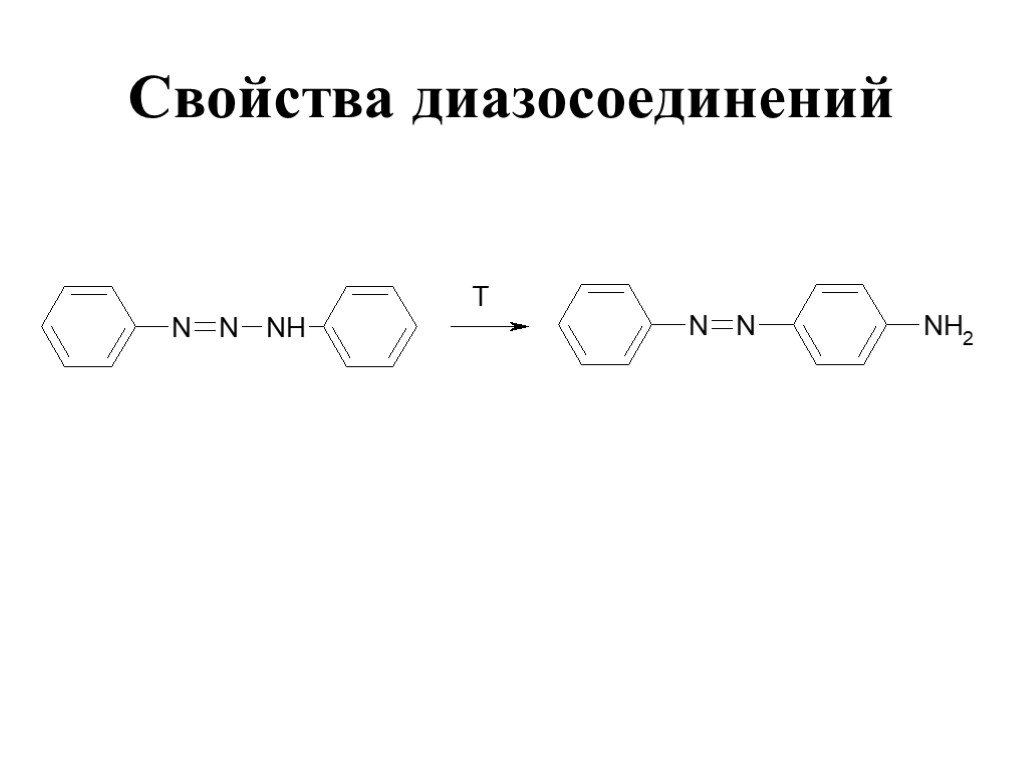
![Свойства диазосоединений. ArN2+ + [Н] ArNHNH2 Свойства диазосоединений. ArN2+ + [Н] ArNHNH2](https://prezentacii.org/upload/cloud/19/03/131330/images/thumbs/screen62.jpg)