Презентация "Подготовка к ЕГЭ: Кислородсодержащие органические соединения. Карбоновые кислоты" по химии – проект, доклад
Презентацию на тему "Подготовка к ЕГЭ: Кислородсодержащие органические соединения. Карбоновые кислоты" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 45 слайд(ов).
Слайды презентации
Список похожих презентаций
Кислородсодержащие органические соединения
КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ. Кафедра ЭПП, к.х.н., доцент Саверченко А.Н. Студент должен: знать строение, номенклатуру, свойства, способы ...Кислоты органические и неорганические
Кисло́ты — сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков. Они получили своё название ...Предельные одноосновные карбоновые кислоты
Тема урока: «Предельные одноосновные карбоновые кислоты». Цель урока: •Знать строение одноосновных карбоновых кислот, их определение, изомеры, гомологи, ...Кислородсодержащие кислоты хлора
Хлорноватистая кислота HClO. Строение. Физические свойства. В свободном виде не выделена. Существует в растворе, максимальная массовая доля 20-25% ...Подготовка к ЕГЭ "Строение атома"
Число электронов во внешнем электронном слое атома, ядро которого содержит 8 протонов, равно. 1) 8 2) 2 3) 6 4) 4. Число электронов в ионе железа ...Предельные карбоновые кислоты
Тема урока: «Предельные одноосновные карбоновые кислоты». Цель урока: •Знать строение одноосновных карбоновых кислот, их определение, изомеры, гомологи, ...Керамики - неорганические соединения
Еще Глейтером в 1981 году был введен термин «нанокристаллические» материалы, позже стали использоваться такие термины как «наноструктурные», «нанофазные», ...Подготовка к ЕГЭ. Полезно знать
Задачи на смеси и сплавы. Удобно решать с использованием следующих вспомогательных средств: каждая отдельная смесь (или сплав), фигурирующая в задаче, ...Карбоновые кислоты-викторина
Цели: Воспитание позитивного отношения к химии. Развитие у учащихся творческого начала. Формирование умения работать в коллективе. Обучение применению ...Органические кислоты
Выберите раздел Лимонная кислота. Муравьиная кислота. Ацетилсалициловая кислота. Молочная кислота Яблочная кислота. Высшие жирные кислоты. Уксусная ...Органические соединения железа
Почему наш век можно назвать железным веком? Элементы и атомы, В менделеевский взятые круг, Сделали химию самой богатой И самой творческой из наук. ...Органические вещества. Нуклеиновые кислоты
Цель урока: изучение строения и функций нуклеиновых кислот. Задачи: Образовательная: показать взаимосвязь строения и выполняемой функции на примере ...Карбоновые кислоты и их строение
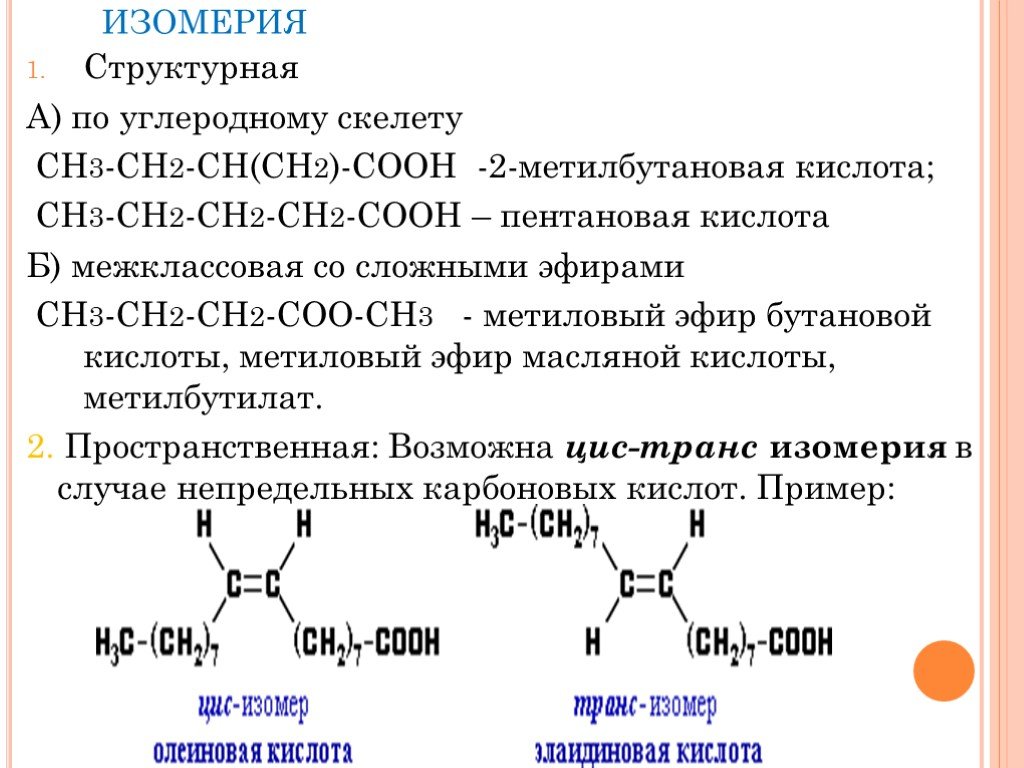
Назовите:. Н-СООН СН3-СООН СН3-СН2-СООН СН3-СН2-СН2-СООН СН3-СН2-СН2-СН2-СООН O R-C CnH2nO2 OH. Выберите изомеры и гомологи. а)СН3-СН-СООН б) СН3 ...Органические кислоты
Почти во всех продовольственных товарах содержатся кислоты или их кислые и средние соли. В продукты переработки кислоты переходят из сырья, они также ...Карбоновые кислоты в природе, химические свойства, применение
План конференции:. 1. «мозговой штурм» 2. Блицопрос 3.Презентация (часть1): номенклатура, строение, классификация 4. Пресс-конференция 5. Презентация ...Неорганические соединения
Цель: Повторить и обобщить знания, умения и навыки по данной теме. Фронтальный опрос. Что такое степень окисления? Какие соединения называются бинарными? ...Неорганические соединения - формулы и реакции
Цели урока. В игровой форме обобщить и закрепить знания о химических свойствах основных классов неорганических соединений и их взаимопревращениях. ...Карбоновые кислоты и их производные
Функциональные производные карбоновых кислот. Образование сложных эфиров R'–COOR":. Реакция образования сложного эфира из кислоты и спирта называется ...Карбоновые кислоты 4
Строение. Карбоновые кислоты – это вещества, содержащие в молекуле одну или несколько карбоксильных групп. Карбоксильная группа – группа атомов Состав ...Неорганические кислоты
Кислотный остаток. Задание классу. Прослушайте аудиозапись определения кислот. Ответьте на вопросы:. 1.В данном ряду найдите формулу кислоты. Поясните. ...Конспекты
Кислородсодержащие органические соединения
Е.А.Кудравец, учитель химии. МОУ гимназии № 32. . Дидактическая разработка урока. . Тема:. «Кислородосодержащие органические соединения». ...Кислородсодержащие органические соединения. Предельные одноатомные спирты
Государственное общеобразовательное учреждение -. средняя общеобразовательная школа. при Посольстве России в Турции. Конспект урока по химии ...Кислородсодержащие органические соединения и их природные источники
ПЛАН-КОНСПЕКТ УРОКА. «Химические свойства спиртов». . ФИО (полностью). . Хочуева Фатима Заурбековна. . . . Место работы. . ...Кислородсодержащие органические соединения. Спирты
Тема:. Кислородсодержащие органические соединения. Спирты. Цель:. изучение нового класса органических веществ «Спирты», формирование знаний о ...Кислородсодержащие органические соединения
Модульное изучение темы «. Кислородсодержащие органические соединения. ».10 класс. Цель:. создание условий для выявления учащимися взаимосвязи между ...Кислородсодержащие органические соединения. Спирты и фенолы
Шайтанова Екатерина Игоревна. Преподаватель химии и биологии. Николаевский-на-Амуре филиал. коренных малочисленных народов Севера. краевого государственного ...Азотсодержащие органические соединения и их нахождение в живой природе
Рекомендации по изучению темы. «Азотсодержащие органические соединения и их нахождение в живой природе». . . 1. . Амины. . Понятие об ...Азотосодержащие органические соединения
4. . . Урок разработала Серебрянская Нелля Александровна,. учитель химии МОУ «Образцовская СОШ». Фроловского муниципального района. Волгоградской ...Химический состав клеток. Неорганические соединения клетки
Урок на тему. «Химический состав клеток. Неорганические соединения клетки». Цели урока:. Расширение и углубление знаний учащихся о роли металлов ...Кислородосодержащие органические соединения
Конспект урока химии 10 класс по теме. . Кислородосодержащие органические соединения. Файрушина Зифа Рустямовна. Учитель химии МБОУ СОШ с. Калтыманово, ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:25 января 2019
Категория:Химия
Содержит:45 слайд(ов)
Поделись с друзьями:
Скачать презентацию




















































CH3CHO + H2O CH3COOH +4[H] (кат) CH3CH2OH+H2O 2. Реакции замещения: СН3СООН + CL2(PCL5) CH2CL-COOH +HCL 3. Реакция этерификации: СH3-COOH + CH3OH CH3-COOCH3 + H2O 4. Образование хлорангидридов Специфические свойства карбоновых кислот: Восстанавливаются до альдегидов и спиртов: CH3COOH +2[H](кат)CH3CHO + H2O CH3COOH +4[H] (кат) CH3CH2OH+H2O 2. Реакции замещения: СН3СООН + CL2(PCL5) CH2CL-COOH +HCL 3. Реакция этерификации: СH3-COOH + CH3OH CH3-COOCH3 + H2O 4. Образование хлорангидридов](https://prezentacii.org/upload/cloud/19/01/119653/images/thumbs/screen8.jpg)

![Специфические свойства муравьиной кислоты: По карбонильной группе А) реакция серебряного зеркала. HCOOH+2[Ag(NH3)2]OH 2Ag+CO2+H2O+4NH3 Б) реакция с гидроксидом меди (II). HCOOH+2Cu(OH)2 CO2+Cu2O+H2O 2. разложение: HCOOH(H2SO4k)CO+H2O 3. Окисление хлором: HCOOH + CL2 CO2 + 2HCL. Кстати: Английски Специфические свойства муравьиной кислоты: По карбонильной группе А) реакция серебряного зеркала. HCOOH+2[Ag(NH3)2]OH 2Ag+CO2+H2O+4NH3 Б) реакция с гидроксидом меди (II). HCOOH+2Cu(OH)2 CO2+Cu2O+H2O 2. разложение: HCOOH(H2SO4k)CO+H2O 3. Окисление хлором: HCOOH + CL2 CO2 + 2HCL. Кстати: Английски](https://prezentacii.org/upload/cloud/19/01/119653/images/thumbs/screen10.jpg)
![Получение: Окисление альдегидов и первичных спиртов: CH3CHO + [O]CH3COOH CH3CH2-OH+ [O] CH3COOH 2. Гидролиз галогенозамещенных углеводородов, содержащих три атома галогена у одного атома углерода: СH3-CCL3 + 3NaOHCH3-COOH +3NaCL 3. Гидролиз сложных эфиров : R-COOR1+H2ORCOOH+ROH 4. Гидролиз ангид Получение: Окисление альдегидов и первичных спиртов: CH3CHO + [O]CH3COOH CH3CH2-OH+ [O] CH3COOH 2. Гидролиз галогенозамещенных углеводородов, содержащих три атома галогена у одного атома углерода: СH3-CCL3 + 3NaOHCH3-COOH +3NaCL 3. Гидролиз сложных эфиров : R-COOR1+H2ORCOOH+ROH 4. Гидролиз ангид](https://prezentacii.org/upload/cloud/19/01/119653/images/thumbs/screen11.jpg)
































































