Презентация "Неорганические соединения - формулы и реакции" по химии – проект, доклад
Презентацию на тему "Неорганические соединения - формулы и реакции" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 15 слайд(ов).
Слайды презентации
Список похожих презентаций
Неорганические соединения
Цель: Повторить и обобщить знания, умения и навыки по данной теме. Фронтальный опрос. Что такое степень окисления? Какие соединения называются бинарными? ...Химический состав клетки. Неорганические соединения
Что же до первоначал, то они еще больше имеют Средств для того, чтоб из них возникали различные вещи, Нет ни одной из вещей, доступных для нашего ...Керамики - неорганические соединения
Еще Глейтером в 1981 году был введен термин «нанокристаллические» материалы, позже стали использоваться такие термины как «наноструктурные», «нанофазные», ...Неорганические соединения. Периодическая таблица Д.И.Менделеева
Урок-конкурс по теме: «Неорганические соединения. Периодическая таблица Д.И.Менделеева». Цель: Закрепить полученные знания по основным классам неорганической ...Реакции соединения
Карточка № 1. Явления. 1. При нагревании вода превращается в пар (физическое) 2. При сильном измельчении кусочек мела превращается в белый порошок ...Окислительно – восстановительные реакции
Окислительно – восстановительные реакции. … – реакции, протекающие с изменением степени окисления элементов. Два антипода парою ходят, Первый – теряет; ...Бинарные соединения
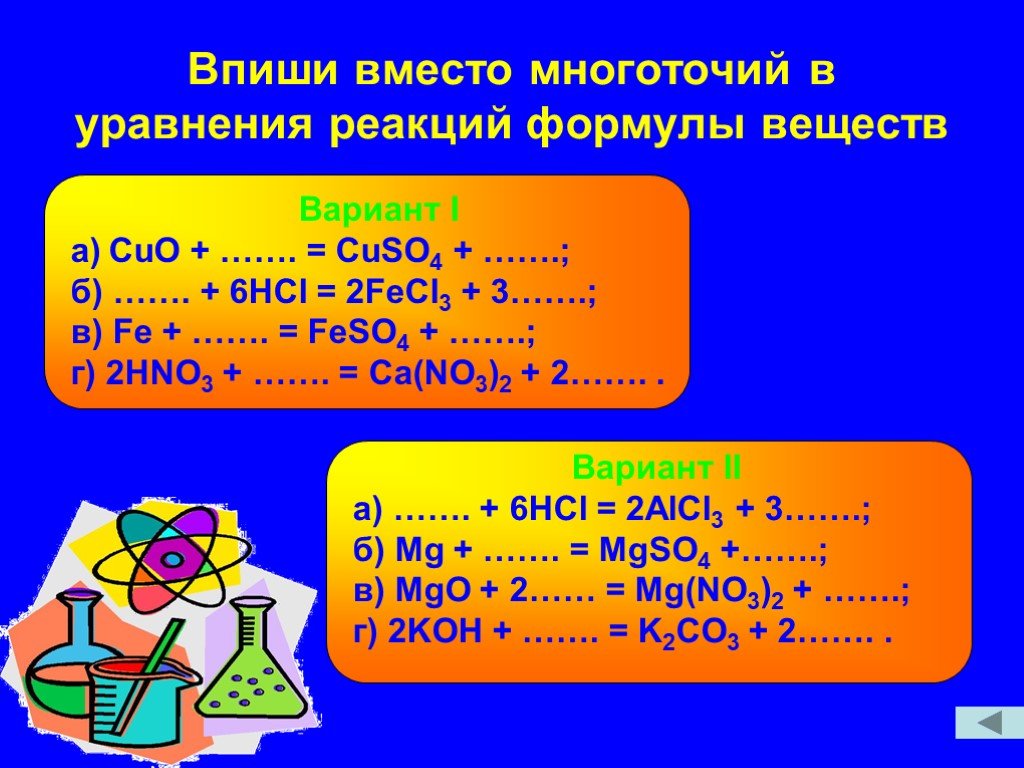
Классификация сложных веществ. Бинарные соединения – это вещества, состоящие из двух разных атомов. Как составить формулу бинарного соединения. Знать ...Химические реакции
Цели 1. Образовательная: Повторить основные свойства веществ. Повторить основные типы химических реакций. 2. Развивающая: Продолжать развитие наблюдательности ...Фосфор и его соединения
«Чудовище лежало перед нами… Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза обведены огненными кругами. Я ...Важнейшие соединения серы
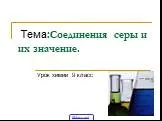
Сероводород выделяется в результате вулканической деятельности, при гниении белков животных и растений, при работе производств химической, текстильной, ...Основные соединения серы
Почему геохимик А.Е.Ферсман назвал серу «двигателем химической промышленности»? Цели урока:. Рассмотреть свойства важнейших соединений серы – сероводорода ...Важнейшие представители бинарных соединений – оксиды и летучие водородные соединения
Н2О - вода. СО2 углекислый газ. СУХОЙ ЛЁД. NH3 аммиак. HCL хлороводород. Бесцветный газ. Тяжелее воздуха. Хорошо растворяется в воде. Раствор хлороводорода ...Важнейшие соединения серы
Сероводород выделяется в результате вулканической деятельности, при гниении белков животных и растений, при работе производств химической, текстильной, ...Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения
SiO2 , H2O , CO2 , AI2O3 , Fe2O3 , CO. Всесильная стихия природы-вода во все времена, во все периоды истории покоряла ум и воображение людей. Человек ...Бинарные соединения
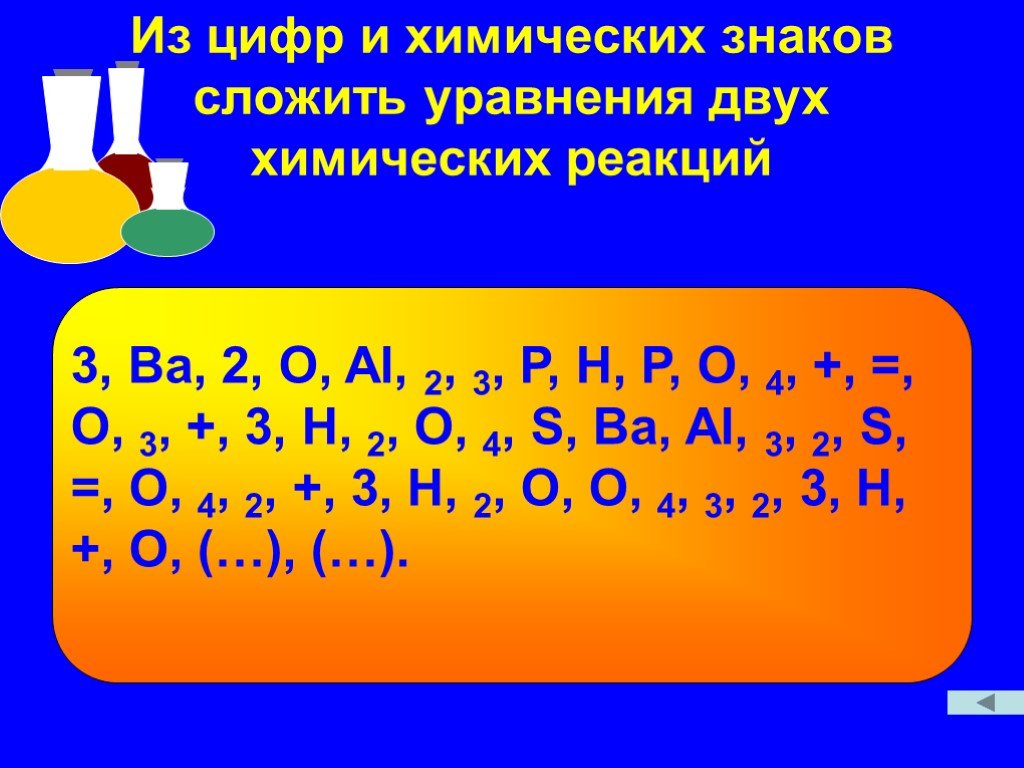
17.09.2018. Бинарные соединения: определение. Многообразие природных бинарных соединений. Вода Хлорид натрия Углекислый газ. Бинарные вещества состоят ...Бинарные соединения
ОПРЕДЕЛЕНИЕ. Бинарные соединения – это соединения, состоящие из двух химических элементов. H2O, NH3, K2S, P2O5, CaC2. Бинарные соединения - хлориды. ...Окислительно-восстановительные реакции
Цели и задачи:. Закрепить умения учащихся применять понятие «степень окисления» на практике. Обобщать и дополнять знания учащихся об опорных понятиях ...Влияние условий на скорость химической реакции
Заполните схему с вопросами о скорости реакции:. Задачи урока. Природа реагирующих веществ Концентрация реагирующих веществ Площадь реагирующих веществ ...Окислительно-восстановительные реакции
Понятие окислительно-восстановительных реакций. Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих ...Конспекты
Типы химических реакций. Реакции разложения, соединения, замещения
Разработка урока:. «Типы химических реакций. . . Реакции разложения, соединения, замещения». . Разработала:. . учитель химии. ...Химический состав клеток. Неорганические соединения клетки
Урок на тему. «Химический состав клеток. Неорганические соединения клетки». Цели урока:. Расширение и углубление знаний учащихся о роли металлов ...Важнейшие d-элементы и их соединения
Среднесрочное планирование уроков химии. Раздел «. Важнейшие. d. -элементы и их соединения» 9 класс. Тема и цель урока. Ожидаемые результаты ...Свойства ионов. Качественные реакции на катионы и анионы
Сидорина Г. Н. , учитель химии. . Г У. Средняя общеобразовательная школа. N. 0. 5, г. Актау. . . Тема урока: «Свойства ионов. Качественные ...Скорость химической реакции (А20)
Конспект урока на тему «Скорость химической реакции(А20)». 1.При комнатной температуре с наибольшей скоростью протекает реакция между1) Zn и НС1 ...Окислительно-восстановительные реакции
Урок по химии на тему «Окислительно-восстановительные реакции». . в 11 классе. Материал подготовила. Дудник Светлана Евгеньевна,. учитель ...Решение задач на определение выхода продукта реакции
Тема урока: Решение задач на определение выхода продукта реакции. Алгоритм решения задач. Составьте краткое условие задачи. . Составьте ...Химические реакции
8 класс. Урок по теме «Химические реакции». Цель:. обобщить и систематизировать знания по теме «Химические реакции». Задачи: 1) образовательная:. ...Окислительно - восстановительные реакции
Фалинская Наталья Васильевна. Учитель высшей категории химии и биологии. Кушокинксая СОШ Бухаржырауского района Карагандинской области. 8 ...урок Горение простых и сложных веществ. Тепловой эффект реакции
. Горение простых и сложных веществ. . . Тепловой эффект химической реакции.(8 класс). Учитель химии. Вохмякова Татьяна ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:24 июня 2018
Категория:Химия
Содержит:15 слайд(ов)
Поделись с друзьями:
Скачать презентацию