Презентация "Окислительно-восстановительные реакции" (1 класс) по химии – проект, доклад
Презентацию на тему "Окислительно-восстановительные реакции" (1 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 19 слайд(ов).
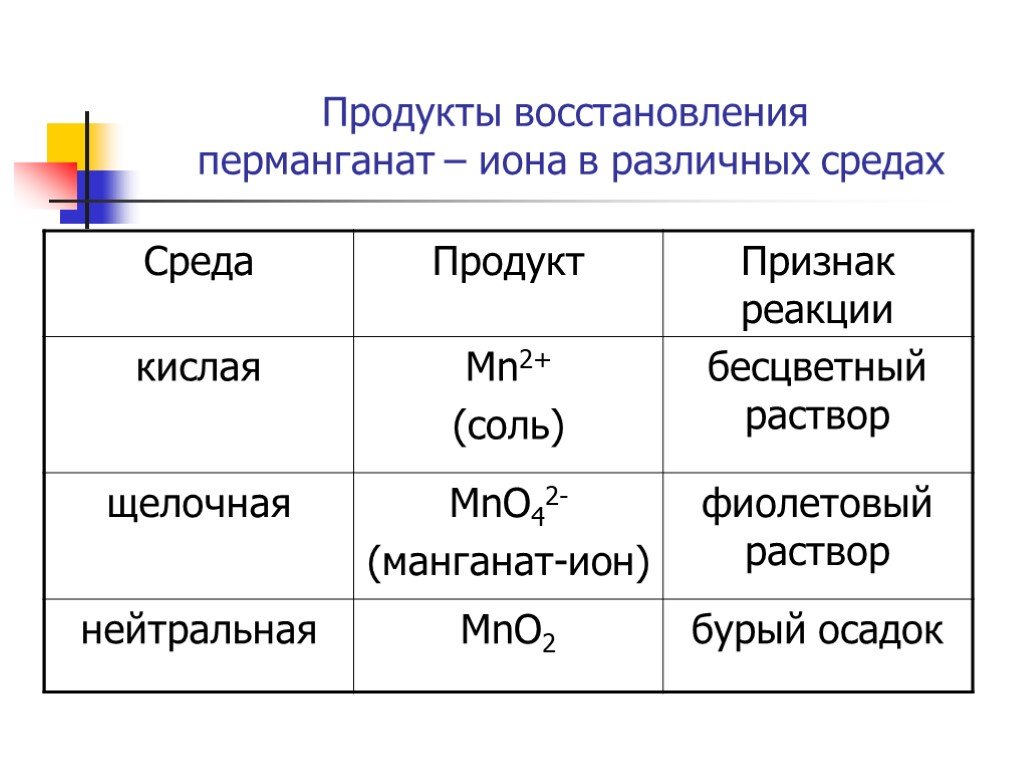
Слайды презентации
Список похожих презентаций
Окислительно-восстановительные реакции: общие сведения
Классификация реакций. Неокислительно-восстановительные реакции Ag +1Cl -1+Na +12S -2 = Ag +12S -2+Na +1Cl-1. Окислительно-восстановительные реакции ...Окислительно-восстановительные реакции.Электролиз
Окислительно-восстановительными называют реакции, протекающие с изменением степеней окисления элементов, образующих вещества, участвующие в реакции. ...Окислительно-восстановительные реакции
Классификация реакций. Неокислительно-восстановительные реакции Ag +1Cl -1+Na +12S -2 = Ag +12S -2+Na +1Cl-1. Окислительно-восстановительные реакции ...Окислительно-восстановительные реакции (ОВР) или «Кто-то теряет, кто-то находит»
Входной контроль. 1 вариант 1 - Г 2 - А 3 – Г 4 – А 5) А- 1 Б- 3 В- 3 Г- 4. 2 вариант 1 – В 2 – В 3 – Г 4 – А 5) А- 2 Б- 3 В- 1 Г- 4. Лабораторная ...Окислительно-восстановительные реакции
Окислительно-восстановительные реакции. Студент должен:. Знать: Основные положения теории окислительно-восстанови-тельных реакций Уметь: Составлять ...Окислительно-восстановительные реакции
Цель урока:. Закрепление, обобщение и углубление знаний об окислительно-восстановительных реакциях, расстановка коэффициентов методом электронного ...Некоторые Окислительно-восстановительные реакции алкенов
Правила составления ОВР. Взаимодействия алкенов с водным раствором KMnO4 (реакция Вагнера). При взаимодействии алкенов с водным раствором KMnO4 происходит ...Окислительно-восстановительные реакции
Цели и задачи:. Закрепить умения учащихся применять понятие «степень окисления» на практике. Обобщать и дополнять знания учащихся об опорных понятиях ...Окислительно-восстановительные реакции
Окислительно-восстановительные реакции (ОВР) -. – химические реакции, в которых происходит изменение степеней окисления атомов, входящих в состав ...Качественные реакции в органической химии
Алканы. Качественная реакция на алканы: Определить, что какое-то вещество в смеси или в чистом виде алкан, несложно. Для этого газ либо поджигают ...Химические реакции
Аннотация. Данная презентация может быть использована при изучении химии на 1 курсе по программе НПО по при изучении темы «Химические реакции». В ...Скорость химической реакции
Скорость гомогенной и гетерогенной реакций. Изменение концентрации вещества по мере протекания реакции. Диаграмма изменения внутренней энергии веществ ...Окислительно - восстановленные реакции
Окислительно-восстановительные реакции (ОВР) – реакции, сопровождающиеся изменением степени окисления элементов (атомов). Степень окисления (СО) – ...Реакции обмена в водных растворах электролитов. Ионные реакции и уравнения
Ионные реакции – реакции протекающие между ионами в растворе. Порядок составления ионных уравнений реакции. 1. Записывают молекулярное уравнение реакции ...Влияние условий на скорость химической реакции
Заполните схему с вопросами о скорости реакции:. Задачи урока. Природа реагирующих веществ Концентрация реагирующих веществ Площадь реагирующих веществ ...окислительно- восстановительные реакции
Al2O3 x 3·(-2) + 2·x = 0 - 6 + 2·x = 0 2·x = 6 X = 3. Сумма степеней окисления химических элементов в соединении равна 0. + 3. Сu О + 2 HCl → CuCl2 ...Окислительно восстановительные реакции сущность
Цели урока: Образовательная цель: Знать сущность степени окисления, окислительно-восстановительных процессов, происходящих с веществами, изменение ...Окислительно – восстановительные реакции
Окислительно – восстановительные реакции. … – реакции, протекающие с изменением степени окисления элементов. Два антипода парою ходят, Первый – теряет; ...Окислительно – восстановительные реакции
Результат теста. Верно: 15 Ошибки: 0 Отметка: 5. Время: 1 мин. 0 сек. ещё. Вопрос 1 В). +6 А). +4 Б). +5 Г). +7. Задание теста с единственным правильным ...Окислительно – восстановительные реакции
Пример: 2Cu0 + O2 =2 Cu2+O2- 2H+CL- + Zn0 = Zn2+CL2- + H20. Реакции, протекающие с изменением степеней окисления атомов всех или некоторых элементов, ...Конспекты
Окислительно-восстановительные реакции
Санкт-Петербургское государственное автономное. профессиональное образовательное учереждение. « морской технический колледж». Методические ...Окислительно-восстановительные реакции
Урок по химии на тему «Окислительно-восстановительные реакции». . в 11 классе. Материал подготовила. Дудник Светлана Евгеньевна,. учитель ...Окислительно-восстановительные реакции
Анализ урока. Учитель. Гордова Марина Алексеевна. Класс. 9. . Предмет. химия. Тема урока. Окислительно-восстановительные реакции. Единица ...Степень окисления. Окислительно-восстановительные реакции
Казахстан, Северо-Казахстанская область, район имени Габита Мусрепова, село Сокологоровка. КГУ «Сокологоровская средняя школа». ...Окислительно-восстановительные реакции
. Подробный конспект урока. Организационная информация. Тема урока. . Окислительно- восстановительные реакции. . . Предмет. . ...Именные реакции в органической химии
Урок обобщения: "Именные реакции в органической химии" 10 класс. Максимова И.Н. учитель химии и биологии. . МБОУ «Среднекибечская СОШ» Канашского ...Цветные реакции на белки
ЛАБОРАТОРНАЯ РАБОТА. . Цветные реакции на белки. тип урока:. Урок-практикум. Цель:. . Закрепить и применить знания по теме "Цветные реакции ...Химические реакции
8 класс. Урок по теме «Химические реакции». Цель:. обобщить и систематизировать знания по теме «Химические реакции». Задачи: 1) образовательная:. ...Химические реакции
Практическое занятие №2 «Примеры проектов уроков с использованием интерактивного оборудования и Интернет-ресурсов». Проект урока химии урока в ...Характерные реакции глюкозы
Характерные реакции глюкозы. Номер учебного элемента. Учебный материал с указанием заданий. . Руководство по усвоению учебного материала. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:25 октября 2018
Категория:Химия
Классы:
Содержит:19 слайд(ов)
Поделись с друзьями:
Скачать презентацию