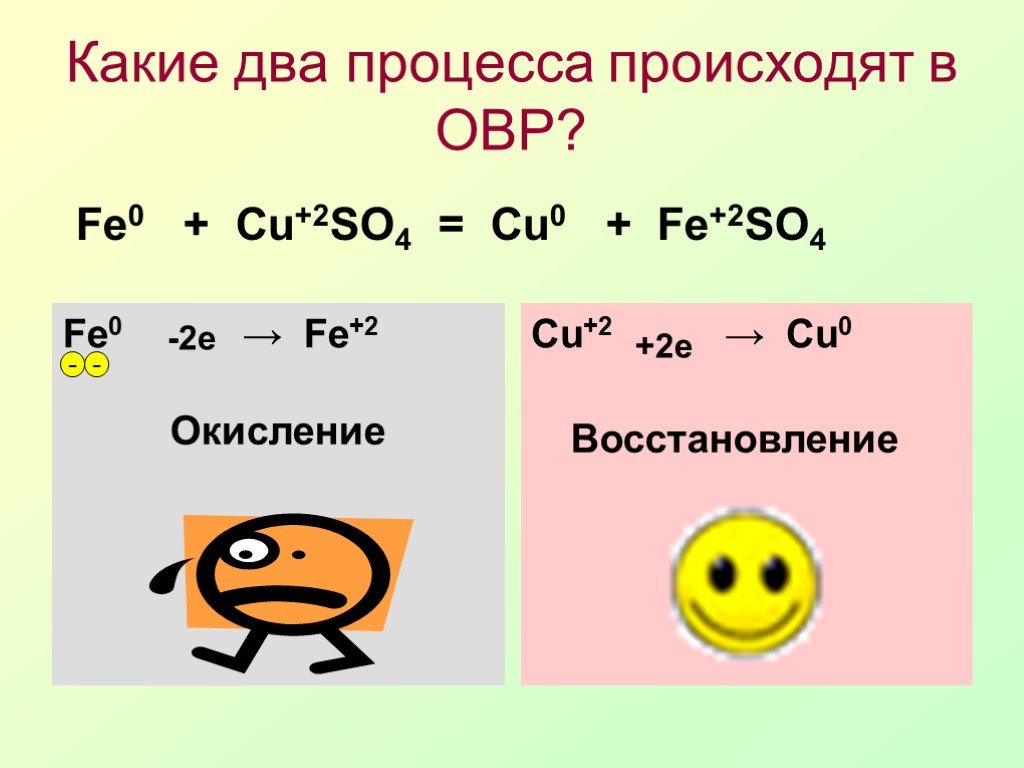
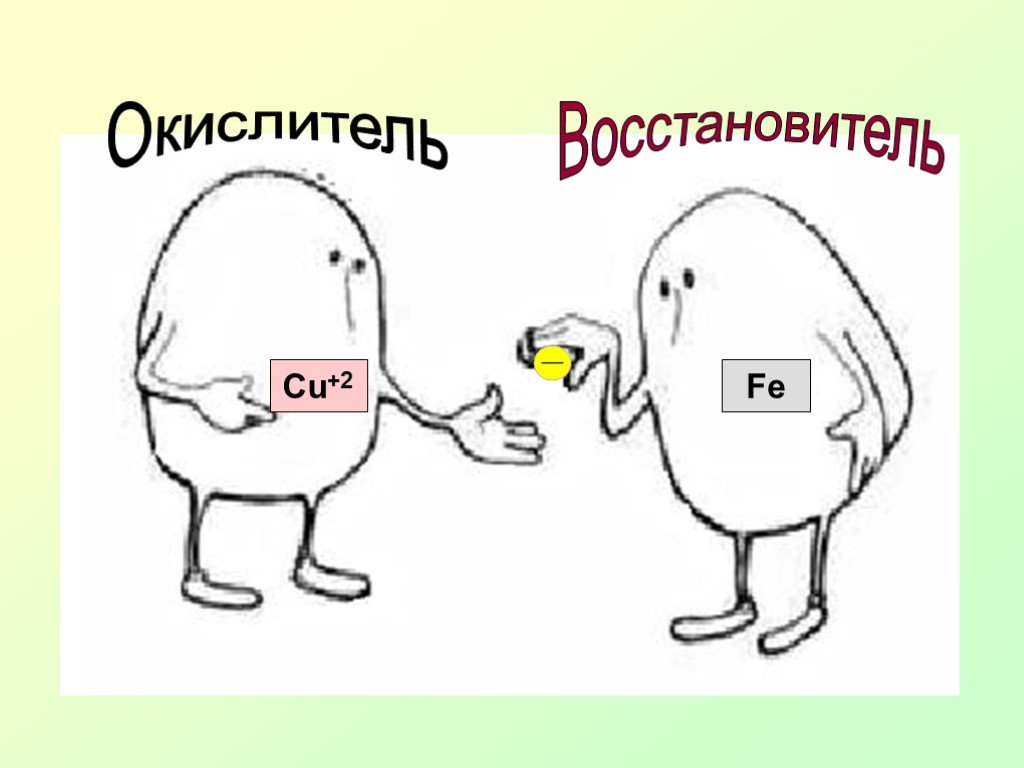
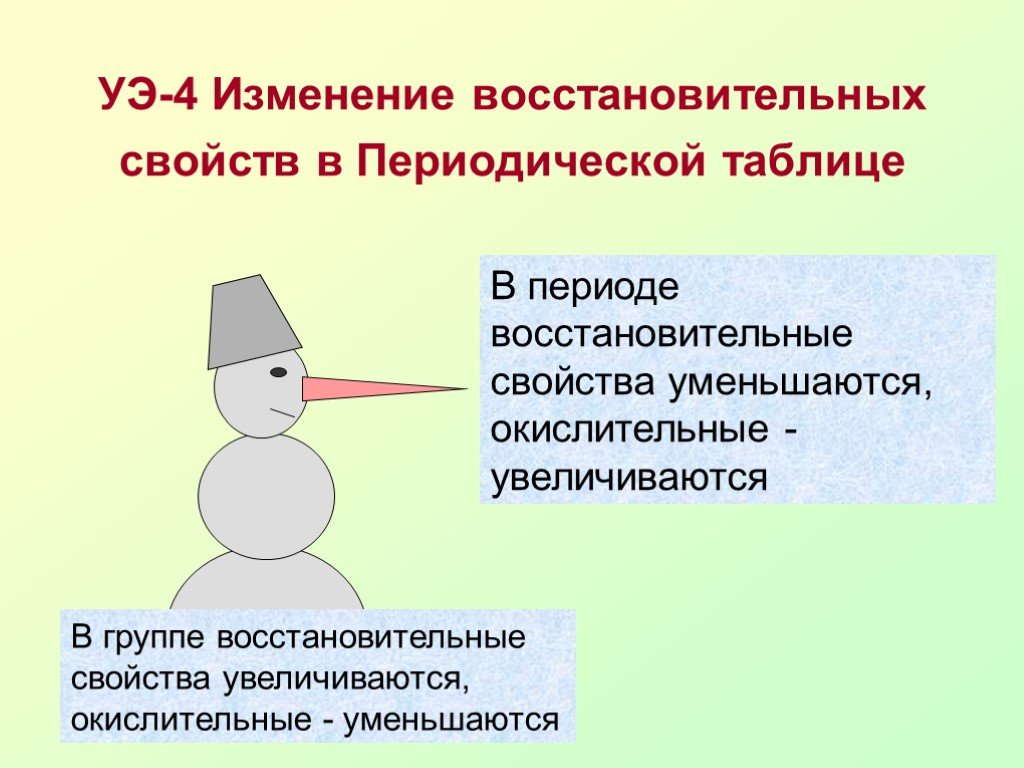
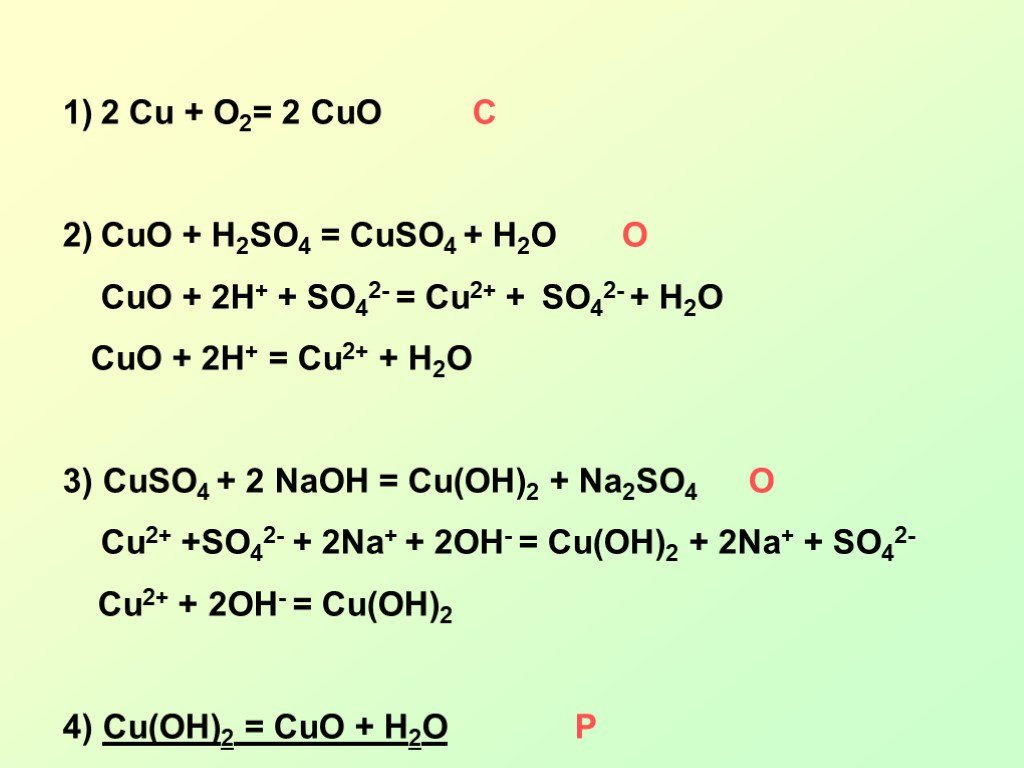
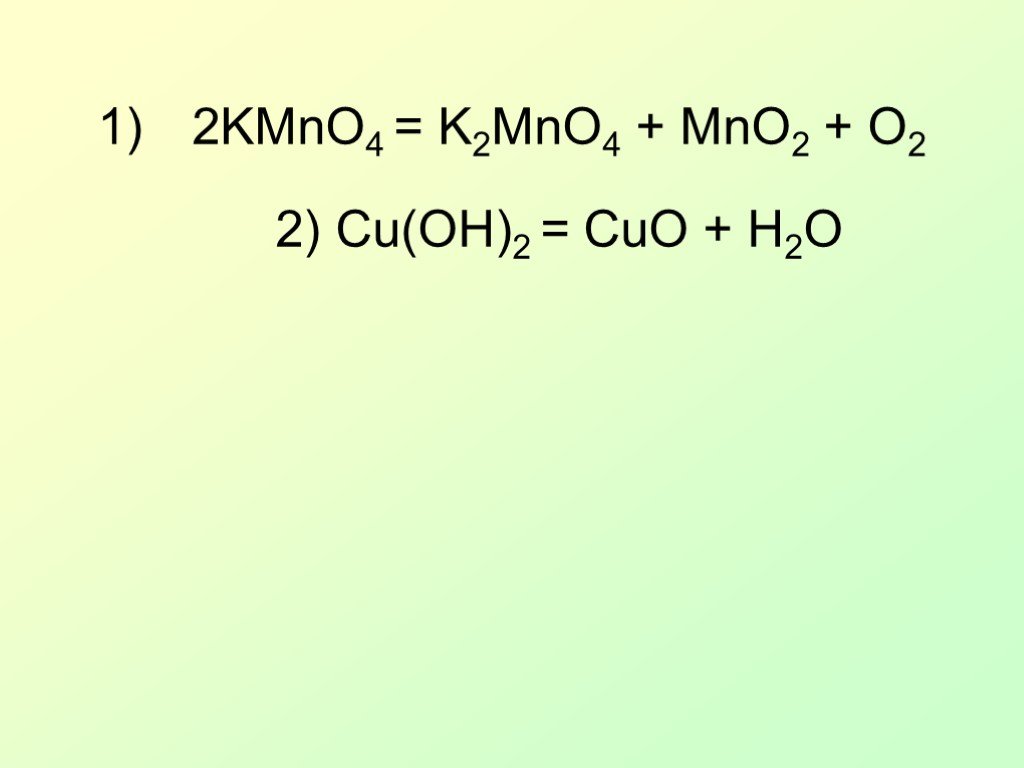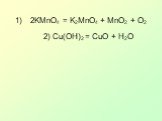Презентация "Окислительно-восстановительные реакции (ОВР) или «Кто-то теряет, кто-то находит»" по химии – проект, доклад
Презентацию на тему "Окислительно-восстановительные реакции (ОВР) или «Кто-то теряет, кто-то находит»" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 22 слайд(ов).
Слайды презентации
Список похожих презентаций
Химические реакции
План урока. 1. Физические и химические явления. 2. Признаки химических реакций. 3. Условия протекания реакций. 4. Значение химических реакций. Как ...Химия в рисунках или эта удивительная химия
Цели: Воспитывать и развивать у учащихся стремление к самоопределению и самореализации. Задачи: Выявить творческих, инициативных учащихся; Активизировать ...Углеводы или сахариды
C (H O) n m. n=m углеводы. В животных : 1 - 5% В растительных: 90%. СОДЕРЖАНИЕ УГЛЕВОДОВ В КЛЕТКАХ:. УГЛЕВОДЫ ПРОСТЫЕ СЛОЖНЫЕ МОНОСАХАРИДЫ. n =3-триозы ...Химические реакции
Цели 1. Образовательная: Повторить основные свойства веществ. Повторить основные типы химических реакций. 2. Развивающая: Продолжать развитие наблюдательности ...Серелогические реакции
Серологические реакции – это реакции между антигенами и антителами in vitro . Цели применения: серодиагностика бактериальных и вирусных инфекционных ...Качественные реакции в органической химии
Алканы. Качественная реакция на алканы: Определить, что какое-то вещество в смеси или в чистом виде алкан, несложно. Для этого газ либо поджигают ...Почему протекают химические реакции
Первый закон термодинамики – закон сохранения энергии. Энергия не возникает из ничего и не исчезает бесследно, а только переходит из одной формы в ...Жевательная резинка: польза или вред?
Актуальность исследования заключается в том, что множество людей, большинство из которых дети, употребляют жевательную резинку. Цель работы: изучение ...Изучение реакции среды в зависимости от типа гидролиза соли
Лабораторная работа Изучение реакции среды в зависимости от типа гидролиза соли. Цели: понять сущность гидролиза. научиться определять реакцию и тип ...Есть ли сахар в банке с медом? или Определение качественного состава меда
"Мед - категория нравственная, но в ряду других вечных ценностей, вместе с золотом, серебром, алмазами, янтарем, розовым маслом, мед тоже есть эталон ...Дидактические игровые задания для уроков закрепления и повторения или для обобщающего повторения в 8 классе
Дайте название данному процессу Определите тип этой реакции Каково условие проведения данной реакции. Проверьте уравнение реакции: 2Al + 3FeO = Al2O3 ...Дефицит пресной воды. Миф или реальность?
Проблема. Как сохранить имеющиеся запасы пресной воды? Что для этого должен делать каждый житель планеты? Гипотеза. Исчезнет вода – исчезнет жизнь ...Энергия химической реакции
Основные понятия термодинамики. ТЕРМОДИНАМИКА (ТД) – это наука о взаимных превращениях различных видов энергии. Химическая термодинамика изучает:. ...Качественные реакции на ионы металлов
Проблемный вопрос: каким образом можно определить ионы металлов в растворах. Цель работы: научиться определять ионы металлов Задачи: расширить знания ...Почему протекают химические реакции
План урока. Закон сохранения массы и энергии. Тепловой эффект химической реакции. Экзотермические и эндотермические реакции. Термохимия. Законы термохимии. ...Мыло: польза или вред?
Гипотеза: мыло не всегда полезно…. Цель работы: выяснить - полезно ли мыло на самом деле? Содержание: Раздел 1. Производство мыла. а) В старину. б) ...Применение ацетилена. Химические реакции, лежащие в основе применения
Химические реакции, лежащие в основе применения ацетилена. Реакции получения и горения ацетилена CaC2 + 2H2O → Ca(OH)2 + C2H2 2C2H2 + 5O2 → 4CO2 +2H2O ...Мыло. Фабричное или ручной работы?
Посмотрите внимательно на состав того мыла, которым Вы привыкли пользоваться. Там будут, помимо собственно мыла, воды, глицерина, указаны синтетические ...Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Обсудим следующие вопросы:. Зачем нужны знания о скорости химических реакций? Какими примерами можно подтвердить то, что химические реакции протекают ...Конспекты
Вычисления по химическим уравнениям реакций массы, количества вещества или объема по известной массе, количеству вещества или объему одного из вступающих или получающихся в реакции веществ
Дата_____________ Класс_______________. Тема:. . Вычисления по химическим уравнениям реакций массы, количества вещества или объема по известной ...Химические реакции
Химические реакции. Цели урока:. Повторить отличия химических явлений от физических. . Познакомить с признаками и условиями течения химических ...Физические и химические явления. Химические реакции
Урок химии в 8 классе на тему. :. Физические и химические явления. Химические реакции. . . Савинская Татьяна Андреевна. учитель химии и биологии. ...Факторы, влияющие на скорость химической реакции
МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ. СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 81. Урок химии в 9 классе. ...Факторы, влияющие на скорость химической реакции
Конспект урока по химии в 9 классе. Щеголева Татьяна Александровна. ,. . учитель химии. . высшей категории. МАОУ «Средняя общеобразовательная ...Уравнения химической реакции
Уравнения химической реакции. Химия 8класс. Мастер-класс. Образовательные задачи:. Обучающие:. Сформировать понятие о химическом уравнении;. ...Скорость химической реакции (А20)
Конспект урока на тему «Скорость химической реакции(А20)». 1.При комнатной температуре с наибольшей скоростью протекает реакция между1) Zn и НС1 ...Чипсы: лакомство или яд?
Технологическая карта факультативного занятия. Предмет. ________химия_______________________________________________. Класс. _________5 «Б»_______________________________________________. ...Обобщение знаний об основных типах химической реакции
. /8 класс/. Тема урока:. Обобщение знаний об основных типах химических реакций. Цель:. Обобщить и закрепить знания о типах ...Обнаружение органических веществ в коровьем или козьем молоке
5. . Методическая разработка. . Учителя химии и биологии Серегиной Ларисы Валерьевны. Практическая работа. . «Обнаружение органических ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:8 февраля 2019
Категория:Химия
Содержит:22 слайд(ов)
Поделись с друзьями:
Скачать презентацию