Презентация "Почему протекают химические реакции" по химии – проект, доклад
Презентацию на тему "Почему протекают химические реакции" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 24 слайд(ов).
Слайды презентации
Список похожих презентаций
Почему протекают химические реакции
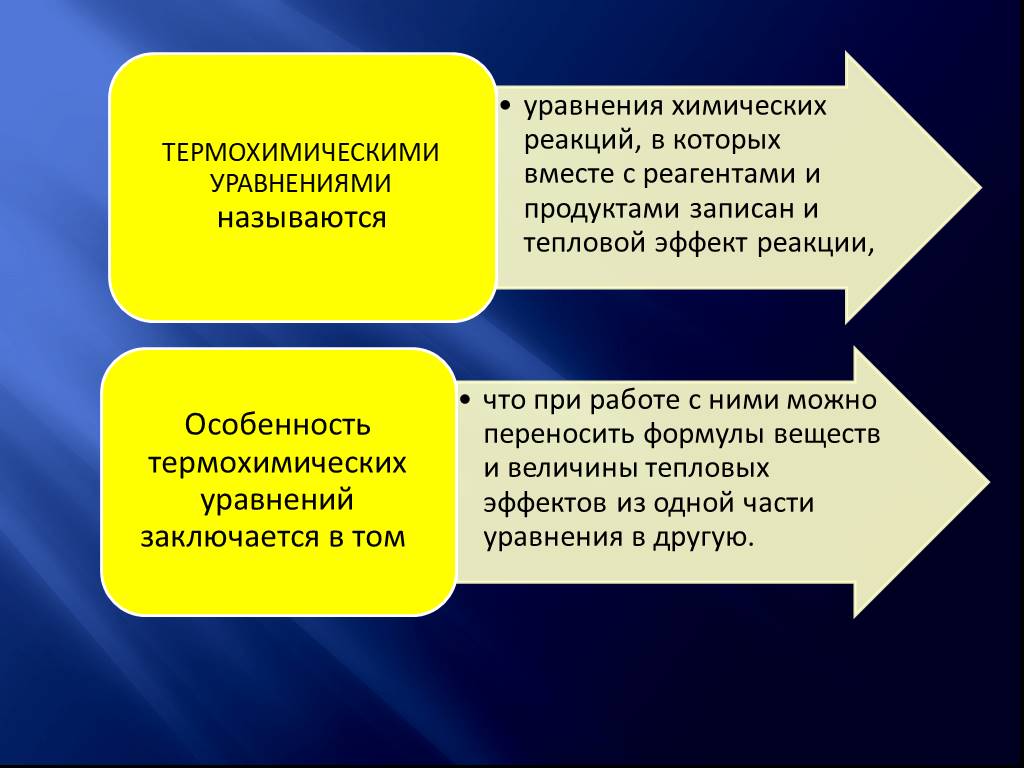
На бумаге можно написать уравнение любой химической реакции («бумага все стерпит»), а возможна ли такая реакция практически? В одних случаях (например, ...Почему протекают химические реакции
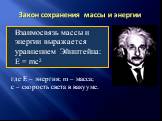
Первый закон термодинамики – закон сохранения энергии. Энергия не возникает из ничего и не исчезает бесследно, а только переходит из одной формы в ...Химические реакции
План урока. 1. Физические и химические явления. 2. Признаки химических реакций. 3. Условия протекания реакций. 4. Значение химических реакций. Как ...Химические реакции и явления, которые их сопровождают
Растет дерево Замерзает вода Ржавеет металл. Растворяется сахар в чае. Извергается вулкан. Скисает молоко. Тема урока: Физические и химические явления. ...Химические реакции в органической химии
Тест Напиши формулы углеводородов:. 1. Бутан 6. Метан 2. Этан 7. Гексан 3. Нонан 8. Декан 4. Гептан 9. Октан 5. Пропан 10. Пентан. Реакции горения:. ...Химические реакции
Цели 1. Образовательная: Повторить основные свойства веществ. Повторить основные типы химических реакций. 2. Развивающая: Продолжать развитие наблюдательности ...Химические реакции
Типы химических реакций. По числу вступивших в реакцию веществ По тепловому эффекту По обратимости По изменению степени окисления По агрегатному состоянию ...Химические реакции
Оглавление:. ВВЕДЕНИЕ КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ: По числу и составу реагирующих веществ По изменению степеней окисления химических элементов ...Химические реакции
Аннотация. Данная презентация может быть использована при изучении химии на 1 курсе по программе НПО по при изучении темы «Химические реакции». В ...Химические реакции
Химические реакции. Химический диктант. 1.почернение медной пластинки при нагревании, 2.плавление металла 3.Кипение воды 4.выделение пузырьков газа ...Применение ацетилена. Химические реакции, лежащие в основе применения
Химические реакции, лежащие в основе применения ацетилена. Реакции получения и горения ацетилена CaC2 + 2H2O → Ca(OH)2 + C2H2 2C2H2 + 5O2 → 4CO2 +2H2O ...Химические реакции
Разминка. НСl Н2SО4 НNО3 Н3РО4 СаСl2 Н2SiО3 Мg(NO3)2 НI К3РО4 НNO2 Cu(OH)2. Серная кислота Соляная кислота Азотная кислота. Ортофосфорная кислота. ...Окислительно – восстановительные реакции
Результат теста. Верно: 15 Ошибки: 0 Отметка: 5. Время: 1 мин. 0 сек. ещё. Вопрос 1 В). +6 А). +4 Б). +5 Г). +7. Задание теста с единственным правильным ...Какие химические явления происходят вокруг нас?
Задачи проекта:. Расширить знания о строении вещества. Дать представление о химических явлениях. Продолжить формирование общих умений коммуникаций. ...Алюминий – металл ХХ века. Физические и химические свойства
Алюминий. Алюминий вы найдете В ложке, кружке, самолете. Нужен легонький металл, Чтобы самолет летал! Самолет парит легко, Небосвод пронзает синий, ...Физические и химические явления
1. Что происходит с водой на морозе? 2. Что происходит при ее нагревании? 3. Что происходит, если оставить железный предмет в сыром месте? В окружающем ...Физические и химические явления. Химические уравнения
Содержание. 1. Химические и физические явления 2. Признаки протекания химических реакций 3. Условия протекания химических реакций 4. Закон сохранения ...Урок –игра «Звездный час» - Первоначальные химические понятия
Цель урока:. обобщить и проконтролировать уровень усвоения учащимися знаний основных первоначальных химических понятий. Учащиеся должны знать знаки ...Физические и химические свойства воды
Цели урока:. Изучить химические свойства воды. Начать формировать представления о важнейших классах неорганических соединений: кислотах и основаниях. ...Сера. Ее физические и химические свойства
«В древней магии присутствую при рождении огня, называют серой издавна меня". 1вариант –О2 2вариант-О3. Газ без запаха Проявляет окислительные и восстановительные ...Конспекты
Химические реакции
Министерство общего и профессионального образования Свердловской области. Муниципальное общеобразовательное учреждение. «Средняя общеобразовательная ...Химические реакции
«Химическое путешествие. Обобщение знаний учащихся по теме «Химические реакции»». Задачи урока. Образовательные:. повторить и обобщить знания ...Химические реакции
8 класс. Урок по теме «Химические реакции». Цель:. обобщить и систематизировать знания по теме «Химические реакции». Задачи: 1) образовательная:. ...Химические реакции
Химические реакции. Цели урока:. Повторить отличия химических явлений от физических. . Познакомить с признаками и условиями течения химических ...Физические и химические явления. Химические реакции
« Химия». Тема урока: «Физические и химические явления. Химические реакции». Предмет: Химия Класс :8. Занозина Елена Владимировна , учитель химии ...Химические реакции
Практическое занятие №2 «Примеры проектов уроков с использованием интерактивного оборудования и Интернет-ресурсов». Проект урока химии урока в ...Физические и химические явления. Химические реакции
Урок химии в 8 классе на тему. :. Физические и химические явления. Химические реакции. . . Савинская Татьяна Андреевна. учитель химии и биологии. ...Алюминий, его физические и химические свойства
. МБОУ «СОШ №3». г. Александровск, пгт. Яйва,. . Алюминий, его физические и химические свойства. . . Литвиненко ...Аммиак. Физические и химические свойства аммиака, получение, применение
Дата_____________ Класс_______________. Тема:. . Аммиак. Физические и химические свойства аммиака, получение, применение. Цели урока:. знать ...Физические и химические явления
Алексахина Елена Николаевна,. учитель химии и экологии. МОУ«Саловская . средняя общеобразовательная школа». Лямбирского муниципального района. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:22 марта 2019
Категория:Химия
Содержит:24 слайд(ов)
Поделись с друзьями:
Скачать презентацию