Слайд 1Чтобы начать работу, нажмите «Показ слайдов»
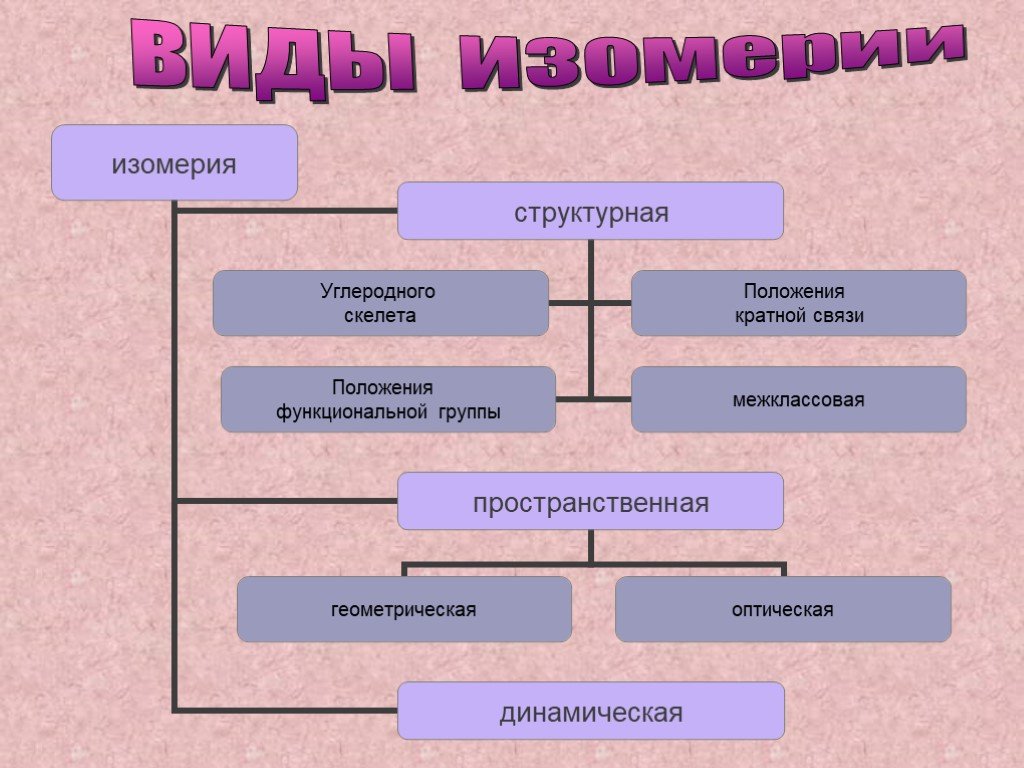
изомерия
Слайд 2- Это вещества одинакового состава и молекулярной массы, но имеющие различное строение молекул и разные свойства. - Это явление существования изомеров.
Главное: изомеры имеют одинаковые эмпирические формулы, но разные структурные формулы.
изомеры
Слайд 4Динамическая изомерия (таутомерия)
Таутомерия – достаточно распространенный вид изомерии в органической химии. Динамическая изомерия возможна в случае переноса подвижного атома водорода, при валентных превращениях, внутримолекулярных взаимодействиях и т.д. Для таутомеров характерно довольно легкое, иногда самопроизвольное, превращение друг в друга. Рассмотрим некоторые примеры таутомерии.
Слайд 5Кето – енольные превращения
То есть превращение непредельного спирта в кетон или альдегид. Например, такое превращение наблюдается в реакции Кучерова (гидратация алкинов в присутствии катализатора): СН ≡ СН + Н2О CН2 = СН – ОН СН3 – СНО этин этенол этаналь В данном случае наблюдается перенос подвижного атома водорода от кислорода к соседнему атому углерода. СН2 = СН – ОН СН3 – СН=О
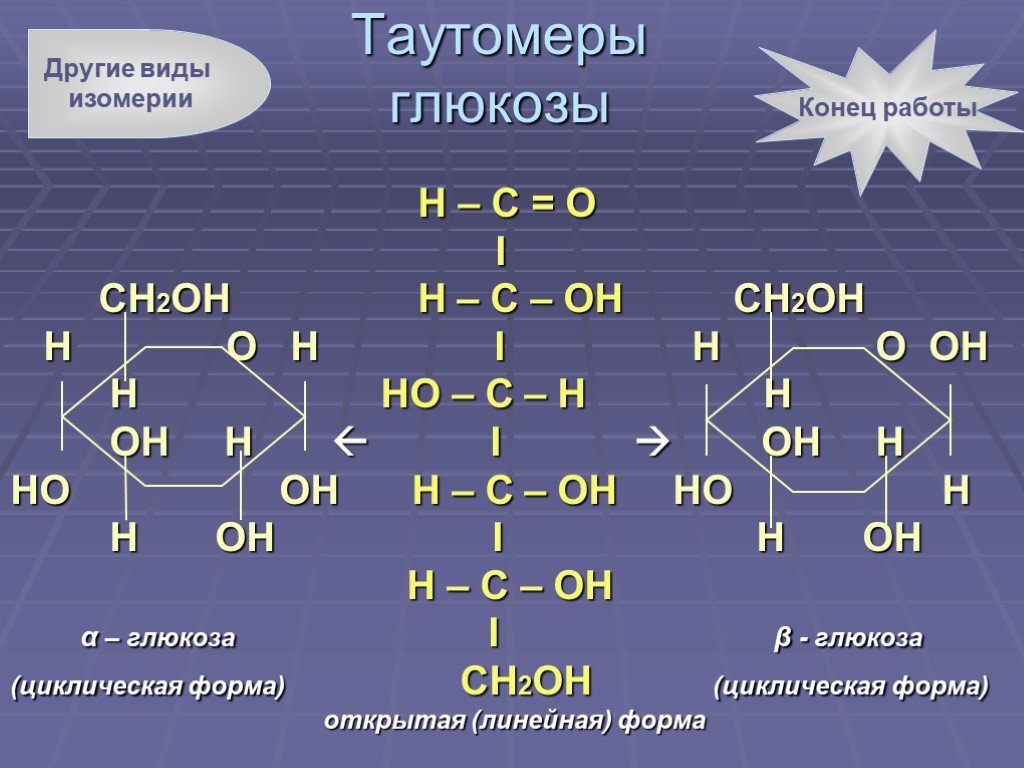
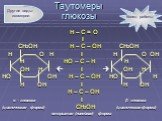
Слайд 6Н – С = О I CH2OH H – C – OH CH2OH H O H I H O OH H HO – C – H Н OH H I OH H HO OH H – C – OH HO H H OH I H OH H – C – OH α – глюкоза I β - глюкоза (циклическая форма) CH2OH (циклическая форма) открытая (линейная) форма
Таутомеры глюкозы
Другие виды изомерии
Конец работы
Слайд 7Геометрическая изомерия
Этот вид изомерии предполагает наличие двух изомеров: цис– и транс–. Геометрическая изомерия характерна для соединений, в которых : невозможно свободное вращение вокруг углерод – углеродной связи (например, алкены) эти атомы углерода связан с двумя различными группами. Рассмотрим геометрическую изомерию на примере бутена С4Н8.
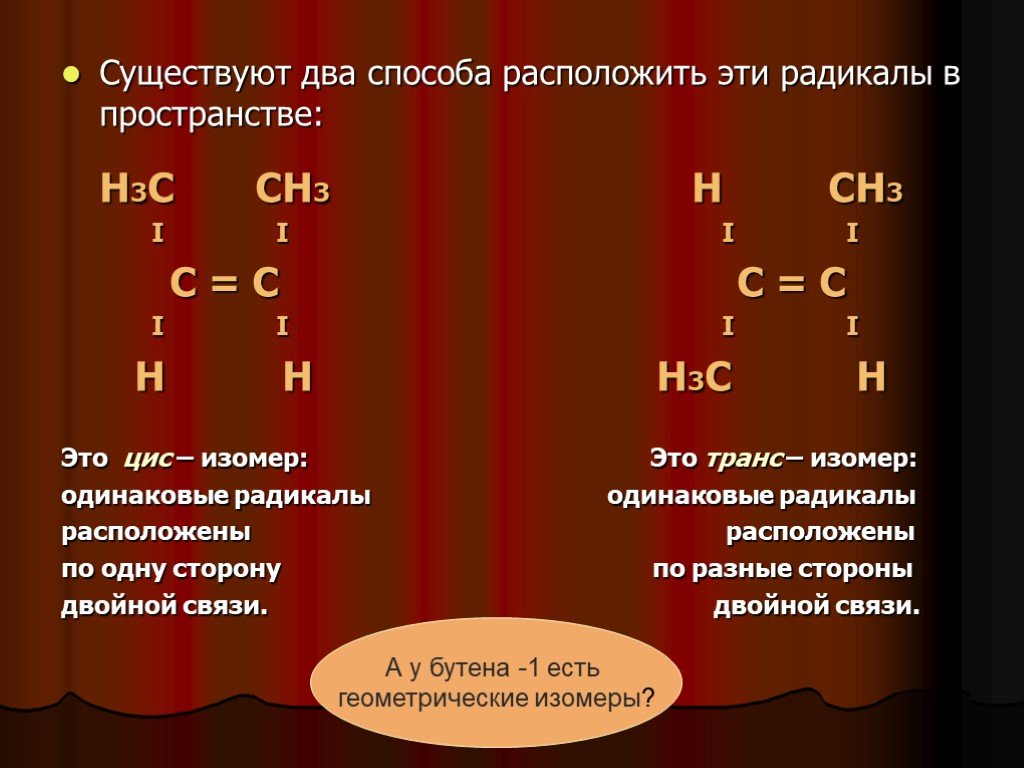
Слайд 8Напишем структурную формулу бутена – 2: СН3 – СН = СН – СН3 Вокруг двойной связи – С = С – свободное вращение невозможно, оба атома углерода связаны с различными группами: метилом СН3 – и водородом Н –.
Слайд 9Существуют два способа расположить эти радикалы в пространстве: Н3С СН3 Н СН3 I I I I С = С С = С I I I I Н Н Н3С Н Это цис – изомер: Это транс – изомер: одинаковые радикалы одинаковые радикалы расположены расположены по одну сторону по разные стороны двойной связи. двойной связи.
А у бутена -1 есть геометрические изомеры?
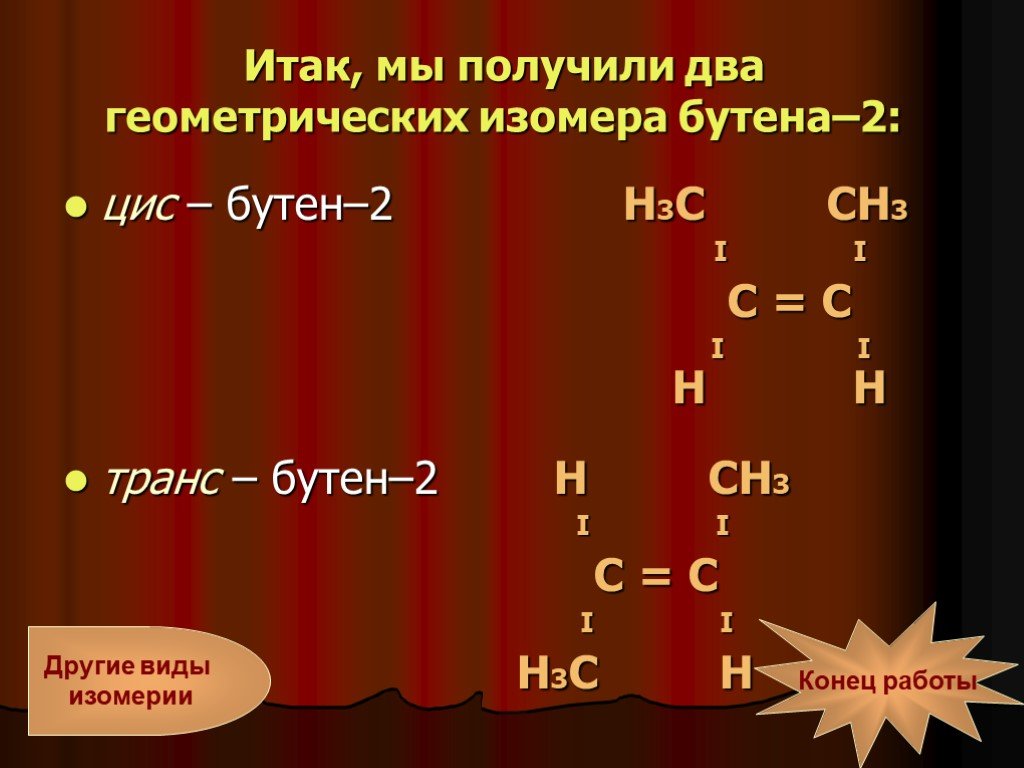
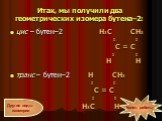
Слайд 10Итак, мы получили два геометрических изомера бутена–2:
цис – бутен–2 Н3С СН3 I I С = С I I Н Н транс – бутен–2 Н СН3 I I С = С I I Н3С Н
Слайд 11Нет. Геометрических изомеров бутена -1 не существует.
Но почему? Ведь для бутена -1 вращение вокруг двойной связи также невозможно, как для бутена -2.
Слайд 12Попробуем составить геометрические изомеры бутена -1: Н СН2 – СН3 Н Н I I I I С = С С = С I I I I Н Н Н3С – Н2С Н Как видите, эти структурные формулы изображают одно и то же вещество. (При наложении они совпадают, достаточно лишь повернуть вторую формулу). Итак, геометрических изомеров бутена -1 не существует.
А для других алкенов С4Н8, геометрические изомеры возможны?
Вернемся к объяснению.
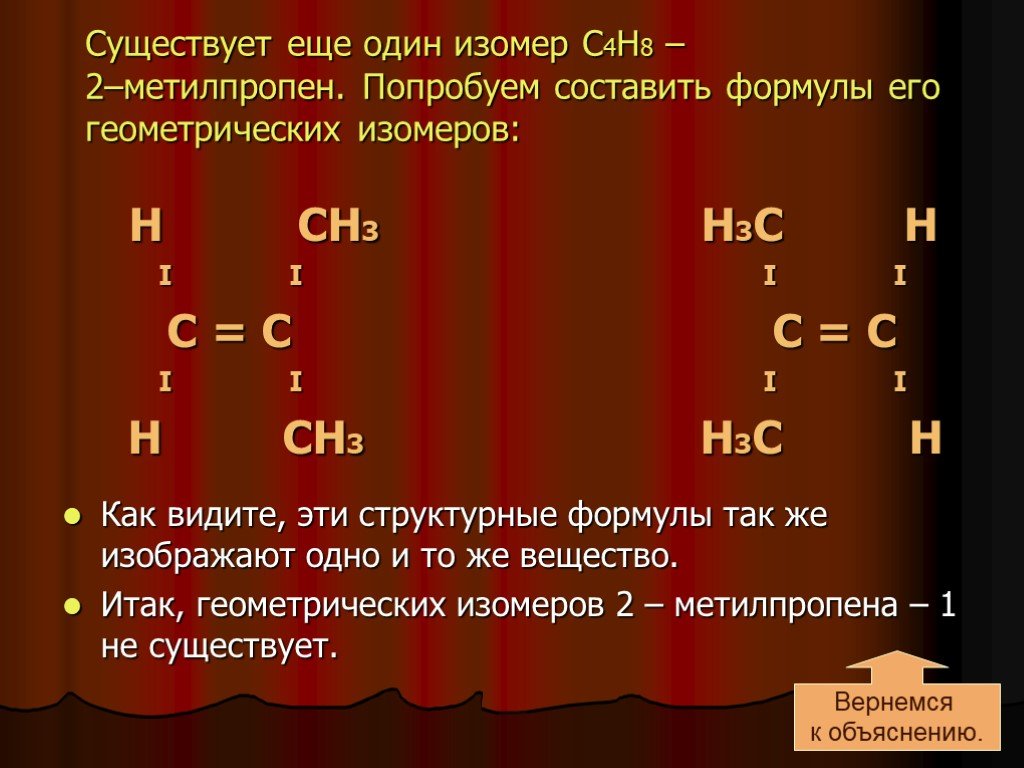
Слайд 13Существует еще один изомер С4Н8 – 2–метилпропен. Попробуем составить формулы его геометрических изомеров:
Н СН3 Н3С Н I I I I С = С С = С I I I I Н СН3 Н3С Н Как видите, эти структурные формулы так же изображают одно и то же вещество. Итак, геометрических изомеров 2 – метилпропена – 1 не существует.
Слайд 14Изомерия углеродного скелета
Этот вид изомерии характерен для всех классов органических соединений. Изомерия углеродного скелета – единственно возможный вид изомерии алканов. Рассмотрим изомерию углеродного скелета на примере пентана С5Н12
Слайд 15Составим структурную формулу простейшего изомера С5Н12, имеющего линейное строение. Для этого изобразим его углеродный скелет, расположив в ряд все пять атомов углерода: С – С – С – С – С А теперь расставим атомы водорода, не забывая при этом, что валентность углерода равна IV, а водорода - I: СН3 – СН2 – СН2 – СН2 – СН3 Мы написали структурную формулу простейшего изомера ПЕНТАНА. А можно ли составить формулу другого изомера?
Слайд 16Для этого сделаем основную цепочку короче. Расположим в ряд четыре атома углерода: С – С – С – С А пятый атом присоединим к одному из средних углеродных атомов: С – С – С – С I C Теперь расставим атомы водорода, не забывая про валентность: СН3 – СН2 – СН – СН3 I CН3 Мы получили формулу 2 – МЕТИЛБУТАНА.
Подумайте, можно ли расположить радикал у соседнего атома «С»?
С
Слайд 17Попробуем написать формулу изомера, содержащего в основной цепи три атома углерода: С – С – С Теперь присоединим оставшиеся атомы углерода ко второму атому цепочки в виде метил– радикалов и расставим атомы водорода: СН3 I СН3 – С – СН3 I СН3 Мы получили формулу еще одного изомера – 2,2 – ДИМЕТИЛПРОПАНА.
А можно вместо двух метил– радикалов использовать один этил– радикал?
Слайд 18Итак, мы получили три изомера с эмпирической формулой С5Н12:
пентан СН3 – СН2 – СН2 – СН2 – СН3 2–метилбутан СН3 – СН – СН2 – СН3 I CН3 2,2–диметилпропан СН3 I СН3 – С – СН3 I СН3
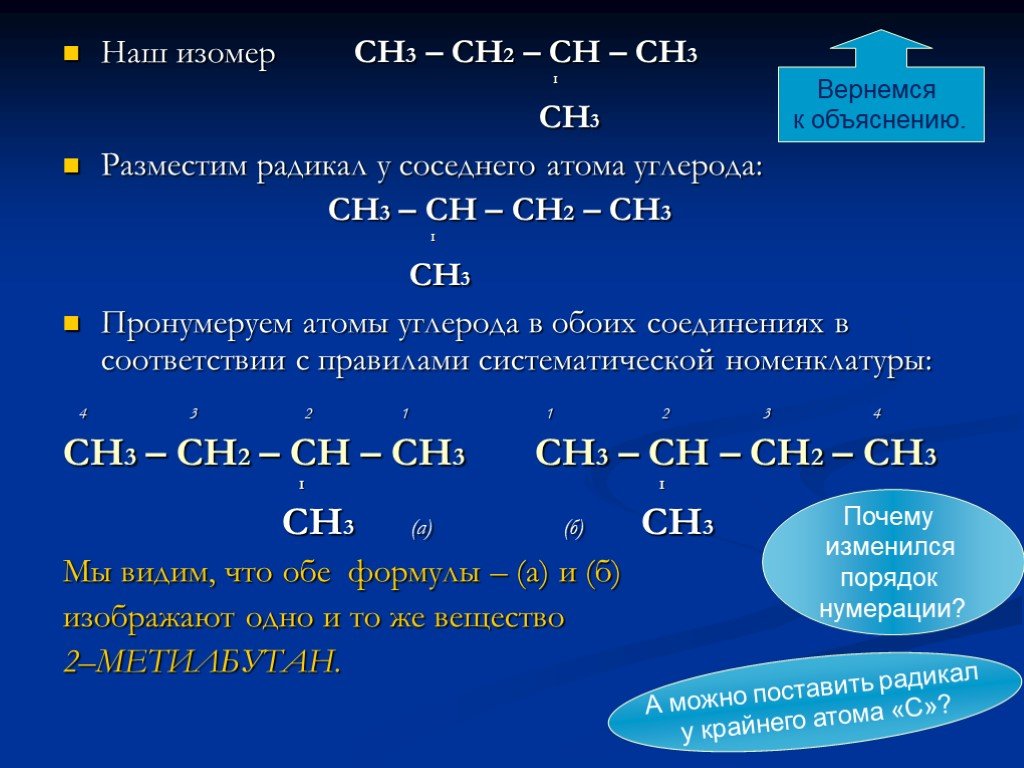
Слайд 19Наш изомер СН3 – СН2 – СН – СН3 I CН3 Разместим радикал у соседнего атома углерода: СН3 – СН – СН2 – СН3 I CН3 Пронумеруем атомы углерода в обоих соединениях в соответствии с правилами систематической номенклатуры: 4 3 2 1 1 2 3 4 СН3 – СН2 – СН – СН3 СН3 – СН – СН2 – СН3 I I CН3 (а) (б) CН3 Мы видим, что обе формулы – (а) и (б) изображают одно и то же вещество 2–МЕТИЛБУТАН.
А можно поставить радикал у крайнего атома «С»?
Почему изменился порядок нумерации?
Слайд 20Сделаем это и посмотрим, что у нас получится: СН3 – СН2 – СН2 – СН2 I CН3 Пронумеруем атомы углерода: 5 4 3 2 СН3 – СН2 – СН2 – СН2 1 I CН3 Как видите, мы вновь получили ПЕНТАН. Такой изомер у нас уже есть.
Пытаемся расположить радикал у крайнего атома «С».
Слайд 21Давайте попробуем использовать этил–радикал, а за одним пронумеруем атомы углерода основной (т.е. самой длинной) цепочки: 1 2 СН3 – СН – СН3 3 I СН2 4 I СН3 Как видите, такой изомер у нас уже был. Это 2–МЕТИЛБУТАН.
Слайд 22Порядок нумерации
Порядок нумерации определяется в соответствии с правилами систематической номенклатуры. Нумеровать цепочку начинаем с того края, где ближе разветвление: 4 3 2 1 нумерацию ведем слева СН3 – СН2 – СН – СН3 направо, т.к. радикал расположен I ближе к левому краю CН3 1 2 3 4 нумерацию ведем справа СН3 – СН – СН2 – СН3 налево, т.к. радикал расположен I ближе к правому краю CН3
Слайд 23Изомерия положения кратной связи
Кратной связью называют двойную связь – С = С – тройную связь – С ≡ С – Рассмотрим изомерию положения кратной связи на примере пентена С5Н10
Слайд 24Напишем структурную формулу простейшего линейного изомера С5Н10, у которого двойная связь расположена возле первого атома углерода.
Для этого расположим все атомы углерода в одну цепочку, после первого атома углерода расположим двойную связь, : С = С – С – С – С Теперь расставим атомы водорода: СН2 = СН – СН2 – СН2 – СН3 Итак, мы написали формулу первого изомера С5Н10 пентена–1.
Слайд 25Само название этого вида изомерии предполагает, что положение двойной связи должно меняться. Разместим двойную связь после второго атома углерода: СН3 – СН = СН – СН2 – СН3 Этот изомер называется пентен –2
Подумайте, существуют ли другие изомеры этого вида?
Слайд 26Итак, мы составили формулы двух изомеров пентена:
пентен – 1 СН2 = СН – СН2 – СН2 – СН3 пентен – 2 СН3 – СН = СН – СН2 – СН3
Слайд 27Нет. Других изомеров положения двойной связи для пентена не существует.
А как же пентен – 3 и пентен – 4?
Слайд 28Вспомните правила номенклатуры и порядок нумерации:
В соответствии с правилами систематической номенклатуры нумерация начинается с того края, где ближе находится кратная связь: 5 4 3 2 1 СН3 – СН2 – СН = СН – СН3 Этот изомер называется пентен – 2 5 4 3 2 1 СН3 – СН2 – СН2 – СН = СН3 Этот изомер называется пентен – 1
Слайд 29Изомерия положения функциональной группы
Функциональная группа – это атом или группа атомов, которая определяет основные свойства соединения. К функциональным группам относятся гидроксогруппа –ОН, сульфогруппа –SO3H, карбоксильная –СООН, нитрогруппа –NO2 и другие. К функциональным группам можно так же отнести галогены: –Cl, –Br, –F, –I. Рассмотрим изомерию положения функциональной группы на примере бромпентана С5Н11Br
Слайд 30Напишем формулу простейшего линейного изомера С5Н11Вr, у которого атом брома расположен возле первого атома углерода.
Для этого расположим все атомы углерода в одну цепочку, к первому атому углерода присоединим атом брома, вспомнив при этом, что валентность брома равна I: С – С – С – С – С I Br Теперь расставим атомы водорода: СН2Вr – СН2 – СН2 – СН2 – СН3 Итак, мы написали формулу первого изомера С5Н11Вr – 1–бромпентана.
Слайд 31Само название этого вида изомерии предполагает, что положение функциональной группы должно меняться. Разместим атом брома возле второго атома углерода: СН3 – СН – СН2 – СН2 – СН3 I Этот изомер называется Br 2 – бромпентан Вы легко догадаетесь как будет выглядеть третий изомер: СН3 – СН2 – СН – СН2 – СН3 I Этот изомер называется Br 3 – бромпентан
Слайд 32Итак, мы получили формулы трех изомеров бромпентана:
1–бромпентан СН2Вr – СН2 – СН2 – СН2 – СН3 2–бромпентан СН3 – СНВr – СН2 – СН2 – СН3 3–бромпентан СН3 – СН2 – СНВr– СН2 – СН3
Слайд 33Нет. Других изомеров положения функциональной группы для бромпентана не существует.
А как же 4 – бромпентан и 5 – бромпентан?
Слайд 34В соответствии с правилами систематической номенклатуры нумерация начинается с того края, где ближе расположена функциональная группа: 5 4 3 2 1 СН3 – СН2 – СН2 – СН – СН3 Этот изомер I называется Br 2–бромпентан 5 4 3 2 1 СН3 – СН2 – СН2 – СН2 – СН3 Этот изомер I называется Br 1–бромпентан
Слайд 35Межклассовая изомерия
Эти изомеры относятся к разным классам органических соединений. Остается просто запомнить какие классы соединений изомерны друг другу. Рассмотрим некоторые примеры межклассовой изомерии.
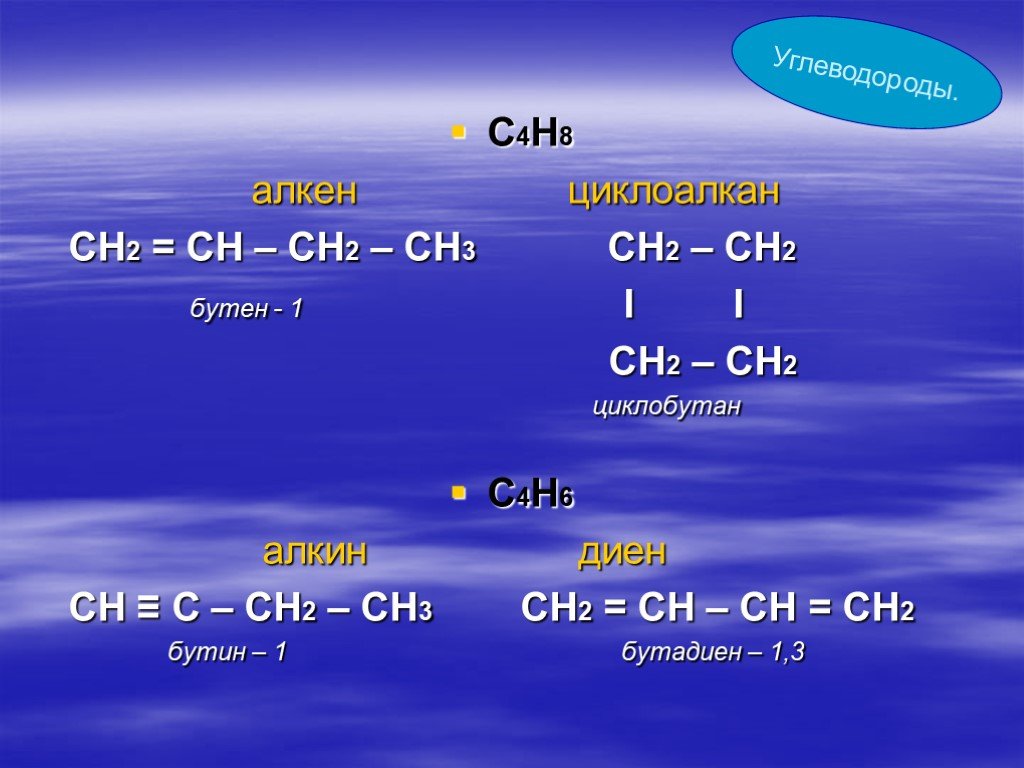
Слайд 36С4Н8 алкен циклоалкан СН2 = СН – СН2 – СН3 СН2 – СН2 бутен - 1 I I CН2 – CН2 циклобутан С4Н6 алкин диен СН ≡ С – СН2 – СН3 СН2 = СН – СН = СН2 бутин – 1 бутадиен – 1,3
Углеводороды.
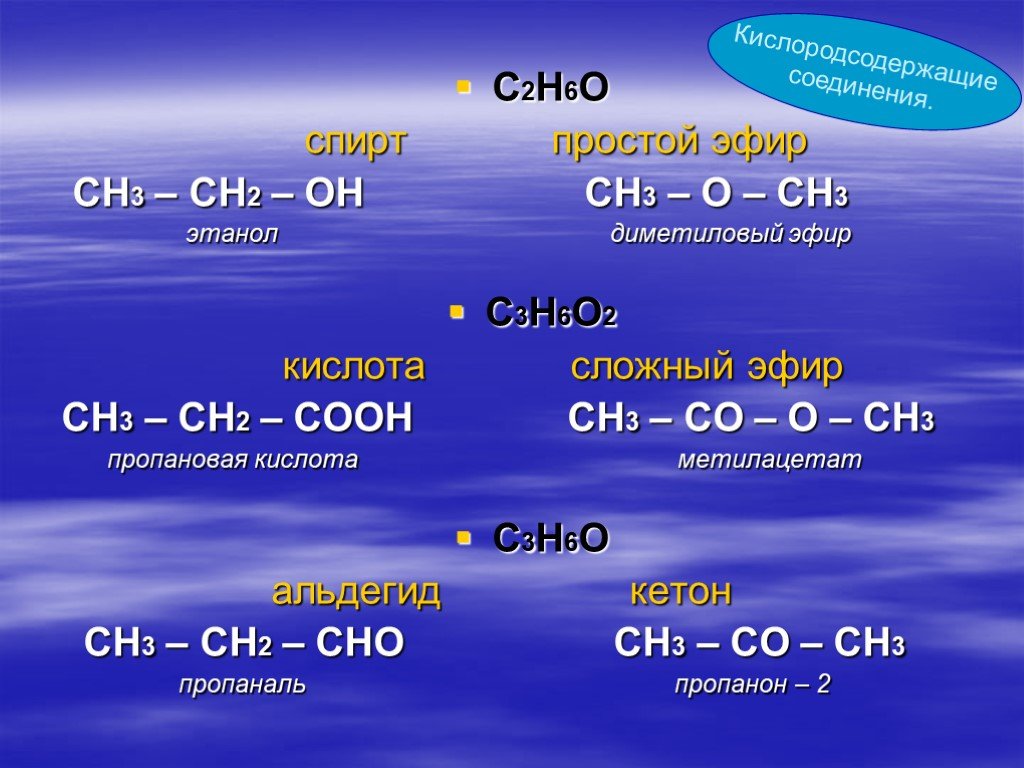
Слайд 37С2Н6О спирт простой эфир СН3 – СН2 – ОН СН3 – О – СН3 этанол диметиловый эфир С3Н6О2 кислота сложный эфир СН3 – СН2 – СООН СН3 – СО – О – СН3 пропановая кислота метилацетат С3Н6О альдегид кетон СН3 – СН2 – СНО СН3 – СО – СН3 пропаналь пропанон – 2
Кислородсодержащие соединения.
Слайд 38С2Н5N О2 аминокислота нитросоединения N Н2 – СН2 – СООН СН3 – СН2 – N О2 2 – аминоэтановая кислота нитроэтан Можно найти межклассовые изомеры и для других соединений. Подумайте сами, для каких.
Азотсодержащие соединения.
Слайд 39Оптическая изомерия
Оптическая изомерия характерна для многих природных соединений. Особенно большое значение она имеет для углеводов и белков. Оптические изомеры обладают одинаковыми химическими свойствами. Большинство их физических свойств (tпл, tкип, цвет, запах и т.д.) совпадают. Отличается они лишь способностью отклонять на некоторый угол плоскость поляризации поляризованного света, а в твердом состоянии их кристаллы выглядят зеркальным отражением друг друга.
Что такое поляризованный свет и как он вращается?
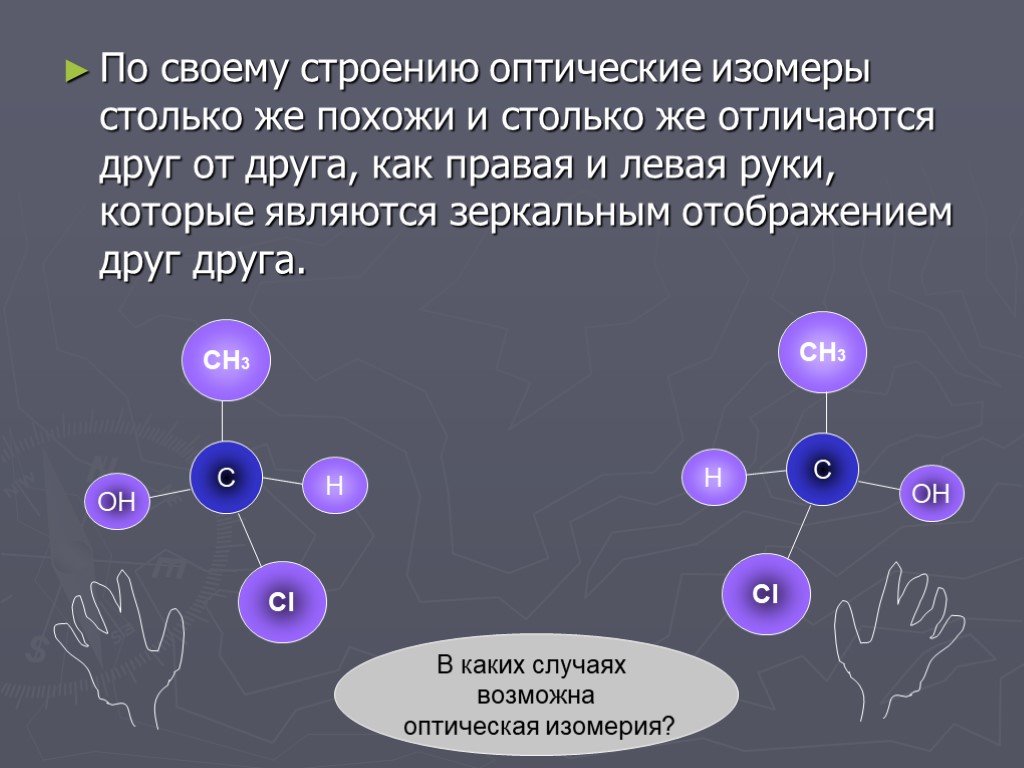
Слайд 40По своему строению оптические изомеры столько же похожи и столько же отличаются друг от друга, как правая и левая руки, которые являются зеркальным отображением друг друга.
СН3 ОН Н Сl
В каких случаях возможна оптическая изомерия?
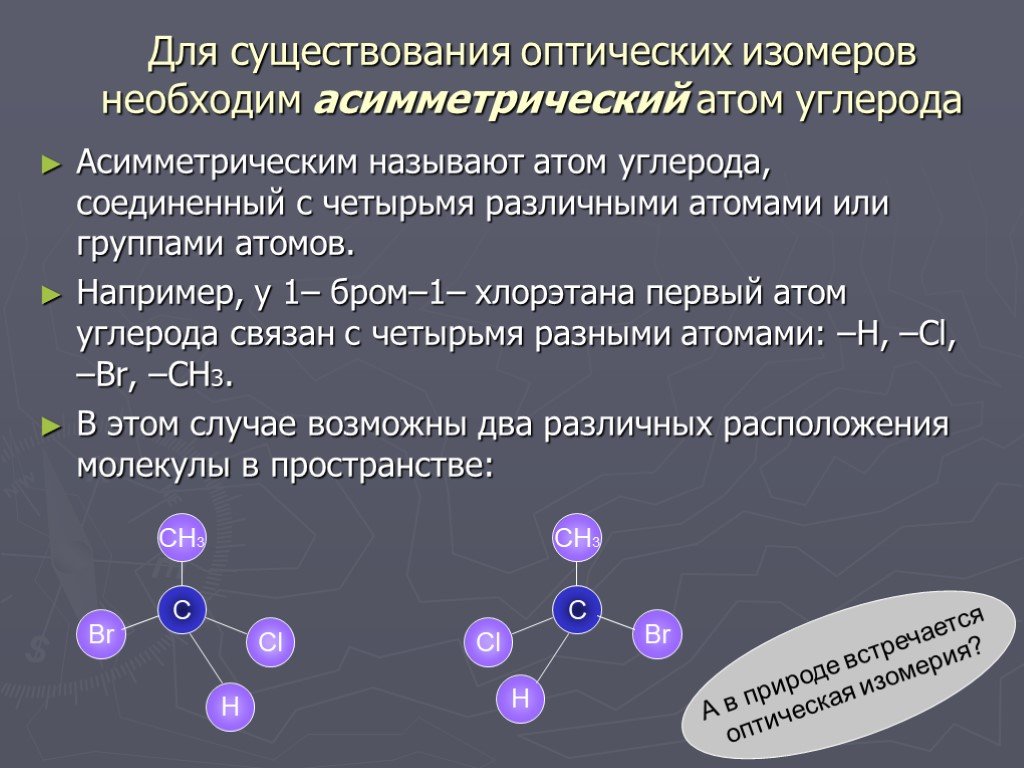
Слайд 41Для существования оптических изомеров необходим асимметрический атом углерода
Асимметрическим называют атом углерода, соединенный с четырьмя различными атомами или группами атомов. Например, у 1– бром–1– хлорэтана первый атом углерода связан с четырьмя разными атомами: –Н, –Сl, –Br, –СН3. В этом случае возможны два различных расположения молекулы в пространстве:
Br
А в природе встречается оптическая изомерия?
Слайд 42В природе наибольшее значение имеет оптическая изомерия углеводов и аминокислот
Интересно, что практически все «природные» углеводы имеют D-конфигурацию, а вот аминокислоты встречаются только в L-форме.
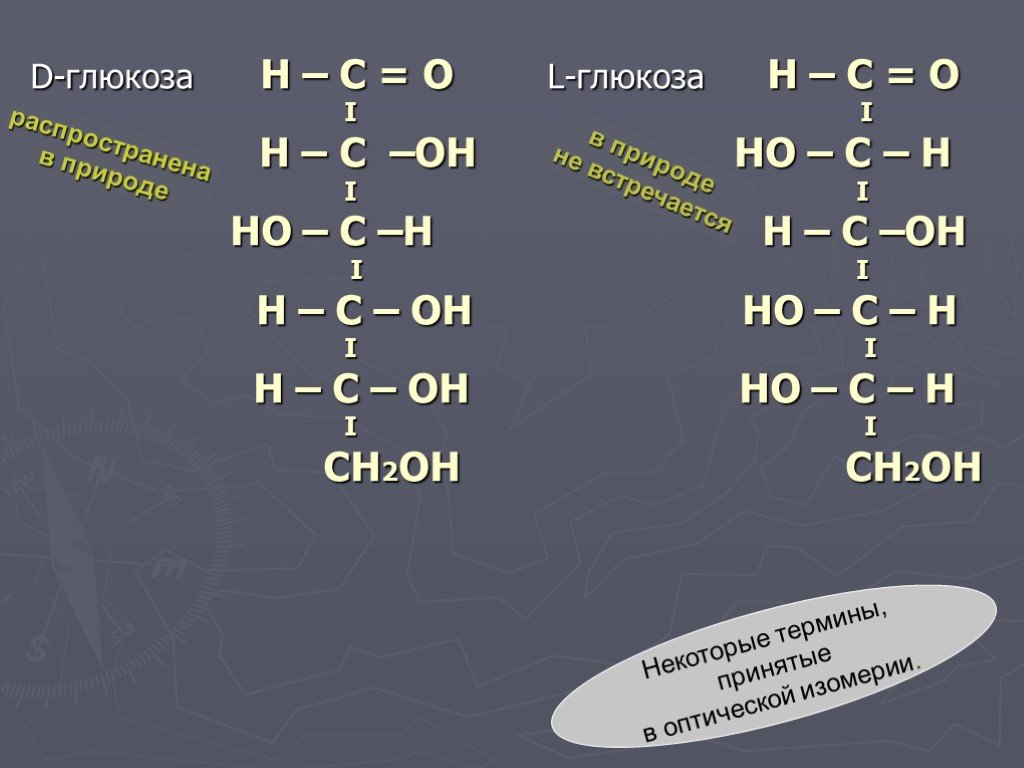
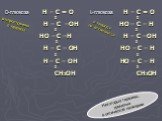
Слайд 43D-глюкоза H – C = О L-глюкоза Н – С = O I I H – С –OH НО – С – Н I I НО – С –Н Н – С –ОН I I Н – С – ОН НО – С – Н I I Н – С – ОН НО – С – Н I I СН2ОН СН2ОН
Некоторые термины, принятые в оптической изомерии.
распространена в природе
в природе не встречается
Слайд 44Некоторые термины
Оптическая изомерия – иначе зеркальная изомерия или энантиомерия. Оптические изомеры – иначе называются зеркальными изомерами или энантиомерами. Хиральность – способность соединений существовать в виде пары зеркальных изомеров. Хиральный центр или хиральный атом углерода – асимметрический атом углерода, связанный с четырьмя различными атомами или группами атомов. Рацемат – смесь оптических изомеров, не обладающая оптической активностью. В рацемате изомеры погашают оптическую активность друг друга.
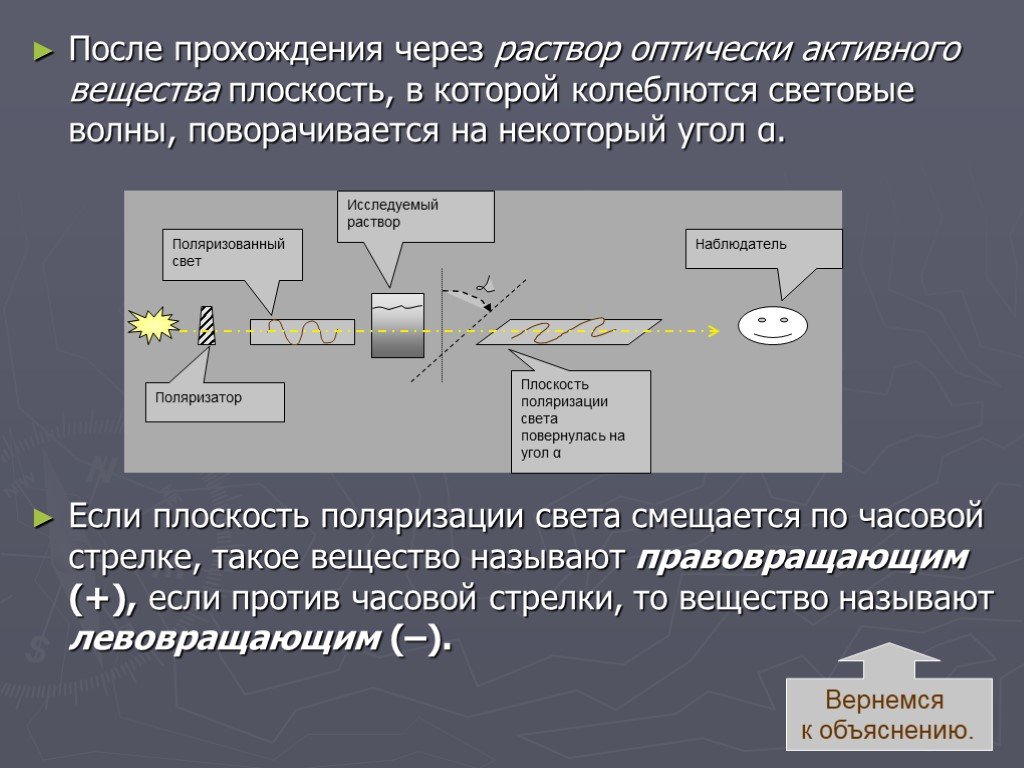
Слайд 45Обычный свет представляет собой электромагнитные колебания. Как правило световые волны колеблются во множестве плоскостей. Если свет пропустить через специальный поляризатор, то все световые волны будут колебаться в одной плоскости. Такой свет называется плоскополяризованным или поляризованным.
Слайд 46В 1815г Жан Батист Био открыл явление оптической активности – способности жидкости изменять (отклонять на некоторый угол) плоскость поляризации поляризованного света.
Слайд 47После прохождения через раствор оптически активного вещества плоскость, в которой колеблются световые волны, поворачивается на некоторый угол α. Если плоскость поляризации света смещается по часовой стрелке, такое вещество называют правовращающим (+), если против часовой стрелки, то вещество называют левовращающим (–).
Слайд 48Вы поняли что такое изомерия? Научились строить изомеры? Значит самое время приступить к выполнению Домашнего Задания. Желаю успеха.
конец работы