Презентация "Реакции обмена в водных растворах электролитов. Ионные реакции и уравнения" по химии – проект, доклад
Презентацию на тему "Реакции обмена в водных растворах электролитов. Ионные реакции и уравнения" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 13 слайд(ов).
Слайды презентации
Список похожих презентаций
Реакции ионного обмена. Ионные уравнения
Определите тип данной реакции по числу и составу веществ вступивших и образующихся в реакции AqNO3 + HCl = AqCl + HNO3. реакция обмена. Технологическая ...Химические уравнения. Реакции обмена
24.05.2019 Лебедева Л.В.Повторим изученный материал.
Какое слово зашифровано в таблице?
2Na+2HCl=2NaCl +H2↑ 2Al + 3S = Al2S3 Al(OH)3 = Al2O3 + ...
Электролитическая диссоциация веществ. Реакции ионного обмена и условия их протекания
1. Веществом, при диссоциации которого образуются катионы металла и анионы кислотного остатка, является. А. NH4NO3 Б. HNO3 В. NaOH Г. Na2SO4. 2. К ...Реакции ионного обмена
Получение гидроксида меди (II). I группа: CuCl2 + 2KOH = Cu(OH)2 + 2KCl 2 группа: CuBr2 + Ba(OH)2 = Cu(OH)2 + BaBr2 3 группа: Cu(NO3)2 + 2NaOH = Cu(OH)2 ..."Реакции ионного обмена"
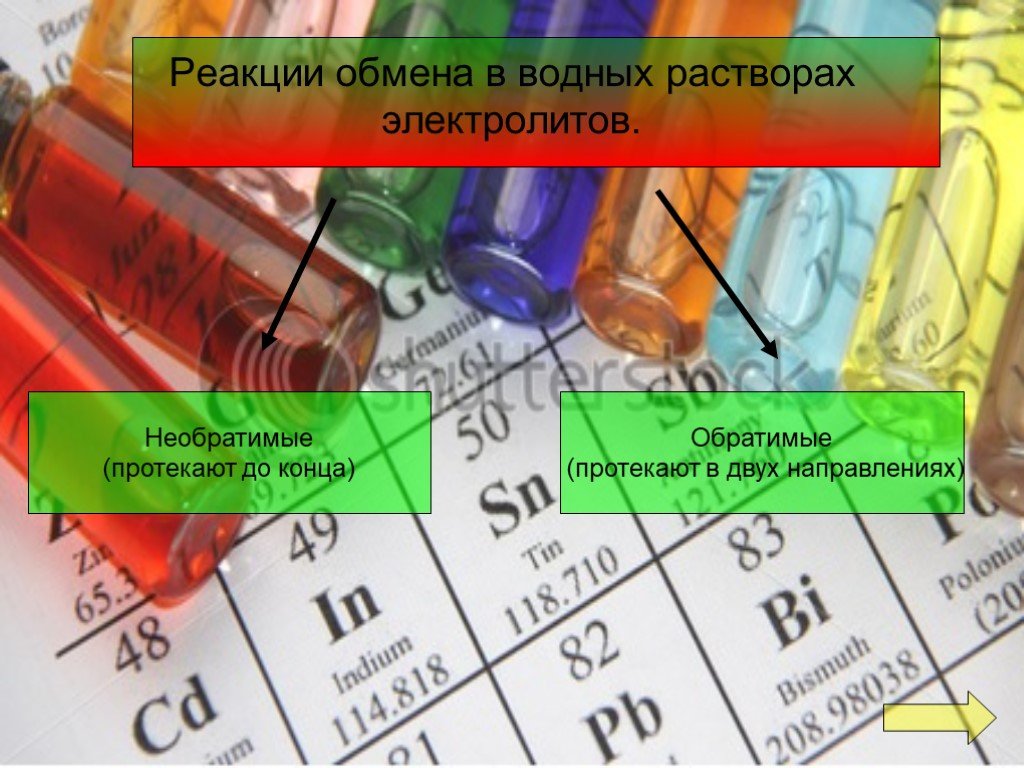
Реакции обмена протекают между ионами, поэтому они называются реакциями ионного обмена Реакции ионного обмена идут до конца в трех случаях. Если образуется ...Реакции ионного обмена
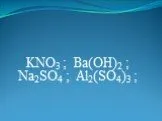
Ошибка. Убери лишнее. (Найдите неэлектролиты). NaOH NaCl K2SO4 H2SO4 CaCO3 Mg(NO3)2 CuCl2 BaSO4 CaSO4 Cu(OH)2 SО3 FeCl3 NaNO3 Ca(OH)2 Al(NO3)3 Na2CO3. ...Реакции ионного обмена
ЦЕЛЬ урока: сформировать понятие о реакциях ионного обмена. ЗАДАЧИ: Образовательные: познакомить учащихся с реакциями ионного обмена и условиями их ...Изучение реакции среды в зависимости от типа гидролиза соли
Лабораторная работа Изучение реакции среды в зависимости от типа гидролиза соли. Цели: понять сущность гидролиза. научиться определять реакцию и тип ...Применение ацетилена. Химические реакции, лежащие в основе применения
Химические реакции, лежащие в основе применения ацетилена. Реакции получения и горения ацетилена CaC2 + 2H2O → Ca(OH)2 + C2H2 2C2H2 + 5O2 → 4CO2 +2H2O ...Почему протекают химические реакции
На бумаге можно написать уравнение любой химической реакции («бумага все стерпит»), а возможна ли такая реакция практически? В одних случаях (например, ...Окислительно-восстановительные реакции
Понятие окислительно-восстановительных реакций. Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих ...Окислительно-восстановительные реакции
Цель урока:. Закрепление, обобщение и углубление знаний об окислительно-восстановительных реакциях, расстановка коэффициентов методом электронного ...Окислительно-восстановительные реакции
Цели и задачи:. Закрепить умения учащихся применять понятие «степень окисления» на практике. Обобщать и дополнять знания учащихся об опорных понятиях ...Некоторые Окислительно-восстановительные реакции алкенов
Правила составления ОВР. Взаимодействия алкенов с водным раствором KMnO4 (реакция Вагнера). При взаимодействии алкенов с водным раствором KMnO4 происходит ...Качественные реакции на ионы металлов
Проблемный вопрос: каким образом можно определить ионы металлов в растворах. Цель работы: научиться определять ионы металлов Задачи: расширить знания ...Качественные реакции в органической химии
Алканы. Качественная реакция на алканы: Определить, что какое-то вещество в смеси или в чистом виде алкан, несложно. Для этого газ либо поджигают ...Ионные уравнения реакций
Протекающая реакция описывается следующим уравнением 2KOH + H2SO4 = K2SO4 + 2H2O. 2KOH + H2SO4 = K2SO4 + 2H2O. Отражает ли эта запись в истинном свете ...Ионные уравнения
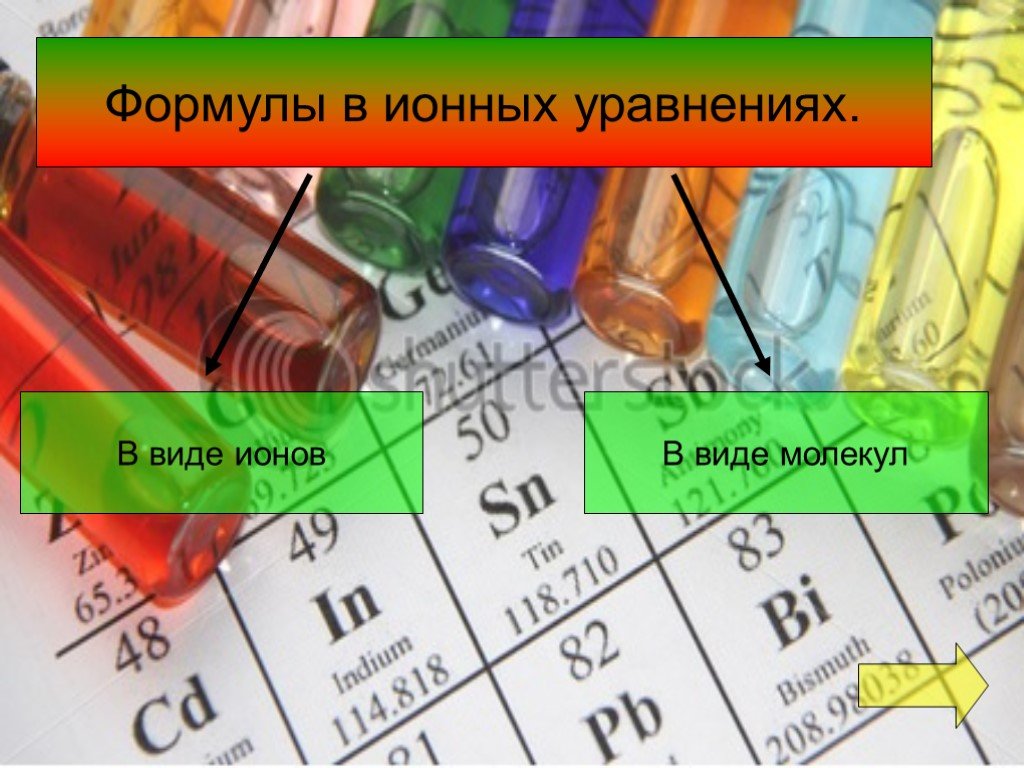
Ионные уравнения. Реакции, осуществляемые в растворах между ионами, называются ионными, а уравнения таких реакций - ионными уравнениями. Правила составления ...Ионные уравнения
Цели урока:. 1)Познакомить учащихся с понятием ионные уравнения и ионные реакции; 2)рассмотреть случаи, при которых реакции ионного обмена протекают ...Анаэробные реакции
Ферменты анаэробных гликолиза и гликогенолиза. 1.Гексокиназа (глюкокиназа) (Mg2+) (2.7.1.1.) 2.Глюкозофосфатизомераза (5.3.1.9.) 3.Фосфофруктокиназа ...Конспекты
Реакции электролитов в водных растворах
Модульный урок по теме: «Реакции электролитов в водных растворах». Цели урока:. опираясь на ранее полученные знания учащихся, сформировать понятие ...Ионные реакции
Работа по разработке урока по химии. в формате ФГОС. Выполнил работу. : Учитель химии гимназии № 33 г.Краснодара. Шакирова Ильвера ...Реакция ионного обмена в растворах электролитов
ХИМИЯ. 9 КЛАСС. ЛАБОРАТОРНЫЕ. . ОПЫТЫ. ТЕТРАДЬ. _________________________. _________________________. _________________________. _________________________. ...Вычисления по химическим уравнениям реакций массы, количества вещества или объема по известной массе, количеству вещества или объему одного из вступающих или получающихся в реакции веществ
Дата_____________ Класс_______________. Тема:. . Вычисления по химическим уравнениям реакций массы, количества вещества или объема по известной ...Реакции ионного обмена и условия их протекания
Дата ______________ Класс_______________. Тема: Реакции ионного обмена и условия их протекания. Цели урока:. продолжить формирование навыков составления ...Реакции ионного обмена и условия их протекания
Дата ______________ Класс_______________. Тема: Реакции ионного обмена и условия их протекания. Цели урока:. познакомить учащихся с ионными уравнениями ...Реакции ионного обмена и условия их протекания
Тема урока:. Реакции ионного обмена и условия их протекания. Тип урока. : Урок новых знаний. Вид урока:. Проблемно – исследовательский. ...Уравнения химической реакции
Уравнения химической реакции. Химия 8класс. Мастер-класс. Образовательные задачи:. Обучающие:. Сформировать понятие о химическом уравнении;. ...Типы химических реакций. Реакции обмена
Разработка урока по теме: "Типы химических реакций. Реакции обмена.". Цели урока:. Образовательная. -. актуализация знаний обучающихся о ...Типы химических реакций. Реакции обмена
Типы химических реакций. Реакции обмена. . . Цели урока:. Образовательная. -. актуализация знаний обучающихся о типах химических реакций, классификации ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:27 октября 2018
Категория:Химия
Содержит:13 слайд(ов)
Поделись с друзьями:
Скачать презентацию