Конспект урока «Реакция ионного обмена в растворах электролитов» по химии для 9 класса
ХИМИЯ
9 КЛАСС
ЛАБОРАТОРНЫЕ
ОПЫТЫ
ТЕТРАДЬ
_________________________
_________________________
_________________________
_________________________
_________________________
2014-2015 уч.год
Дата:
Реакция ионного обмена в растворах электролитов.
Цель работы: ознакомиться на практике с реакциями ионного обмена различных типов и условиями их протекания.
Оборудование и реактивы: штатив с 4 пробирками, соляная кислота, растворы хлорида бария, сульфата меди, сульфата натрия, гидроксида натрия, карбоната натрия, фенолфталеин
Ход работы:
-
В пробирку налейте 2 мл раствора хлорида бария и добавьте столько же раствора сульфата натрия. Что наблюдаете? Сделайте вывод и напишите уравнение химической реакции в молекулярном и сокращенном ионном виде.
-
В пробирку налейте 2 мл раствора сульфата меди и прилейте раствор гидроксида натрия. Что наблюдаете? Сделайте вывод и напишите уравнение химической реакции в молекулярном и сокращенном ионном виде.
-
Налейте в пробирку 2 мл раствора карбоната натрия, добавьте 1мл соляной кислоты. Что наблюдаете? Сделайте вывод и напишите уравнение химической реакции в молекулярном и сокращенном ионном виде.
-
Налейте в пробирку 2 мл гидроксида натрия, добавьте каплю фенолфталеина. Что наблюдаете? Затем добавьте по каплям соляную кислоту до полного обесцвечивания раствора. Сделайте вывод и напишите уравнение химической реакции в молекулярном и сокращенном ионном виде.
По итогам проведенных опытов заполните таблицу, сделайте вывод об условиях протекания реакций ионного обмена до конца.
| РАСТВОРЫ | НАБЛЮДЕНИЕ | ХИМИЧЕСКИЕ РЕАКЦИИ (молекулярные, полные ионные и сокращенные ионные уравнения) | |
| 1 | | | |
| 2 | | | |
| 3 | | | |
| 4 | | | |
Вывод:_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дата:
Лабораторная работа №2
Гидролиз солей
Цель: исследовать гидролиз разных солей и определить рН среды растворов.
Оборудование, реактивы, материалы: раствор гидроксида натрия, соляной кислоты, соды, хлорида железа (ІІІ), хлорида бария, пробирки, универсальная индикаторная бумага.
Задание:
В пять пробирок наберите:
1 – раствор гидроксида натрия;
2 – раствор соляной кислоты;
3 – раствор соды;
4 – раствор хлорида железа (ІІІ);
5 – раствор хлорида бария.
Опустив в каждую пробирку универсальную индикаторную бумагу, определите рН среды растворов по шкале рН.
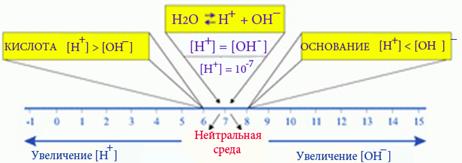
| ИНДИКАТОРНАЯ БУМАГА | ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ рН | ВЫВОД | |
| NaOH | | | |
| HCl | | | |
| Na2CO3 | | | |
| BaCl2 | | | |
| FeCl3 | | | |
Вывод:_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дата:
«Получение углекислого газа и его распознавание»
Цель работы: экспериментально получить углекислый газ и провести опыты, характеризующие его свойства.
Оборудование и реактивы: штатив с пробирками, штатив лабораторный, прибор для получения углекислого газа, мел (мрамор), соляная кислота, известковая вода.
Ход работы:
-
Подготовьте заранее две пробирки: одну с 4 мл раствора лакмуса в дистиллированной воде (водопроводная вода не годится), другую – с 3 мл известковой воды с добавлением фенолфталеина.
-
Соберите прибор для получения газа. Поместите в пробирку несколько кусочков мела, налейте до 1/3 объема пробирки соляной кислоты и закройте пробкой с газоотводной трубкой, конец которой направлен вниз. Сделайте вывод о способе получения углекислого газа.
-
Опустите газоотводную трубку в пробирку с раствором лакмуса так, чтобы конец газоотводной трубки был ниже уровня раствора. Пропускайте углекислый газ до изменения окраски индикатора на розовую.
-
Погрузите газоотводную трубку в пробирку с известковой водой так, чтобы конец газоотводной трубки был ниже уровня раствора. Пропускайте углекислый газ до изменения окраски раствора и выпадения осадка. Если продолжать дальше пропускать углекислый газ то осадок исчезнет. Сделайте вывод о химических свойствах углекислого газа.
По итогам проведенных опытов заполните таблицу, сделайте вывод.
| НАБЛЮДЕНИЕ | |
| | |
| | |
| | |
Вывод:_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дата:
«Получение аммиака и его распознавание»
Цель работы: экспериментально получить аммиак и провести опыты, характеризующие его свойства.
Оборудование и реактивы: штатив с пробирками, штатив лабораторный, прибор для получения аммиака, хлорид аммония, гидроксид кальция, индикатор, вода.
Ход работы:
-
Пробирку с насыпанной смесью хлорида аммония NH4Cl и гидроксида кальция Са(ОН)2 закрепите в держателе на штативе и вставьте в нее газоотводную трубку. Конец газоотводной трубки поместите в другую сухую пробирку, установленную горлышком вниз
-
Зажгите спиртовку и начинайте нагревать смесь. Вы почувствуете резкий запах (нюхать осторожно!), заполнение пробирки проверьте с помощью универсального индикатора, заранее смочите его в стакане с водой. Поднесите смоченный индикатор к отверстию пробирки. По изменению окраски индикатора судите о полноте заполнения пробирки аммиаком.
По итогам проведенных опытов заполните таблицу, сделайте вывод.
| НАБЛЮДЕНИЕ | ВЫВОД | |
| | | |
| | | |
Вывод:_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дата:
«Распознавание солей хлорида, сульфида,
сульфата, карбоната, силиката и аммония»
(мультимедиа)
Цель работы: через мультимедию распознать солей хлорида, сульфида, сульфата, карбоната, силиката и аммония.
Оборудование и реактивы: мультимедиа, видео.
| НАБЛЮДЕНИЕ | ВЫВОД | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
Вывод:_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дата:
«Получение гидроксида алюминия и
взаимодействие с растворами кислот и щелочей»
Цель работы: получить гидроксид алюминия и исследовать его характерные химические свойства.
Оборудование и реактивы: штатив с пробирками, растворы сульфата алюминия, гидроксида натрия и соляной кислоты.
Ход работы:.
-
В две пробирки налейте по 1 мл раствора сульфата алюминия и по каплям прилейте раствор щелочи до образования студенистого осадка.
-
В одну пробирку добавьте раствор кислоты, в другую – раствор щелочи. Встряхните пробирки. Что наблюдаете?
По итогам проведенных опытов заполните таблицу, сделайте вывод.
| НАБЛЮДЕНИЕ | ВЫВОД | |
| | | |
| | | |
| | | |
Вывод:_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дата:
Лабораторная работа №6
«Получение гидроксида железа (ІІ) и (ІІІ), изучить свойства»
Цель работы: получить гидроксид железа (ІІ) и (ІІІ) и исследовать его характерные химические свойства.
Оборудование и реактивы: соли железа (II), NaOH, кислота, пероксид водорода, соли железа (IIІ), пробирки, фильтр.
Ход работы:
Опыт №1. Получение и свойства гидроксида железа (II).
К раствору соли железа (II) подливаем раствор щелочи NaOH до образования осадка, затем осадок разделить на четыре части: а) в первую пробирку добавляем избыток щелочи; б) во вторую - кислоту; в) осадок из третьей пробирки отфильтровать и дать ему постоять на воздухе; г) в четвертую пробирку добавить пероксида водорода. Что наблюдаете?
Опыт №2. Получение гидроксида железа (III)
Наливаем в пробирку немного соли железа (IIІ). Добавляем раствор щелочи NaOH до появления осадка. Осадок разделите на две части: в первую добавьте раствора шелочи; во вторую добавьте раствора кислоты. Что наблюдате?
| НАБЛЮДЕНИЕ | ВЫВОД | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
Вывод:_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дата:
«Изготовление моделей молекул углеводородов»
Цель работы: изготовление и изучение пространственного строения молекул углеводородов.
Оборудование и реактивы: разноцветный пластилин, спички (палочки, металлические стержни).
Ход работы:
-
Изготовление модели молекулы метана
а) из белого пластилина изготовьте четыре небольших шарика, имитирующих атомы водорода.
б) сделайте еще один шарик черного цвета большего размера (имитация атома углерода)
в) на черном шарике наметьте четыре равноудаленных друг от друга небольших отверстия и вставьте в них спички, к свободным концам которых прикреплены маленькие белые шарики.
2. Изготовление модели молекулы этилена
а) из белого пластилина изготовьте четыре небольших шарика, имитирующих атомы водорода.
б) сделайте еще два шарика черного цвета большего размера (имитация атома углерода)
в) на каждом черном шарике проделайте три небольших углубления, равноудаленных друг от друга примерно на 1200.
г) прикрепите к черным шарикам «атомы водорода» и соедините черные шарики так, как показано на рисунке.
| СТРУКТУРА МОЛЕКУЛЫ | МОДЕЛЬ | |
| | | |
| | | |
Вывод:_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дата:
«Ознакомление с нефтепродуктами»
Цель работы: ознакомление с коллекцией «Нефть и нефтепродукты», заполнение таблицы.
Оборудование и реактивы: коллекция «нефть и нефтепродукты»
Ход работы:
-
Заполнить таблицу:
| Агрегатное состояние | Цвет | Применение | |
| | | | |
Вывод:_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
«Действие уксусной кислоты на индикаторы,
взаимодействие с металлами и содой»
Цель работы: изучение химических свойств карбоновых кислот на примере уксусной кислоты.
Оборудование и реактивы: штатив с пробирками, лакмус, порошок магния, оксид кальция, раствор гидроксида натрия, карбоната натрия.
Ход работы:
-
Налейте в пробирку 2 мл уксусной кислоты и добавьте несколько капель лакмуса. Что наблюдаете? Затем в эту же пробирку добавляйте по каплям раствор гидроксида натрия. Что наблюдаете?
-
В пробирку поместите порошок магния и прилейте раствор уксусной кислоты. Что наблюдаете?
-
В пробирку с оксидом кальция прилейте раствор уксусной кислоты. Что наблюдаете?
-
В пробирку налейте 2 мл карбоната натрия и прилейте раствор уксусной кислоты. Что наблюдаете?
По итогам проведенных опытов заполните таблицу, сделайте вывод о химических свойствах уксусной кислоты.
| НАБЛЮДЕНИЕ | ВЫВОД | |
| | | |
| | | |
| | | |
| | | |
Вывод:_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Лабораторная работа №10
«Сравнение свойств мыла и синтетических моющих средств»
Цель работы: исследование моющего действия растворов мыла и синтетического порошка.
Оборудование и реактивы: штатив с пробирками, 1% растворы мыла и синтетического порошка, приготовленные на дистиллированной воде, фенолфталеин, жесткая вода, раствор серной кислоты.
Ход работы:
-
Налейте в две пробирки по 1 мл жесткой (водопроводной) воды: в одну добавьте по каплям раствор мыла, в другую – раствор порошка. Не забудьте взбалтывать содержимое пробирок после добавления каждой капли. Обратите внимание, в каком случае приходится прибавлять больше раствора для образования устойчивой пены. Какой можно сделать вывод? Какое моющее средство не утрачивает своего действия в жесткой воде.
-
В пробирки с растворами мыла и порошка прилейте несколько капель фенолфталеина. Что наблюдаете?
По итогам проведенных опытов заполните таблицу, сделайте вывод.
| НАБЛЮДЕНИЕ | ВЫВОД | |
| | | |
| | | |
Вывод:_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Здесь представлен конспект к уроку на тему «Реакция ионного обмена в растворах электролитов», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (9 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

