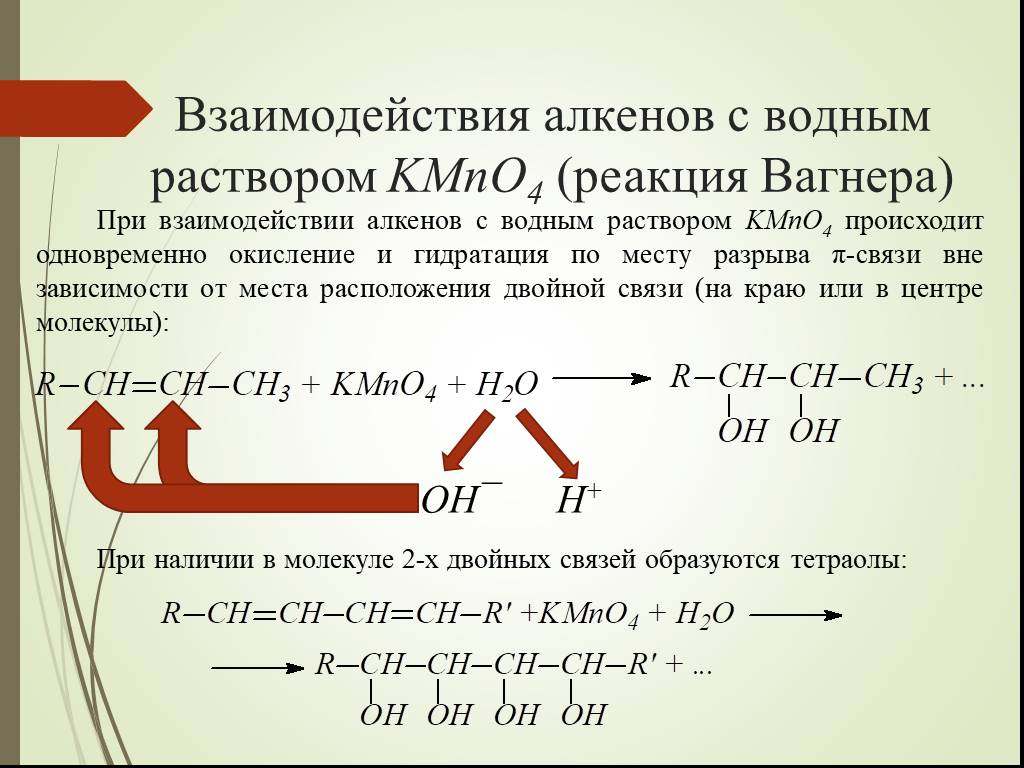
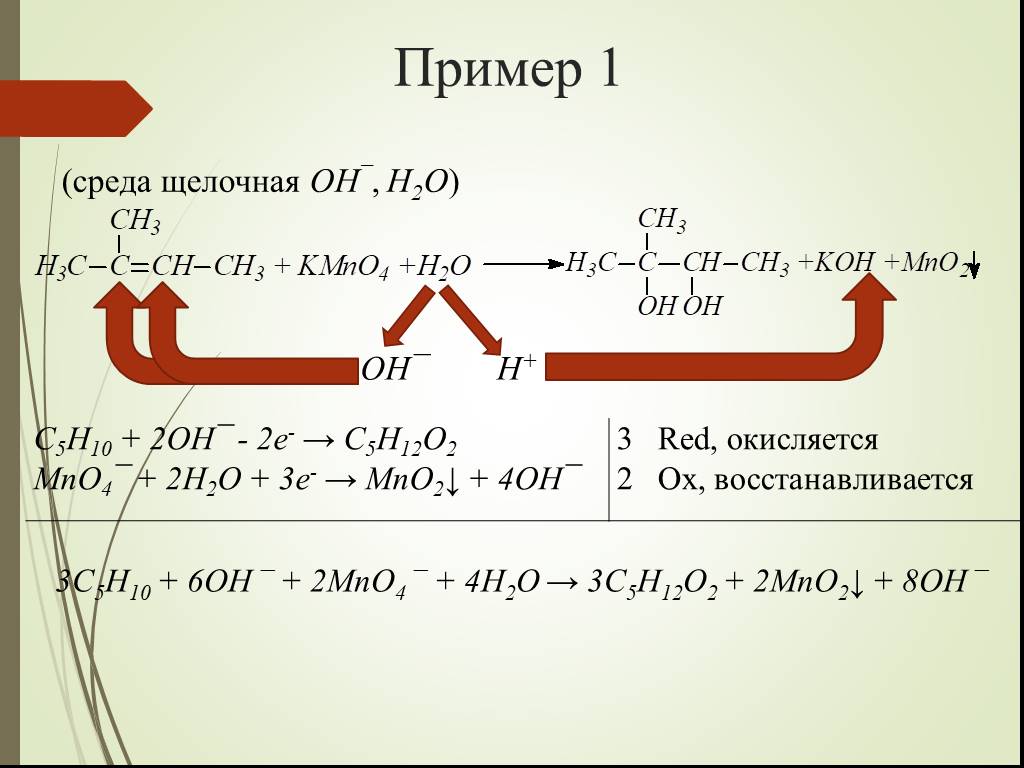
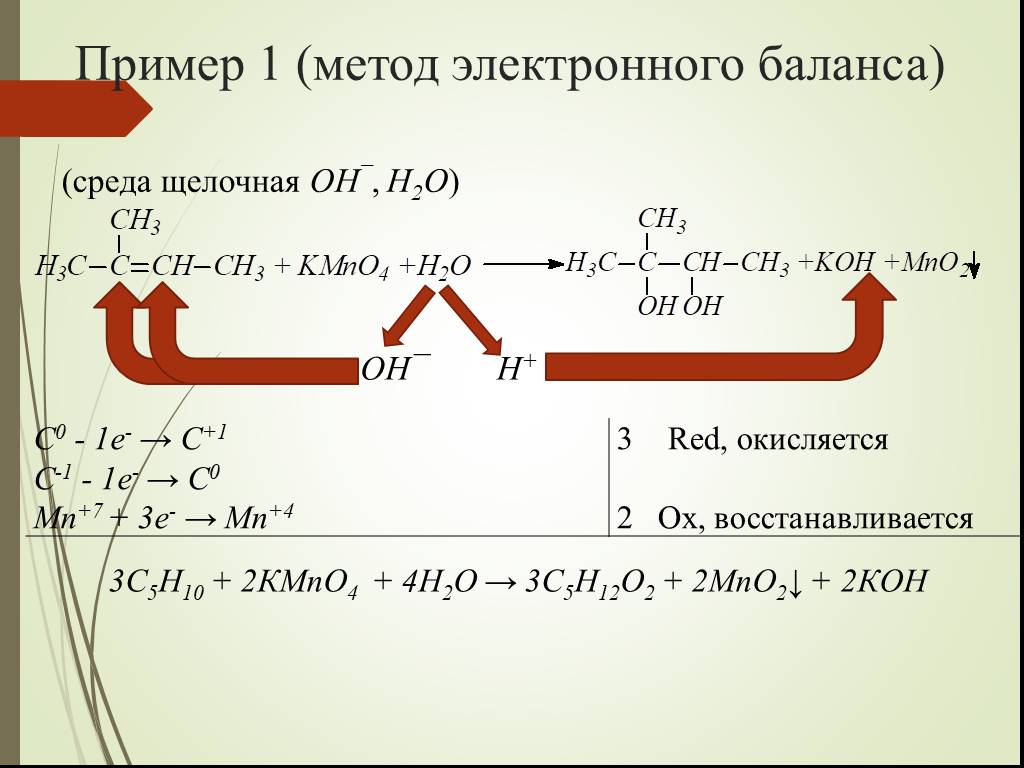
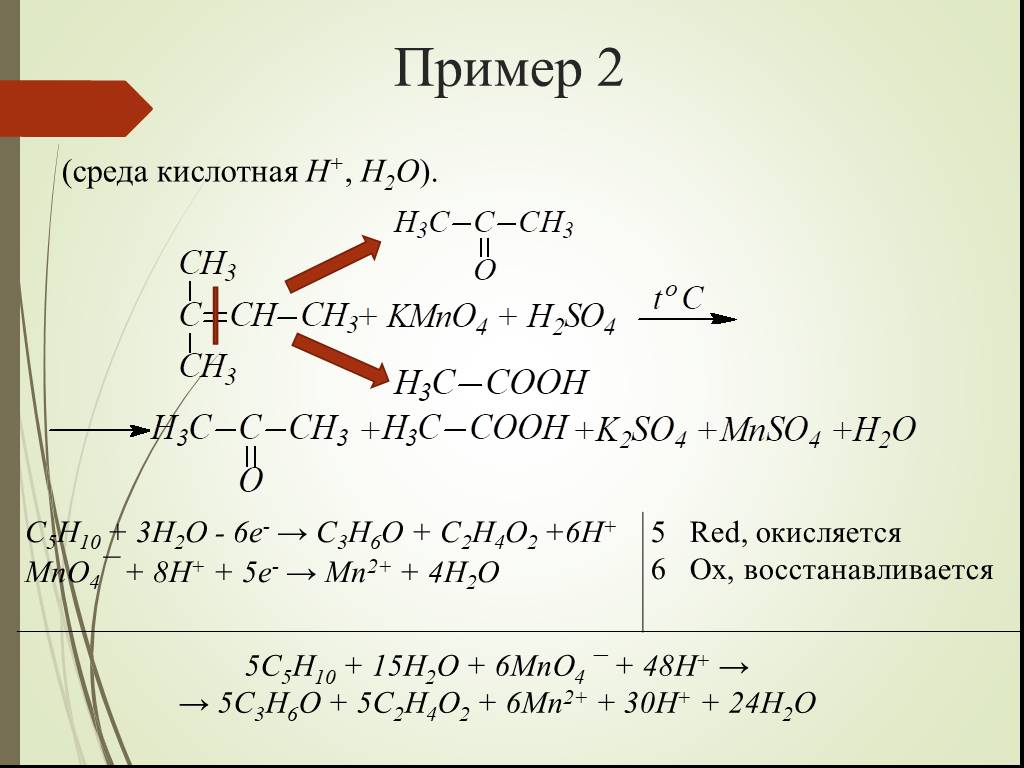
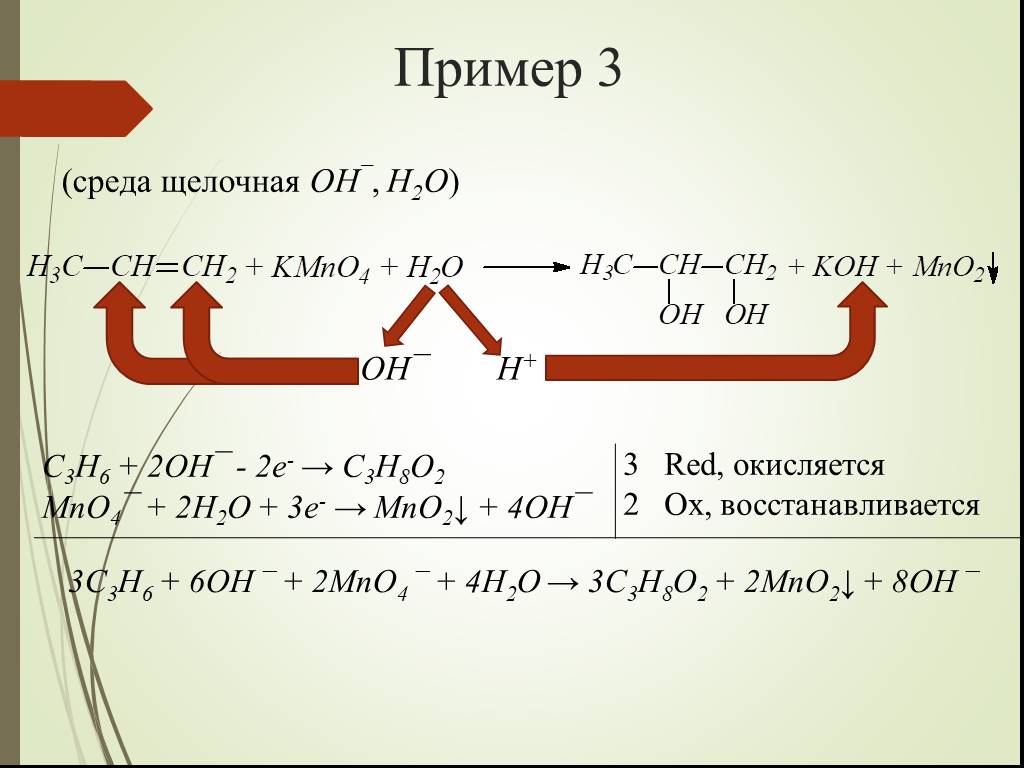
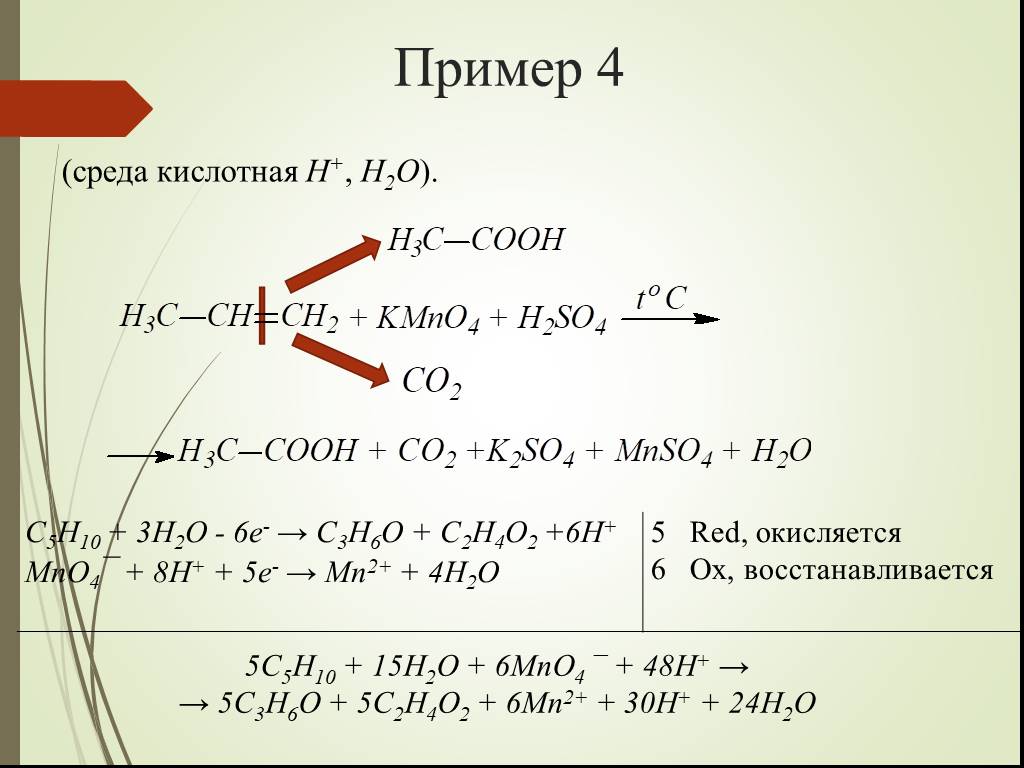
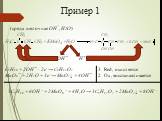
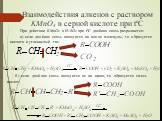Презентация "Некоторые Окислительно-восстановительные реакции алкенов" по химии – проект, доклад
Презентацию на тему "Некоторые Окислительно-восстановительные реакции алкенов" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 16 слайд(ов).
Слайды презентации
Список похожих презентаций
Применение ацетилена. Химические реакции, лежащие в основе применения
Химические реакции, лежащие в основе применения ацетилена. Реакции получения и горения ацетилена CaC2 + 2H2O → Ca(OH)2 + C2H2 2C2H2 + 5O2 → 4CO2 +2H2O ...Серелогические реакции
Серологические реакции – это реакции между антигенами и антителами in vitro . Цели применения: серодиагностика бактериальных и вирусных инфекционных ...Цветные качественные реакции, как способ химического кодирования документов
Тайнопись и защита информации. Защита информации и документов от подделки актуальна с древности. Наибольшую популярность в прошлом имели химические ...Влияние условий на скорость химической реакции
Заполните схему с вопросами о скорости реакции:. Задачи урока. Природа реагирующих веществ Концентрация реагирующих веществ Площадь реагирующих веществ ...Химические реакции
Цели 1. Образовательная: Повторить основные свойства веществ. Повторить основные типы химических реакций. 2. Развивающая: Продолжать развитие наблюдательности ...Химические реакции
План урока. 1. Физические и химические явления. 2. Признаки химических реакций. 3. Условия протекания реакций. 4. Значение химических реакций. Как ...Неорганические соединения - формулы и реакции
Цели урока. В игровой форме обобщить и закрепить знания о химических свойствах основных классов неорганических соединений и их взаимопревращениях. ...Сущность химических реакций и признаки их протекания. Тепловой эффект реакции
Верные и неверные утверждения:. Горение ацетона – это физическое явление. Замерзание воды – это химическое явление. Диффузия паров духов – это физическое ...Качественные реакции на ионы металлов
Проблемный вопрос: каким образом можно определить ионы металлов в растворах. Цель работы: научиться определять ионы металлов Задачи: расширить знания ...Некоторые примеры использования Ферментов в промышленности
АЛМАЗЫ(расщепляют крахмал). Протеазы(расщепляют белки) 1 Папаин. 2 Фицин. 3 Пепсин. 4 Трипсин. 5 Ренин. 6 Бактериальные протеазы. Глюкозооксидаза. ...Качественные реакции в органической химии
Алканы. Качественная реакция на алканы: Определить, что какое-то вещество в смеси или в чистом виде алкан, несложно. Для этого газ либо поджигают ...Изучение реакции среды в зависимости от типа гидролиза соли
Лабораторная работа Изучение реакции среды в зависимости от типа гидролиза соли. Цели: понять сущность гидролиза. научиться определять реакцию и тип ...Изомерия алкенов
Изомеры – это вещества, имеющие одинаковую эмпирическую формулу, но различное строение. Для этиленовых углеводородов характерны 3 вида изомерии: 1. ...Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Обсудим следующие вопросы:. Зачем нужны знания о скорости химических реакций? Какими примерами можно подтвердить то, что химические реакции протекают ...Окислительно - восстановленные реакции
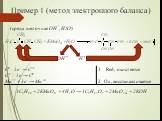
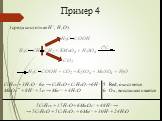
Окислительно-восстановительные реакции (ОВР) – реакции, сопровождающиеся изменением степени окисления элементов (атомов). Степень окисления (СО) – ...Окислительно – восстановительные реакции
Значение окислительно – восстановительных реакций в окружающем нас мире трудно переоценить. ЦЕЛИ:. 1.Расширение, углубление и обобщение знаний в области ...Химические реакции
Химические реакции. Химический диктант. 1.почернение медной пластинки при нагревании, 2.плавление металла 3.Кипение воды 4.выделение пузырьков газа ...Окислительно – восстановительные реакции
Пример: 2Cu0 + O2 =2 Cu2+O2- 2H+CL- + Zn0 = Zn2+CL2- + H20. Реакции, протекающие с изменением степеней окисления атомов всех или некоторых элементов, ...Химические реакции
Оглавление:. ВВЕДЕНИЕ КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ: По числу и составу реагирующих веществ По изменению степеней окисления химических элементов ...Конспекты
Химические реакции
Химические реакции. Цели урока:. Повторить отличия химических явлений от физических. . Познакомить с признаками и условиями течения химических ...Химические реакции
Министерство общего и профессионального образования Свердловской области. Муниципальное общеобразовательное учреждение. «Средняя общеобразовательная ...Факторы, влияющие на скорость химической реакции
МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ. СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 81. Урок химии в 9 классе. ...Физические и химические явления. Химические реакции
Урок химии в 8 классе на тему. :. Физические и химические явления. Химические реакции. . . Савинская Татьяна Андреевна. учитель химии и биологии. ...Уравнения химической реакции
Уравнения химической реакции. Химия 8класс. Мастер-класс. Образовательные задачи:. Обучающие:. Сформировать понятие о химическом уравнении;. ...Факторы, влияющие на скорость химической реакции
Конспект урока по химии в 9 классе. Щеголева Татьяна Александровна. ,. . учитель химии. . высшей категории. МАОУ «Средняя общеобразовательная ...Окислительно - восстановительные реакции
Фалинская Наталья Васильевна. Учитель высшей категории химии и биологии. Кушокинксая СОШ Бухаржырауского района Карагандинской области. 8 ...Именные реакции в органической химии
Урок обобщения: "Именные реакции в органической химии" 10 класс. Максимова И.Н. учитель химии и биологии. . МБОУ «Среднекибечская СОШ» Канашского ...Обобщение знаний об основных типах химической реакции
. /8 класс/. Тема урока:. Обобщение знаний об основных типах химических реакций. Цель:. Обобщить и закрепить знания о типах ...Окислительно - восстановительные реакции
Рогова Е.В. Учитель химии и биологии. МКОУ Васильевская ООШ Воронежской области. Тема урока. - лекции: Окислительно - восстановительные ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:22 марта 2019
Категория:Химия
Содержит:16 слайд(ов)
Поделись с друзьями:
Скачать презентацию