Презентация "Ионные уравнения" по химии – проект, доклад
Презентацию на тему "Ионные уравнения" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 15 слайд(ов).
Слайды презентации
Список похожих презентаций
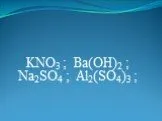
Реакции ионного обмена. Ионные уравнения
Определите тип данной реакции по числу и составу веществ вступивших и образующихся в реакции AqNO3 + HCl = AqCl + HNO3. реакция обмена. Технологическая ...Ионные уравнения реакций
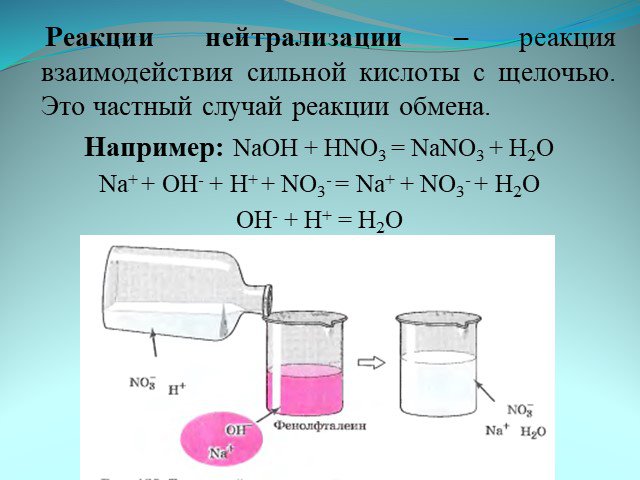
Протекающая реакция описывается следующим уравнением 2KOH + H2SO4 = K2SO4 + 2H2O. 2KOH + H2SO4 = K2SO4 + 2H2O. Отражает ли эта запись в истинном свете ...Ионные уравнения
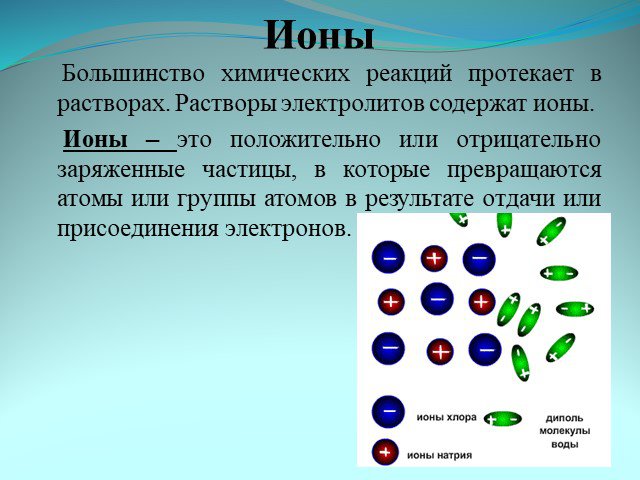
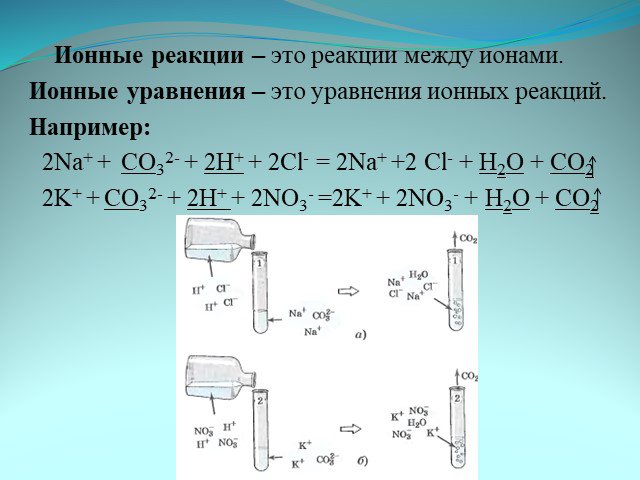
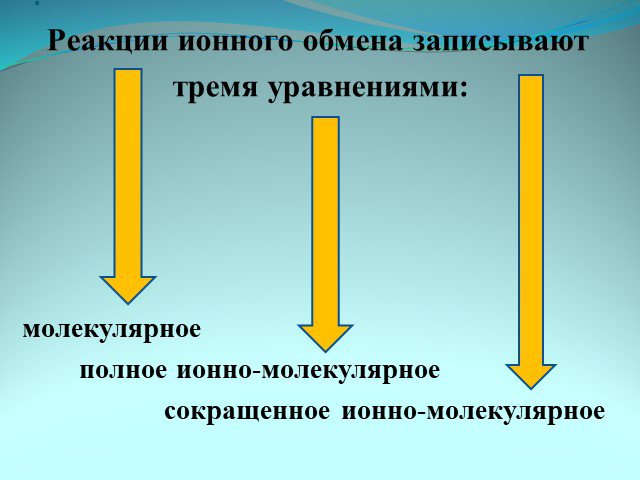
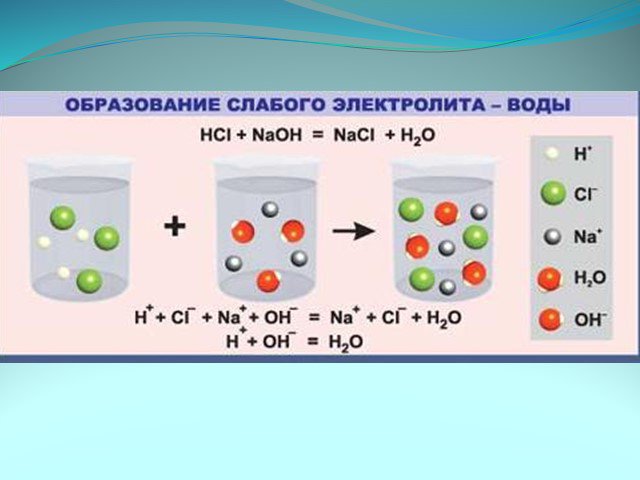
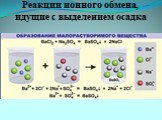
Ионные уравнения. Реакции, осуществляемые в растворах между ионами, называются ионными, а уравнения таких реакций - ионными уравнениями. Правила составления ...Реакции обмена в водных растворах электролитов. Ионные реакции и уравнения
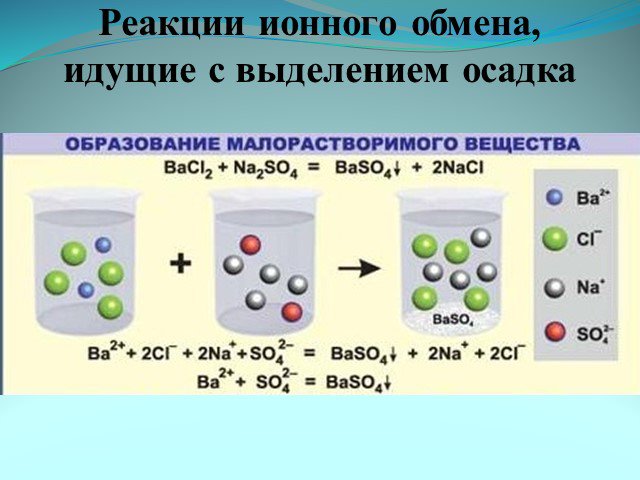
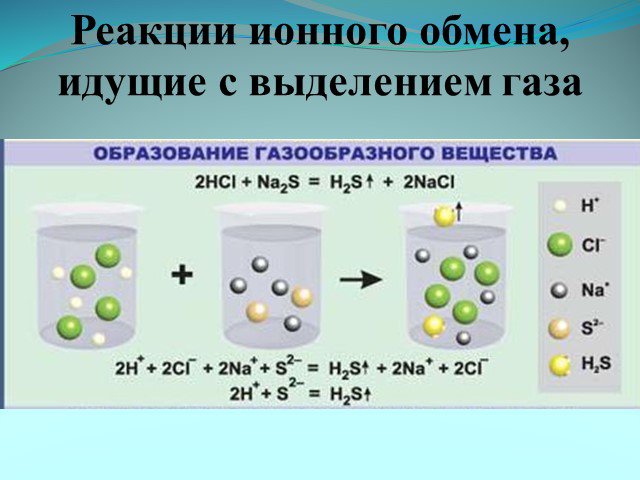
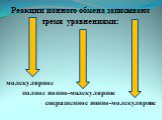
Ионные реакции – реакции протекающие между ионами в растворе. Порядок составления ионных уравнений реакции. 1. Записывают молекулярное уравнение реакции ...Физические и химические явления. Химические уравнения
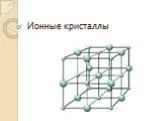
Содержание. 1. Химические и физические явления 2. Признаки протекания химических реакций 3. Условия протекания химических реакций 4. Закон сохранения ...Ионные кристаллы
Ионные кристаллы представляют собой кристаллы, состоящие из ионов, связанных между собой электростатическим притяжением. Примерами таких кристаллов ...Конспекты
Ионные уравнения реакций 8 класс
Тема:. Ионные уравнения реакций. Цель:. обобщить основы теории электролитической диссоциации, сведения учащихся об ионах и их классификациях, ...Ионные уравнения реакций
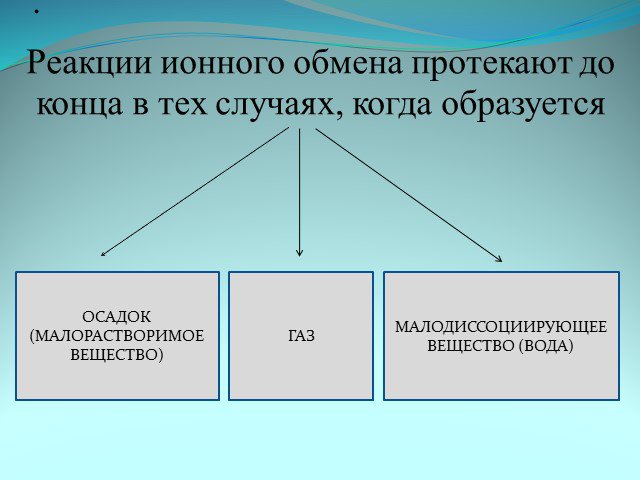
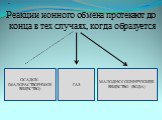
Урок №65. Тема урока:. Ионные уравнения реакций. Л.р.№13 «Примеры реакций, идущих до конца». Цели и задачи урока:. Дать представление о полных ...Ионные уравнения
Разработка урока химии по теме: «Ионные уравнения». 8 класс. . Автор урока: учитель химии ВКК МБОУ лицей №4 Шевченко Алла Вячеславовна. . Тип ...Ионные уравнения
Муниципальное базовое общеобразовательное учреждение. « Средняя общеобразовательная школа» № 2 г.Лакинска. Собинского района Владимирской области. ...Ионные уравнения
МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ. . СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №13. . Конспект урока. . по химии в 8 классе. ...Ионные реакции
Работа по разработке урока по химии. в формате ФГОС. Выполнил работу. : Учитель химии гимназии № 33 г.Краснодара. Шакирова Ильвера ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 сентября 2014
Категория:Химия
Автор презентации:Парамонов А.Ю., учитель химии
Содержит:15 слайд(ов)
Поделись с друзьями:
Скачать презентацию


















![Список источников. 1) Габриелян О.С. Химия. 8 класс: учеб. для общеобразоват. учрежд. / О.С. Габриелян. – 16 изд., стереотип. – М.: Дрофа, 2010.-270 с., [2]с.: ил. Использованы фотографии: http://900igr.net/datai/fizika/Tok-v-rastvorakh/0011-001-Skhema-elektroliticheskoj-dissotsiatsii.gif ионы хлори Список источников. 1) Габриелян О.С. Химия. 8 класс: учеб. для общеобразоват. учрежд. / О.С. Габриелян. – 16 изд., стереотип. – М.: Дрофа, 2010.-270 с., [2]с.: ил. Использованы фотографии: http://900igr.net/datai/fizika/Tok-v-rastvorakh/0011-001-Skhema-elektroliticheskoj-dissotsiatsii.gif ионы хлори](https://prezentacii.org/upload/cloud/14/09/4647/images/thumbs/screen15.jpg)