Презентация "Основные соединения серы" по химии – проект, доклад
Презентацию на тему "Основные соединения серы" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 25 слайд(ов).
Слайды презентации
Список похожих презентаций
Основные соединения кальция и их применение – вчера, сегодня, завтра
5 МЕСТО ПО РАСПРОСТРАНЕННОСТИ В ПРИРОДЕ. 100 кг кальция !!! Кальцит. Мел Мрамор Известняк. Владимирский собор. Нижегородский собор. Церковь Покрова ...Соединения серы
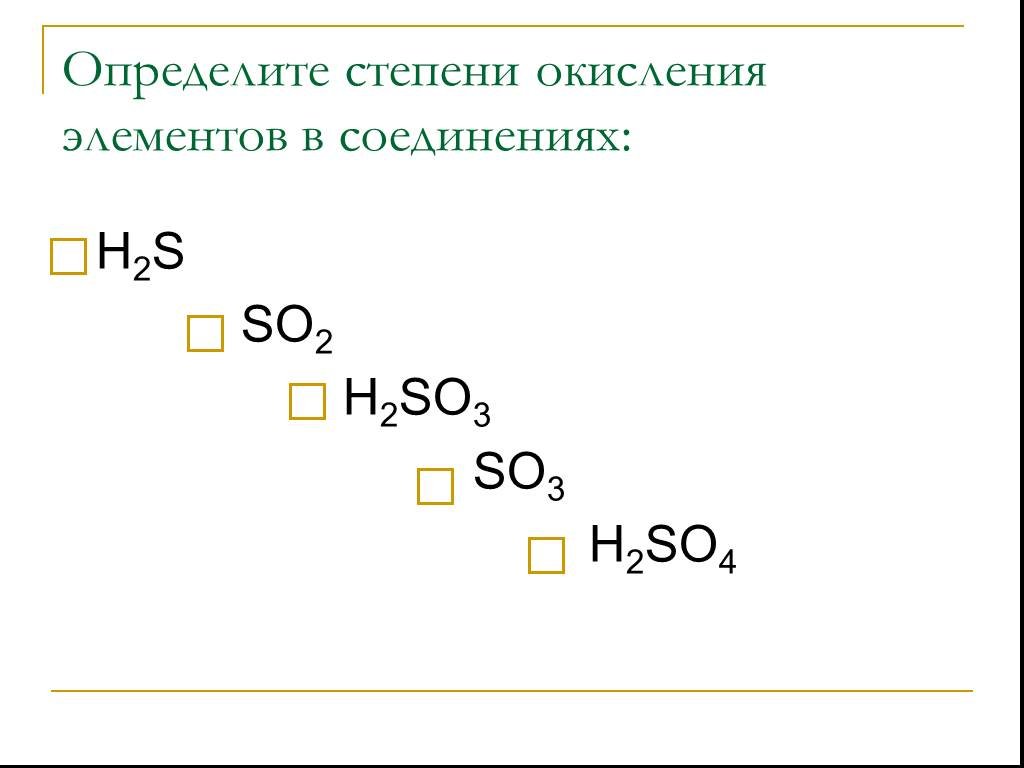
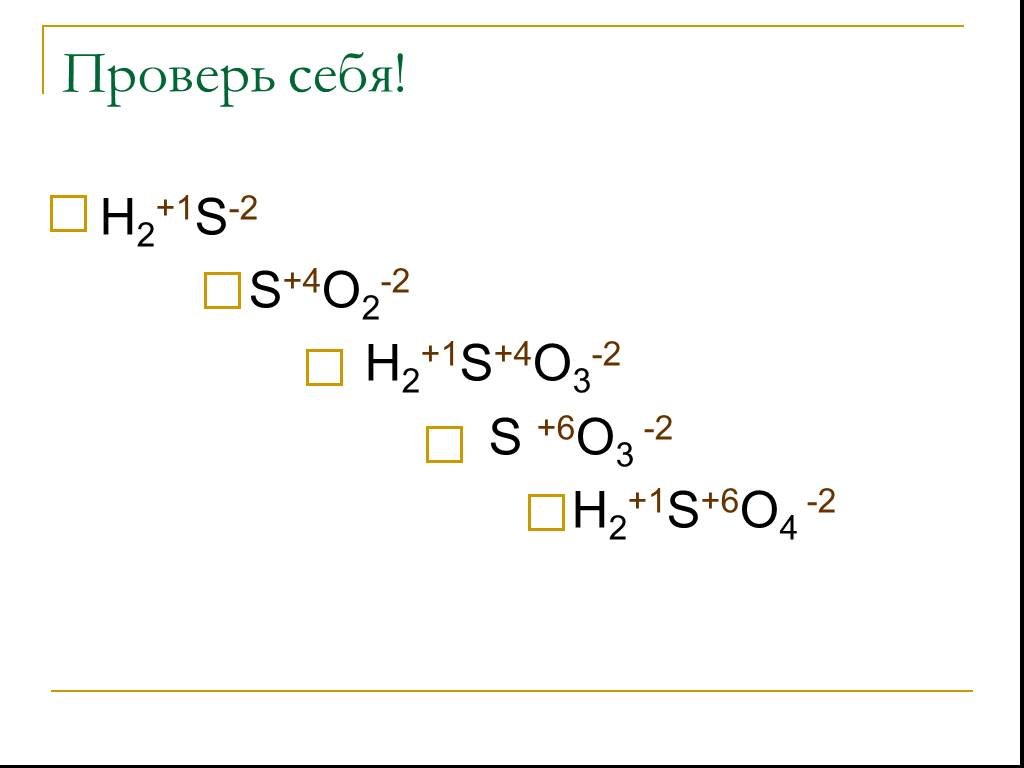
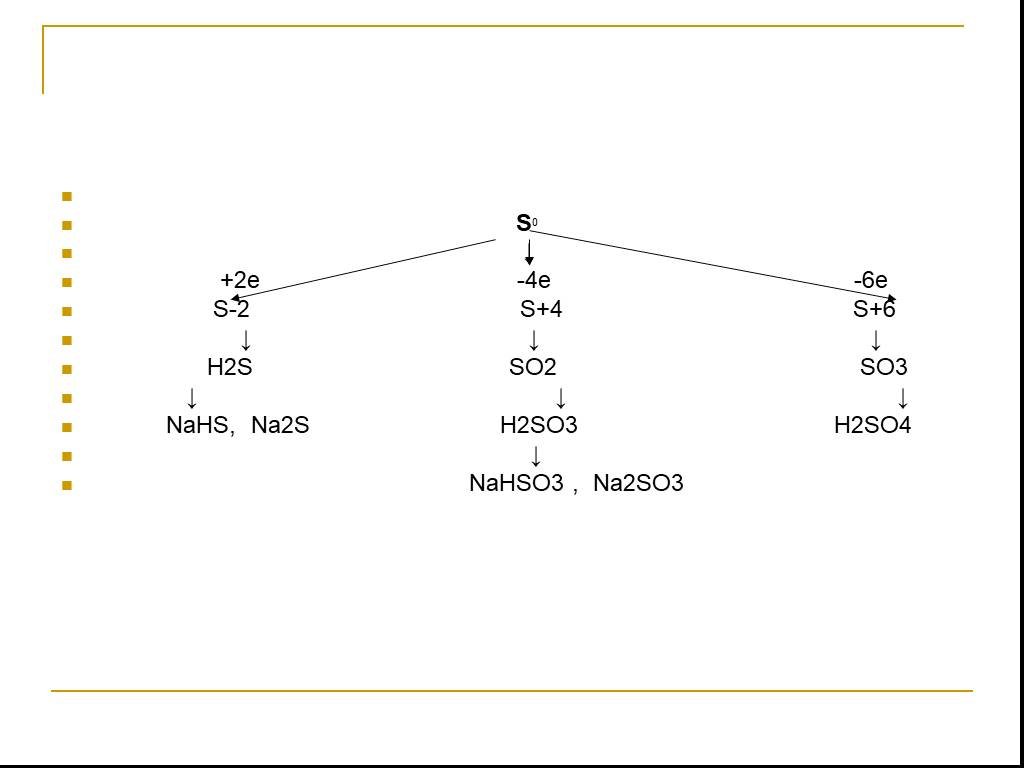
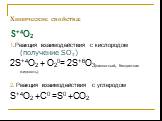
С О Е Д И Н Е Н И Я С Е Р Ы. степень окисления серы -2. Сероводород - Н2S. Сульфиды неметаллов – CS2, P2S3. Сульфиды металлов – Al2S3, K2S. Н2S СЕРОВОДОРОД. ...Соединения серы
Сероводоро́д, сернистый водород Н2S. Общие Систематическое наименование сероводород / hydrogen sulphide Химическая формула H2S Отн. молек. Масса 34.082 ...Соединения серы
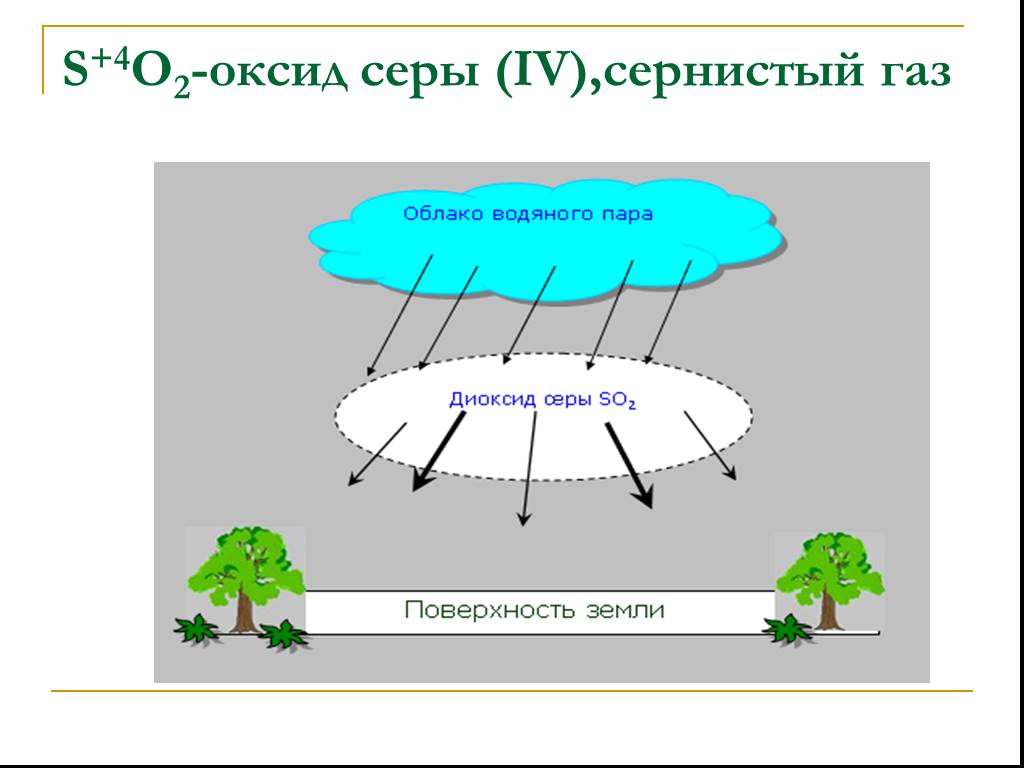
Оксид серы (VI). Физические свойства серной кислоты. Безводная серная кислота - это бесцветная маслянистая жидкость без запаха, смешивается с водой ...Важнейшие соединения серы
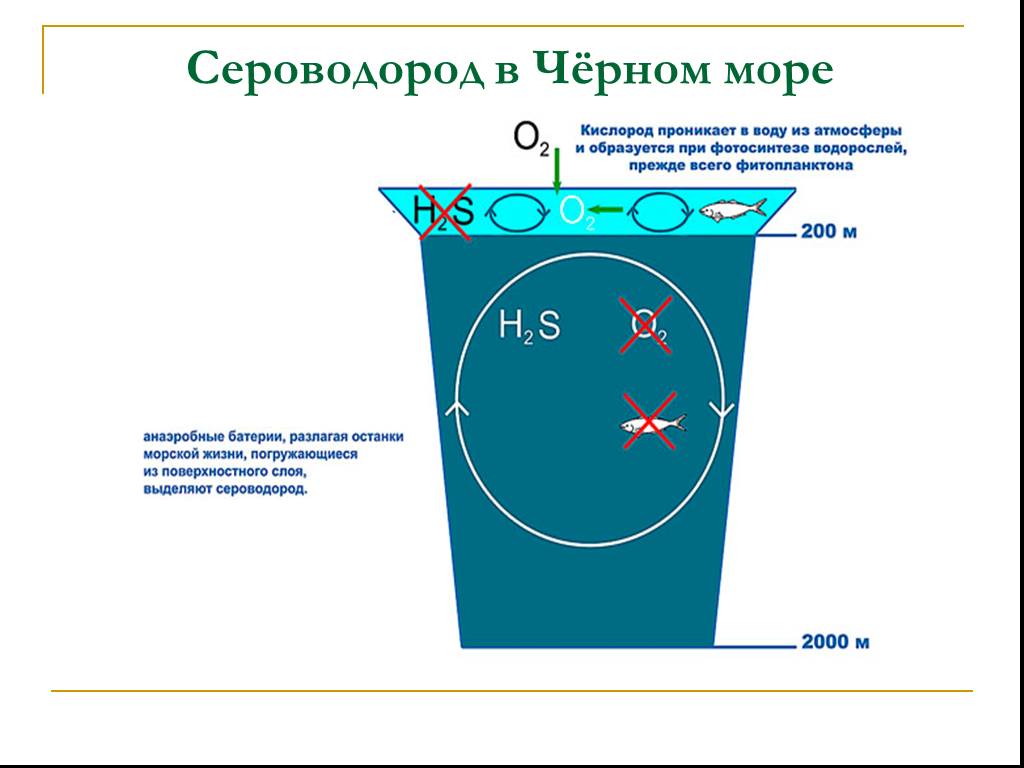
Сероводород выделяется в результате вулканической деятельности, при гниении белков животных и растений, при работе производств химической, текстильной, ...Важнейшие соединения серы
Сероводород выделяется в результате вулканической деятельности, при гниении белков животных и растений, при работе производств химической, текстильной, ...Основные классы химических соединений.
вещества простые сложные металлы неметаллы оксиды кислоты основания соли. Обобщающий урок по теме:. Основные классы химических соединений. Н2O. Углекислый ...Основные классы неорганических соединений. Генетическая связь между классами неорганических соединений
Девиз урока! Думай, работай, ищи, трудно будет -не пищи! Путешествие на подводной лодке «Генезис". соляндия основайские оксидония кислотостан. Работа ...Основные классы неорганических соединений
Вопрос 1. Укажите формулу основного оксида. А) HCI Б) K2O В)NaOH. Молодец ! следующий вопрос. Вы ошиблись ! Подумайте еще! Вопрос 2. Укажите формулу ...Основные классы неорганических веществ
Вспомним теорию. Какие вещества вы знаете? Какие вещества назы- ваются сложными? Что такое оксиды,кис- лоты,основания и соли? Распределить вещества ...Бинарные соединения
Классификация сложных веществ. Бинарные соединения – это вещества, состоящие из двух разных атомов. Как составить формулу бинарного соединения. Знать ...Сера и ее соединения
Сера и ее соединения. Цель работы: Изучение физических и химических свойства серы и ее соединений. Выявление отрицательного воздействия на окружающую ...Алюминий и его соединения
Стартовое задание. Выполнение задания А оценивается одним баллом. Выполнение задания В оценивается 2 баллами. Выполнение задания С оценивается 3 баллами. ...Водородные соединения неметаллов
метан аммиак вода сероводород кислоты. Метан. Газ без цвета и запаха, малорастворим в воде, легче воздуха, горит бледным синеватым пламенем. Смесь ...Важнейшие представители бинарных соединений – оксиды и летучие водородные соединения
Н2О - вода. СО2 углекислый газ. СУХОЙ ЛЁД. NH3 аммиак. HCL хлороводород. Бесцветный газ. Тяжелее воздуха. Хорошо растворяется в воде. Раствор хлороводорода ...Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения
SiO2 , H2O , CO2 , AI2O3 , Fe2O3 , CO. Всесильная стихия природы-вода во все времена, во все периоды истории покоряла ум и воображение людей. Человек ...Бинарные соединения
17.09.2018. Бинарные соединения: определение. Многообразие природных бинарных соединений. Вода Хлорид натрия Углекислый газ. Бинарные вещества состоят ...Бинарные соединения
ОПРЕДЕЛЕНИЕ. Бинарные соединения – это соединения, состоящие из двух химических элементов. H2O, NH3, K2S, P2O5, CaC2. Бинарные соединения - хлориды. ...Основные понятия и законы химии
стратегия успеха. посещение, работа на лабораторных занятиях и своевременное оформление отчетов. посещение, восприятие и записывание материала лекций. ...Все о железе и его соединения
Урок-проект в 9 классе подготовила Яскевич В.А. учитель химии МОУ «Кадетская школа «Патриот» г.Энгельса 2010 г. План изучения вещества. Железо как ...Конспекты
Сера и ее соединения. Аллотропия серы. Сероводород. Оксиды серы
Тема: Сера и ее соединения. Аллотропия серы. Сероводород. Оксиды серы (. IV, VI. ). . Цели урока:. рассмотреть вещество «сера», аллотропию серы, ...Кислородные соединения серы
Тема урока: Кислородные соединения серы. Цель урока. : 1. Контроль и оценка усвоения учащимися изученного материала. 2. Способствовать развитию ...Основные положения теории электролитической диссоциации
Дисциплина: химия. План-конспект методической разработки урока. . с пояснениями по использованию материала. . в практической деятельности ...Основные сведения о строении атома
лицей № 9. имени заслуженного учителя школы Российской Федерации А.Н.Неверова Дзержинского района г. Волгограда. Конспект ...Основные классы неорганических соединений
Муниципальное общеобразовательное учреждение. «Стрелецкая средняя общеобразовательная школа. Белгородского района Белгородской области имени Героя ...Основные классы неорганических соединений
Урок-повторение по теме. «Основные классы неорганических соединений». Цель урока:. систематизировать знания учащихся по теме «Основные классы ...Основные классы неорганических веществ
Тема урока: Генетическая связь между основными классами неорганических соединений. Система целей к уроку. . Доминирующая дидактическая цель (ОДЦ):. ...Основные классы неорганических веществ
ТЕМА № 5. «Основные классы неорганических веществ» (9 часов). Урок № 3. (35). Тема: Физические и химические свойства оснований. Реакция нейтрализации. ...Типы химических реакций: соединения, разложения
. Муниципальное бюджетное общеобразовательное учреждение. «Харьковская средняя общеобразовательная школа. . Ровеньского района Белгородской ...Алюминий и его соединения
Технологическая карта урока по химии. подготовила учитель химии МБОУ СОШ № 1 г.Тимашевск. . ИСПАЛОВА НАТАЛЬЯ СЕРГЕЕВНА. Тема урока. . Алюминий ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:15 февраля 2019
Категория:Химия
Содержит:25 слайд(ов)
Поделись с друзьями:
Скачать презентацию