Слайд 1Методическая разработка раздела «Изменения, происходящие с веществами» образовательной программы «Химия»
Разработала: учитель химии МОУ СОШ №5 г. Дзержинска Мартынова Людмила Феофановна
г. Дзержинск 2010 г.
Слайд 2Представители педагогической науки
А.В.Дистервег /29.10.1790 – 07.07.1866/
В.А.Сухомлинский /28.09.1918 – 02.09.1970/
К.Д.Ушинский /19.02.1824 – 22.12.1870/
Д.И.Менделеев /27.01.1834 – 20.01.1907/
А.М. Бутлеров /03.09.1828 – 05.08.1886/
П.Н.Лебедев /24.02.1866 – 01.03.1912/
И.И.Мечников /03.05.1845 – 02.07.1916/
И.М.Сеченов /01.08.1829 – 02.11.1905/
Химия – наука о веществах, их свойствах и превращениях
Химическая реакция - превращение, в результате которого из одних веществ получаются другие, новые вещества, отличающиеся от исходных по составу и свойствам

Слайд 3Пояснительная записка
Методическая разработка темы «Изменение, происходящие с веществами» предназначена для учащихся 8 классов. Она составлена на основе программы курса химии для 8-11 классов общеобразовательных учреждений автора О.С.Габриелян. Тема является одной из важных курса химии, так как знание типов химических реакций и закона сохранения массы веществ дает возможность управлять превращениями веществ, находить экономически безопасные способы производства веществ и материалов и охраны окружающей среды от химических загрязнений. Освоение важных знаний и овладение умениями и навыками по теме служит фундаментом для изучения дальнейшего курса химии.
Слайд 4Актуальность понятие
Химическая реакция
Форма движения материи
Формирование целостной картины мира
основное важное
Слайд 5Принципы отбора содержания
преемственность
принцип доступности и последовательности
принцип научности
формирование предметной компетенции
единство содержания и методики преподавания
учёт возрастных особенностей учащихся
принцип познавательной активности, самостоятельности, творчества
принцип разнообразия учебной деятельности
формирование рефлексивных качеств
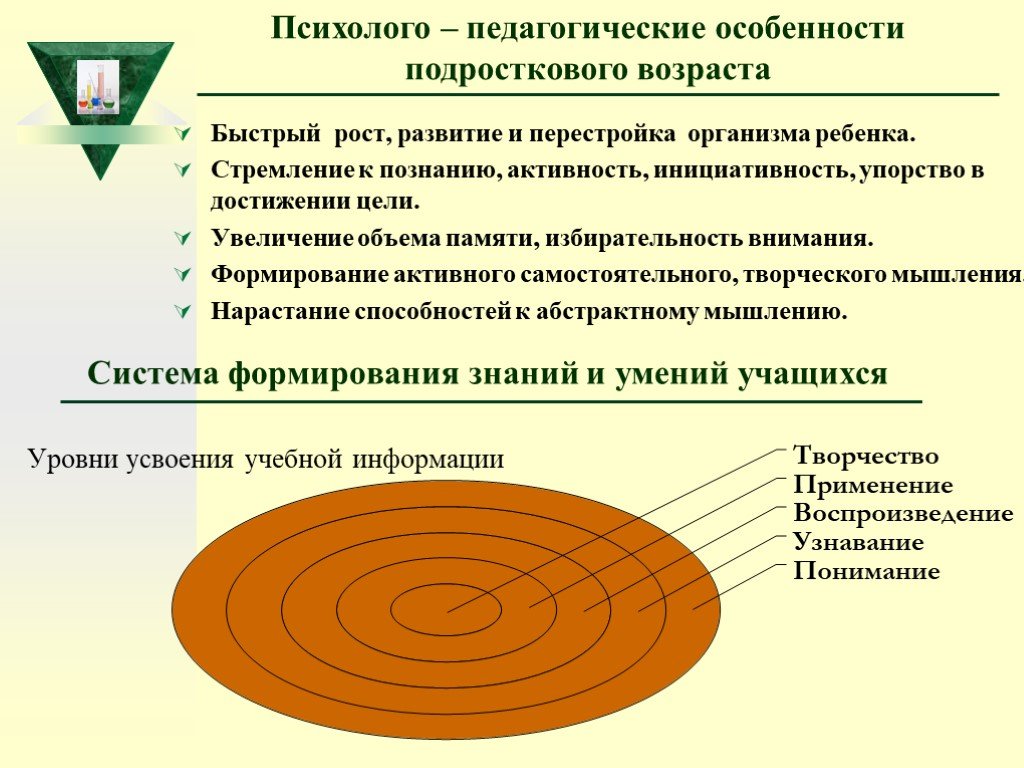
Слайд 6Система формирования знаний и умений учащихся
Уровни усвоения учебной информации
Психолого – педагогические особенности подросткового возраста
Быстрый рост, развитие и перестройка организма ребенка. Стремление к познанию, активность, инициативность, упорство в достижении цели. Увеличение объема памяти, избирательность внимания. Формирование активного самостоятельного, творческого мышления. Нарастание способностей к абстрактному мышлению.

Слайд 7Система деятельности учителя по формированию знаний и умений
Формирование знаний учебного материала. Формирование умений и навыков. Формирование понимания изучаемого материала. Развитие внимания. Развитие мировоззрения.
Постановка цели
Организация деятельности
Формирование знаний учебного материала
- Найдите в тексте ключевые слова. - Разбейте текст на смысловые части. - Найдите дополнительный материал в других источниках информации.
Формирование понимания изучаемого материала
- Составьте вопросы по данной теме. - Ответьте на вопросы, отражающие причинно-следственные связи: «Почему?», «Зачем?» - Перекодируйте словесную информацию в виде схемы, таблицы.
Формирование умений и навыков
- Установите, какие знания необходимо использовать для выполнения данного задания. - Ответьте на вопрос «Почему?» и «Как?», связанные с каким-либо действием и способом его осуществления.
Развитие внимания
- Найдите ошибку в тексте, схеме, ответе одноклассника. - Установите последовательность каких-либо действий.
Развитие мировоззрения
- Привести примеры объектов или процессов действительности, описываемых данным явлением. - Составить содержательную прикладную задачу.

Слайд 8Цели обучения
Познакомить учащихся с классификацией химических реакций и основным законом химии (закон сохранения массы веществ). Научить различать физические и химические явления, составлять уравнения химических реакций, определять типы химических реакций, делать вычисления по химическим уравнениям реакций. Совершенствовать умения обращаться с химической посудой и лабораторным оборудованием. Показать возможность использования приобретенных знаний и умений в практической деятельности и повседневной жизни для безопасного обращения с веществами и материалами; очистки загрязненных веществ от примесей.
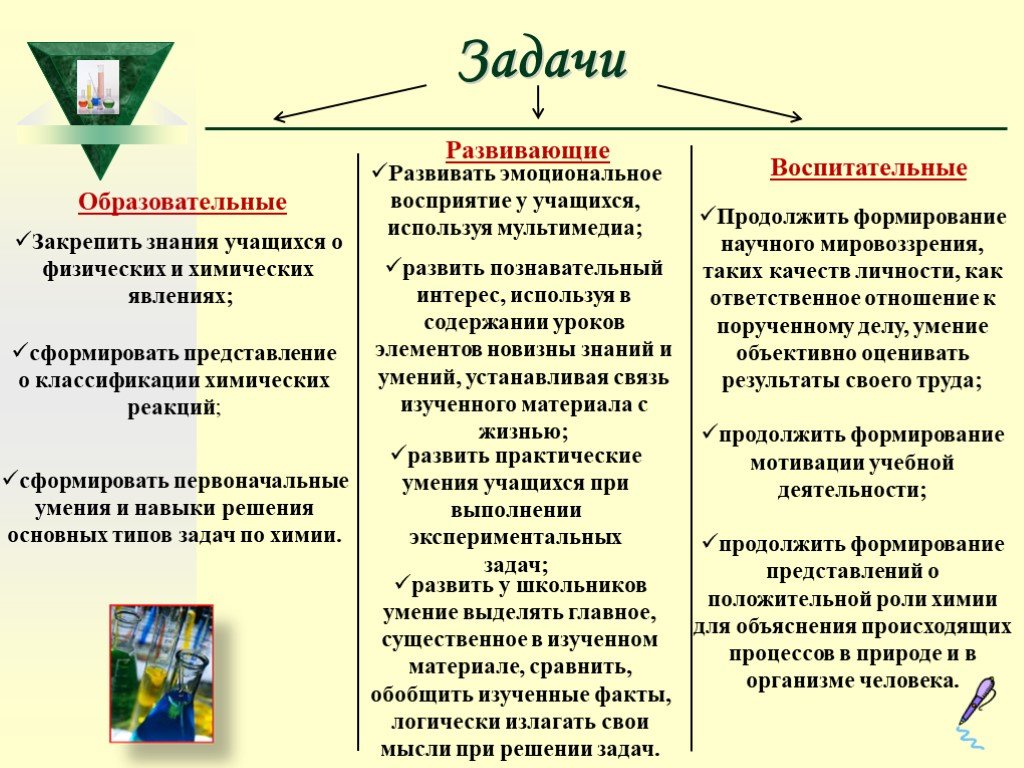
Слайд 9Задачи Образовательные Развивающие Воспитательные
Закрепить знания учащихся о физических и химических явлениях;
сформировать представление о классификации химических реакций;
сформировать первоначальные умения и навыки решения основных типов задач по химии.
Развивать эмоциональное восприятие у учащихся, используя мультимедиа;
развить познавательный интерес, используя в содержании уроков элементов новизны знаний и умений, устанавливая связь изученного материала с жизнью;
развить практические умения учащихся при выполнении экспериментальных задач;
развить у школьников умение выделять главное, существенное в изученном материале, сравнить, обобщить изученные факты, логически излагать свои мысли при решении задач.
Продолжить формирование научного мировоззрения, таких качеств личности, как ответственное отношение к порученному делу, умение объективно оценивать результаты своего труда; продолжить формирование мотивации учебной деятельности; продолжить формирование представлений о положительной роли химии для объяснения происходящих процессов в природе и в организме человека.

Слайд 10Результаты обучения
Будут знать Будут уметь
сущность химических реакций
классификацию химических реакций по различным признакам
взаимосвязь химических превращений между неорганическими и органическими веществами
распознавать химические реакции по типам
объяснять механизмы протекания химических реакций
решать задачи различных типов
Слайд 11Технология и формы организации деятельности
Классно-урочная система
урок
домашняя работа внеклассная работа
Лекционно-семинарская система
лекция семинар зачёт консультация
практикум экзамены собеседование
ИКТ (информационно коммуникативные технологии) Здоровьесберегающие технологии
(комбинированный, сообщения новых знаний, формирования и закрепления умений и навыков, обобщающий, контрольный )
внеурочная работа экскурсии
Формы организации учебной деятельности фронтальная индивидуальная парная групповая

Слайд 12Система контроля Самостоятельные работы Практическая работа Контрольная работа Тестирование
Методы организации учебно-познавательной деятельности
По источнику передачи и восприятию учебной информации: словесные(рассказ, беседа, лекция, диспут, конференция); наглядные (наблюдение, демонстрация); практические (лабораторные, практические работы) По степени самостоятельности и активности мышления учащихся: репродуктивный (беседа, работа с книгой, устное изложение, наблюдение), продуктивный (проблемное, частично-поисковое, исследовательское, экспериментальное изложение) По логике передачи и восприятию учебной информации: дедуктивные (от общего к частному),индуктивные (от частного к общему
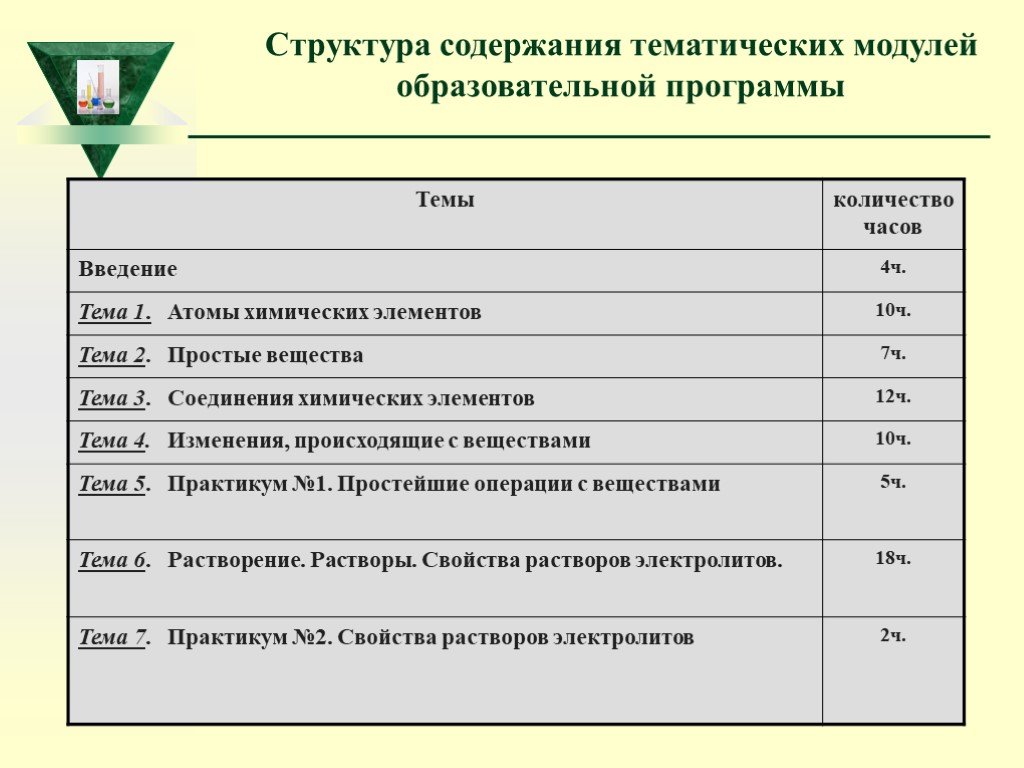
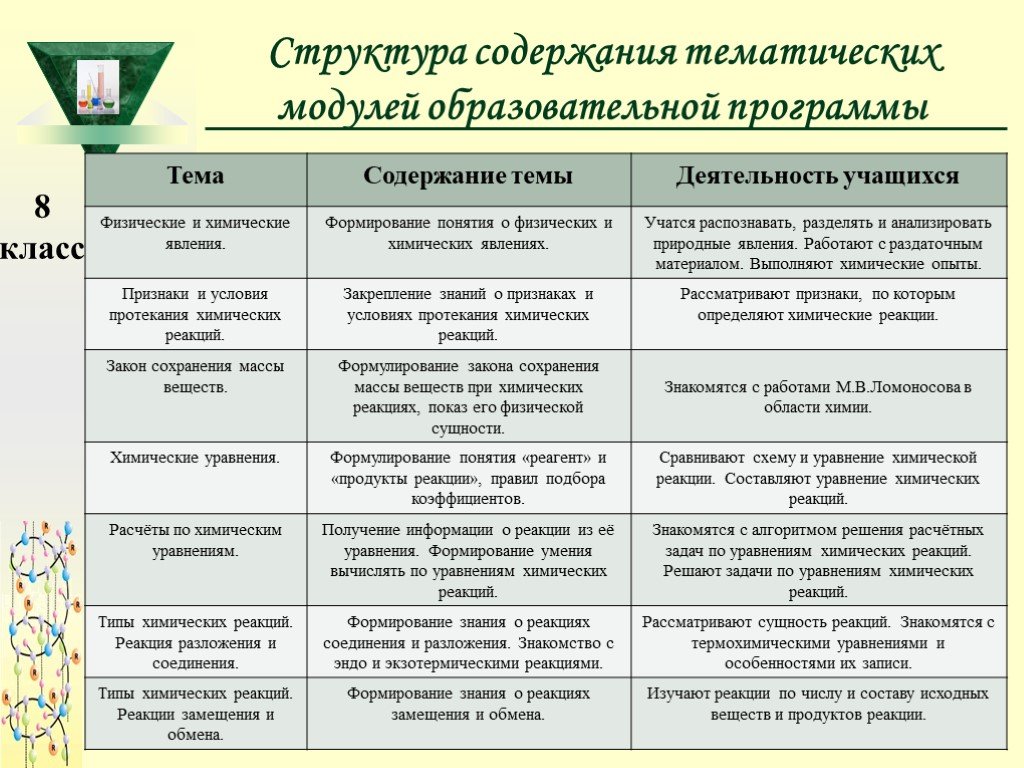
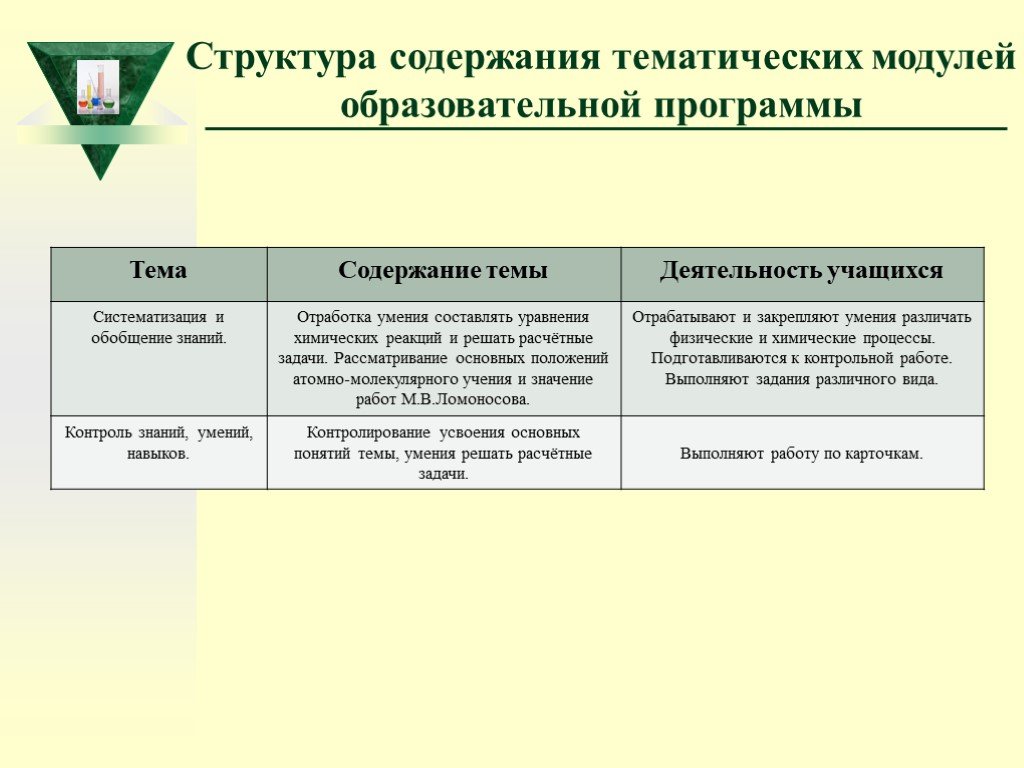
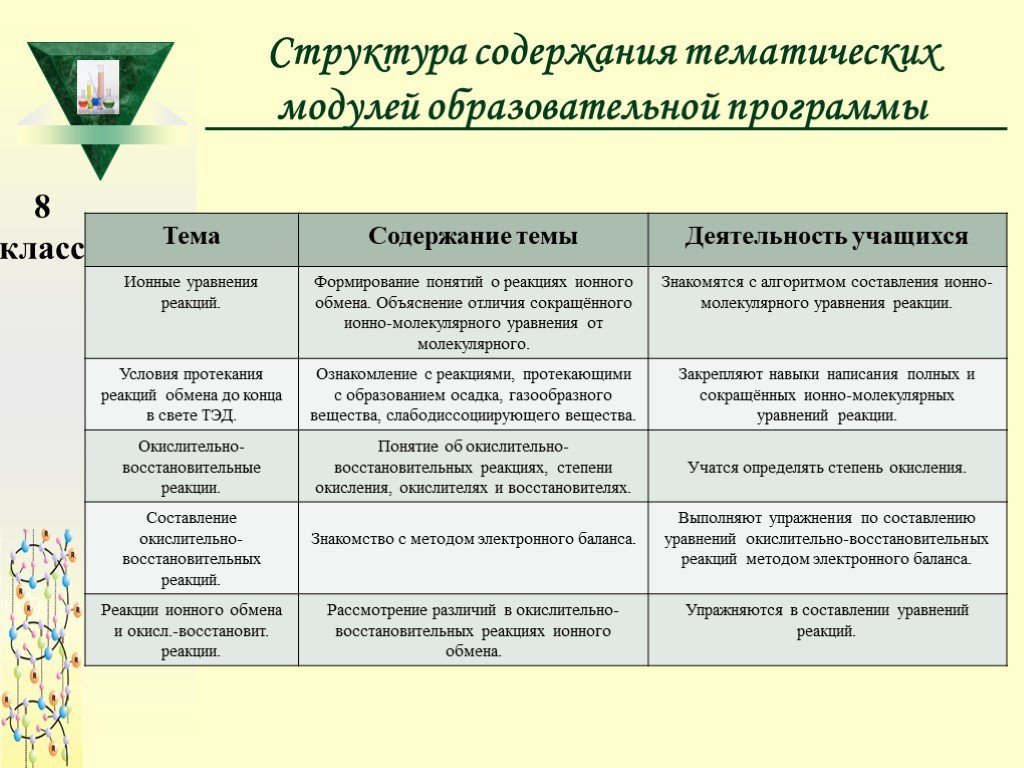
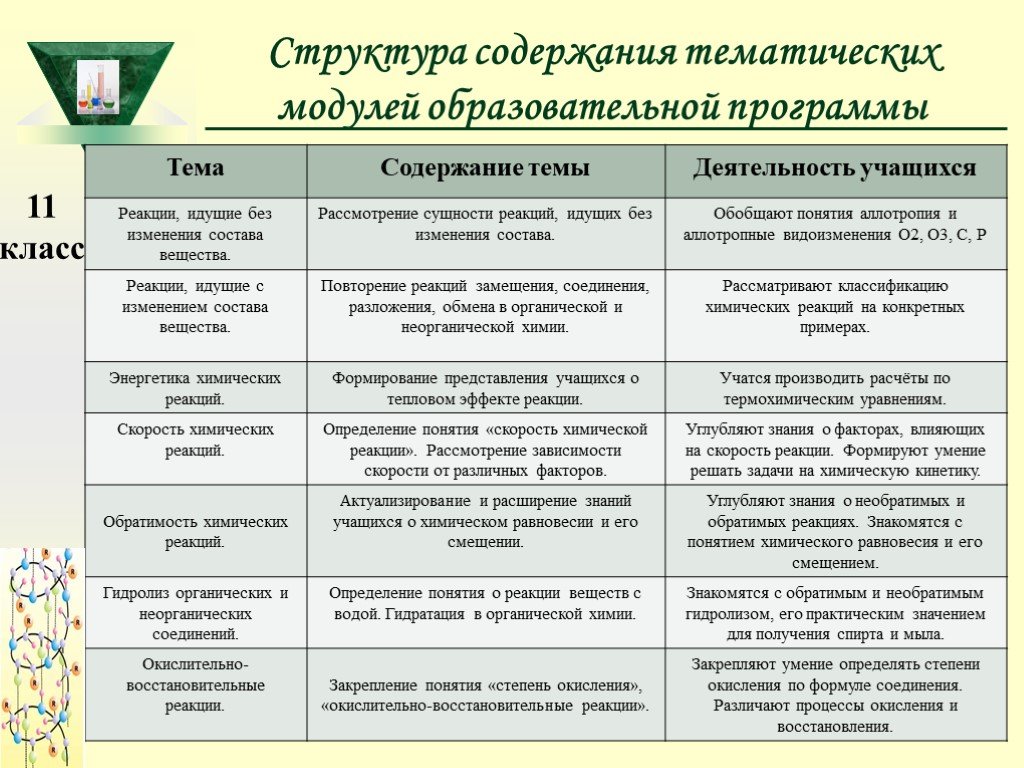
Слайд 13Структура содержания тематических модулей образовательной программы
Слайд 14Общий учебно-тематический план
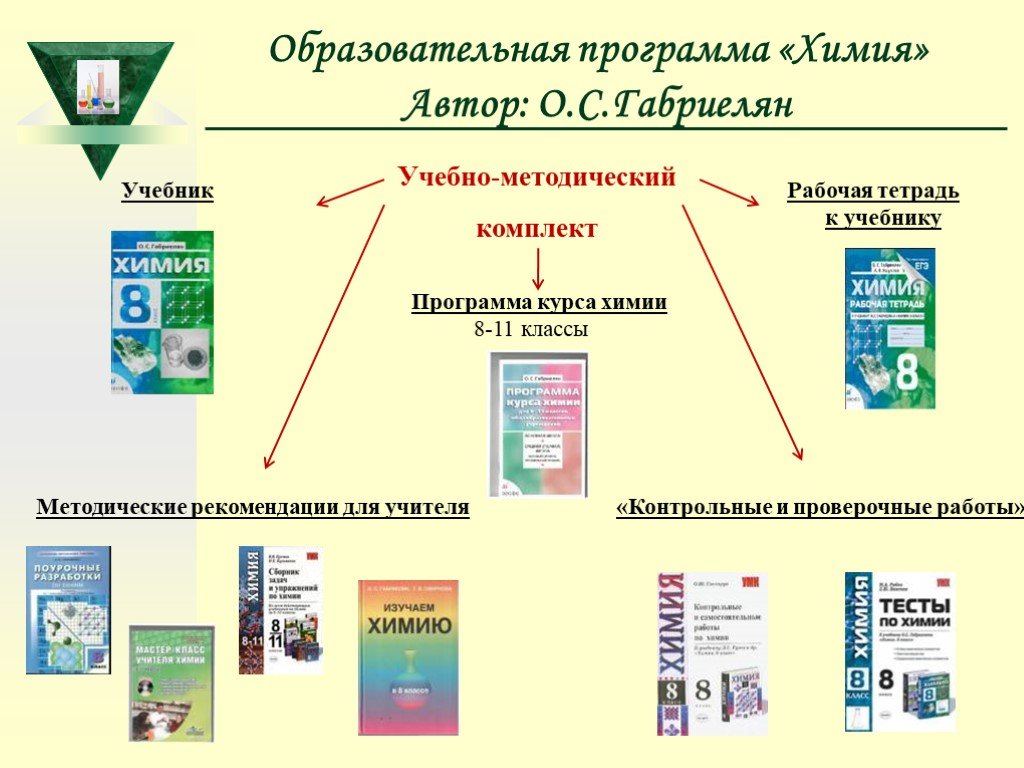
Слайд 20Образовательная программа «Химия» Автор: О.С.Габриелян
Учебно-методический комплект
Учебник
Рабочая тетрадь к учебнику
Программа курса химии 8-11 классы
Методические рекомендации для учителя
«Контрольные и проверочные работы»
Слайд 21Приемы, используемые на разных этапах урока

Слайд 22Этапы уроков РОП
Урок 1: Физические явления.
Цель: Сформировать понятия о физических явлениях.
Методические рекомендации
2) Демонстрация опытов учителем с использованием фронтальной беседы о происходящих явлениях - плавление парафина ; - растворение перманганата калия; - возгонка йода; - диффузия душистых веществ.
3) Выполнение лабораторного опыта «Сравнение скорости испарения воды и спирта по исчезновению их капель на фильтровальной бумаге» учащимися в парах нанесение пипеткой капель воды и спирта на фильтровальную бумагу; замечают время исчезновения капель воды и спирта с фильтровальной бумаги; оформление вывода в рабочих тетрадях.
Изучение нового материала:
1)Актуализация знаний на основе повторения материала о природных явлениях по вопросам. Вопросы: Какие явления можно наблюдать в природе? Приведите примеры таких явлений. По каким признакам их можно разделить на группы? Приведите примеры. В чём особенность природных явлений в каждой группе?
Задачи: Показать способы разделения смесей и области применения этих способов в быту. Дать понятия о физических явлениях в химии.

Слайд 23Закрепление знаний:
Просмотр презентации об очистке воды в городе Дзержинске (фильм прилагается). Беседа по презентации с целью проверки усвоения знаний. Работа в паре по заданиям в рабочей тетради (стр.88-89) Габриеляна с последующей взаимопроверкой: - записать определение; - назвать физические свойства веществ; - записать об использовании физических явлений в быту и народном хозяйстве; - определить оборудование для разделения смесей.
4) Самостоятельная работа с текстом и рисунками учебника
Слайд 24Д/З 1) изучить текст § 25 стр. 129-134 2) выполнить письменно упражнения № 3, 6 3) подготовить сообщения, презентации об очистке воды в домашних условиях
4) Работа с занимательным материалом

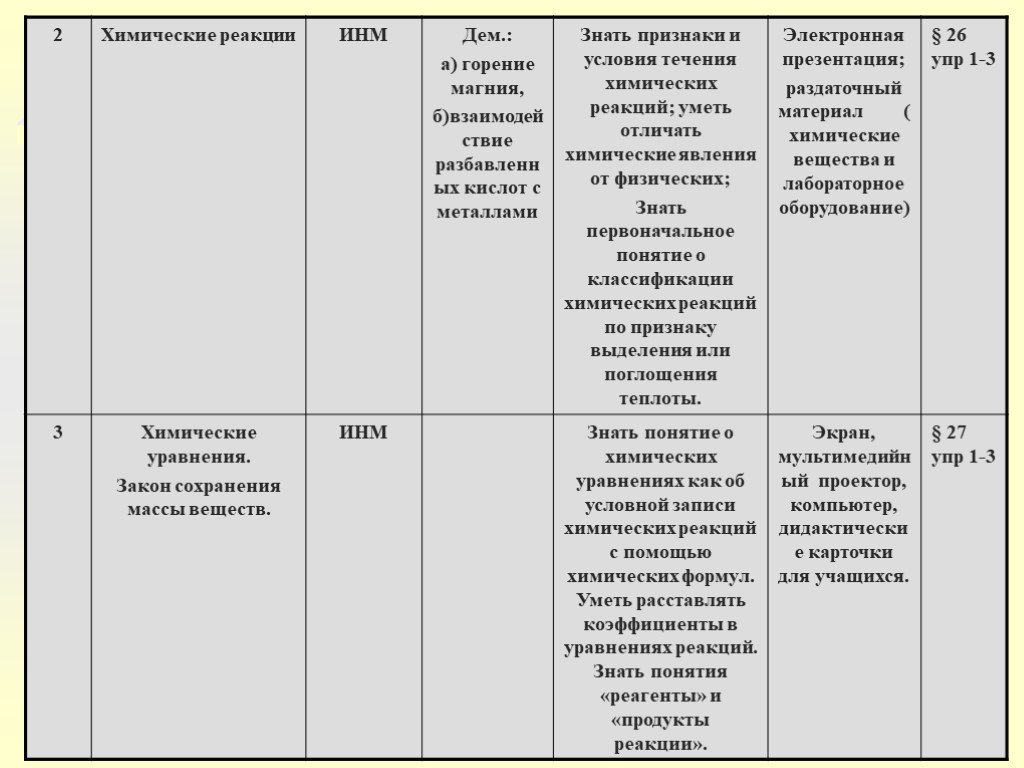
Слайд 25Урок 2: Химические реакции.
Цель: Сформировать понятие о химических реакциях, их отличий от физических
Задачи: - Познакомить с признаками и условиями протекания химических реакций. Показать различия реакций экзо и эндотермических реакций. Дать определение реакциям горения.
Проверка и закрепление ранее полученных знаний:
Открытый тестовый диктант - Фильтрование применяют для разделения смесей, если компоненты обладают: а) различной растворимостью; б) различной температурой кипения; в) различными размерами частиц; г) различной массой - Выпаривание применяют для выделения веществ из смеси, если компоненты обладают: а) различной плотностью; б) различным агрегатным состоянием; в) различной растворимостью; г) различной температурой кипения. - Методами отстаивания и фильтрования можно разделить смесь: а) растительного масла и воды; б) поваренной соли и воды; в) речного песка и воды

Слайд 263) Формулировка вывода о значении чистой воды для организма человека.
2) Просмотр презентаций учащихся об очистке воды в домашних условиях.
Актуализация знаний в ходе беседы на основе повторения материала о природных явлениях: - Как называются изменения, происходящие в природе? - Какие группы явлений вы помните? - Что происходит при физических явлениях? - На каких различиях в свойствах веществ основаны способы разделения?
2) Объяснение учителем основных понятий темы: химические реакции, их сущность, признаки, условия протекания.

Слайд 273) Демонстрация опытов учителем: - горение магния; - горение фосфора; - взаимодействие соляной кислоты с мелом; - получение гидроксида меди (11) и растворение его в кислотах
4) Повторение правил техники безопасности при работе с лабораторным оборудованием и реактивами
(а) тушить спиртовку только колпачком; (б) запрещается зажигать одну спиртовку от другой, передавать спиртовку в зажженном виде; (в) запрещается пробовать вещества на вкус; (г) запрещается брать вещества руками; (д) запрещается выливать или высыпать остатки реактивов в склянки и банки, из которых они были взяты;
(е) запрещается менять пробки и пипетки от различных банок или склянок; (ж) работать только над столом; (з) смыть водой, затем нейтрализующим веществом реактив, если он попал на кожу или одежду; (и) собирайте остатки веществ в специально предназначенную посуду

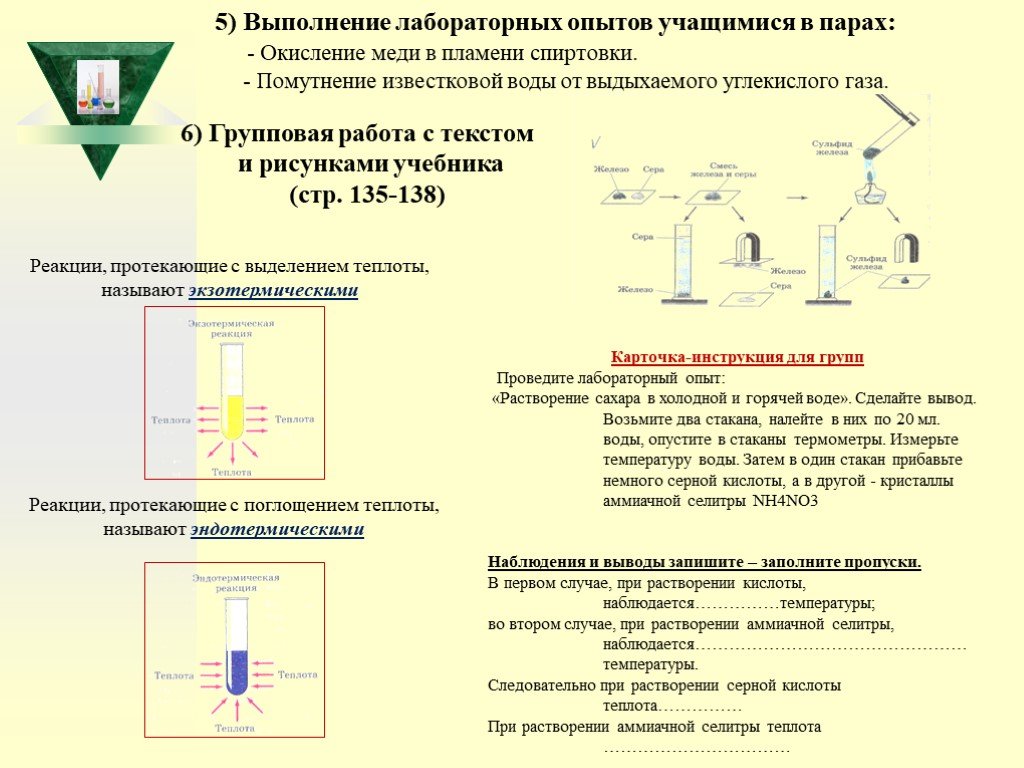
Слайд 286) Групповая работа с текстом и рисунками учебника (стр. 135-138)
Реакции, протекающие с выделением теплоты, называют экзотермическими
Реакции, протекающие с поглощением теплоты, называют эндотермическими
5) Выполнение лабораторных опытов учащимися в парах: - Окисление меди в пламени спиртовки. - Помутнение известковой воды от выдыхаемого углекислого газа.
Карточка-инструкция для групп Проведите лабораторный опыт: «Растворение сахара в холодной и горячей воде». Сделайте вывод. Возьмите два стакана, налейте в них по 20 мл. воды, опустите в стаканы термометры. Измерьте температуру воды. Затем в один стакан прибавьте немного серной кислоты, а в другой - кристаллы аммиачной селитры NН4NO3 Наблюдения и выводы запишите – заполните пропуски. В первом случае, при растворении кислоты, наблюдается……………температуры; во втором случае, при растворении аммиачной селитры, наблюдается………………………………………… температуры. Следовательно при растворении серной кислоты теплота…………… При растворении аммиачной селитры теплота ……………………………

Слайд 29Реакции, протекающие с выделением теплоты и света называются - РЕАКЦИЯМИ ГОРЕНИЯ Реакции, протекающие с выделением теплоты, называются – ЭКЗОТЕРМИЧЕСКИМИ (+Q) 4Al+3O2=2Al2O3+Q Протекающие с выделением теплоты – ЭНДОТЕРМИЧЕСКИМИ (-Q) N2+O2 2NO-Q
Слайд 30Заполните схему: Проверьте себя
1) Беседа с составлением схемы о распределении природных явлений с дальнейшей самопроверкой по данному образцу
Д/З 1) изучить текст § 26 2) выполнить письменно упражнения №1-3
2) Решение проблемной задачи урока в процессе заполнения таблицы, на основе полученных знаний
3) Индивидуальная работа в тетрадях Габриеляна с использованием текста учебника

Слайд 31Урок 3: Химические уравнения. Закон сохранения массы веществ.
Цель: Показать количественную сторону химических реакций, значение закона сохранения массы веществ, роль Ломоносова в открытии этого закона.
Задачи: Научить составлять химические уравнения, пользуясь законом сохранения массы веществ. Дать понятие индекса и коэффициента.
Укажите химические явления:
а) Распространение запаха духов; б) Ржавление железа; в) Испарение воды; г) Получение сахарной пудры из кристаллов сахара; д) Гниение растительных остатков; е) Почернение серебряных изделий.
Примеры химических явлений: б) ржавление железа; д) гниение растительных остатков; е) почернение серебряных изделий. Запомните: химические явления называют также химическими реакциями Ответьте на вопрос: как вы определили, что данные явления - химические?
1) Тематический диктант

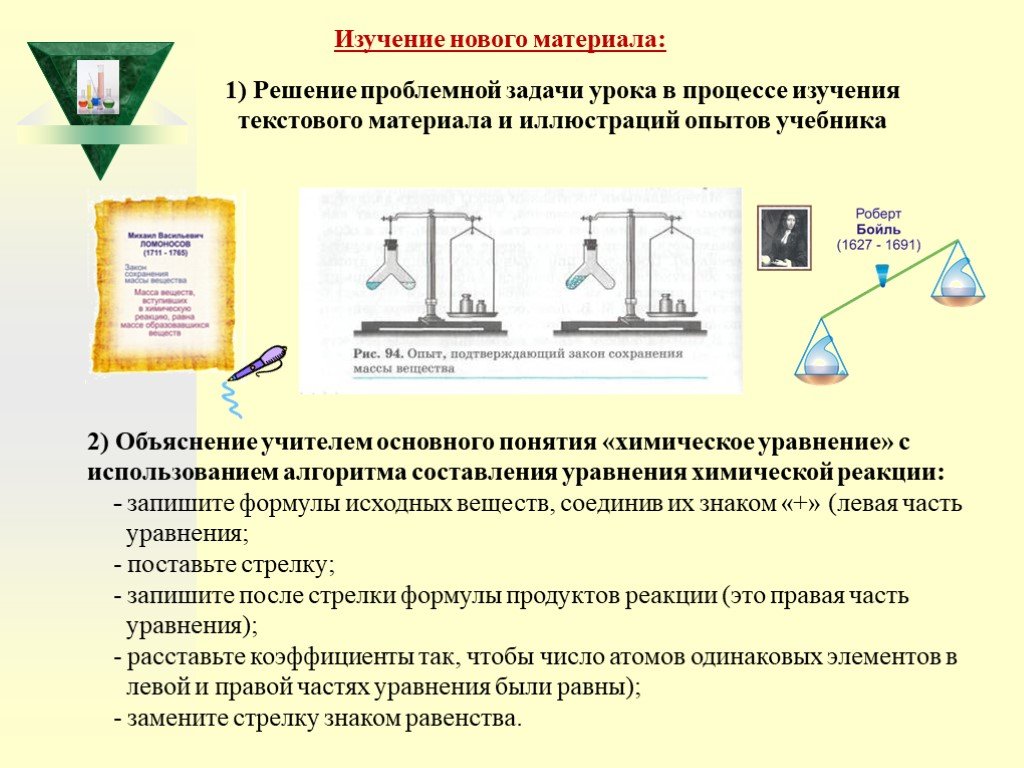
Слайд 321) Решение проблемной задачи урока в процессе изучения текстового материала и иллюстраций опытов учебника
2) Объяснение учителем основного понятия «химическое уравнение» с использованием алгоритма составления уравнения химической реакции: - запишите формулы исходных веществ, соединив их знаком «+» (левая часть уравнения; - поставьте стрелку; - запишите после стрелки формулы продуктов реакции (это правая часть уравнения); - расставьте коэффициенты так, чтобы число атомов одинаковых элементов в левой и правой частях уравнения были равны); - замените стрелку знаком равенства.
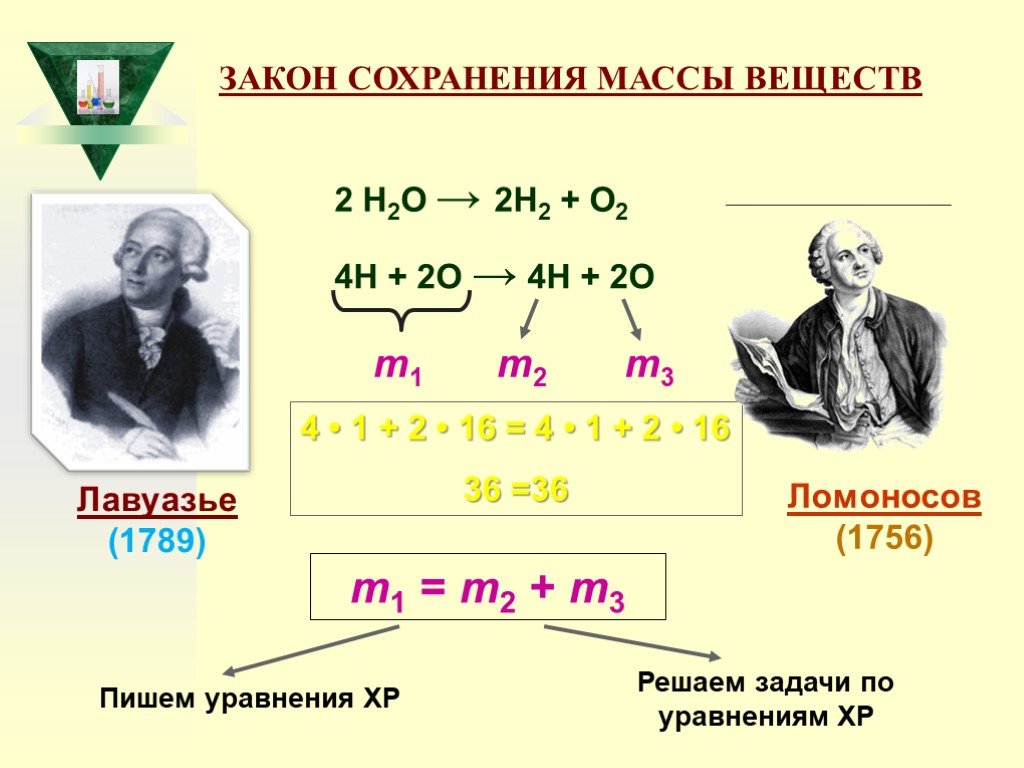
Слайд 33ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ
2 Н2О → 2Н2 + О2 4Н + 2О → 4Н + 2О m1 m2 m3 m1 = m2 + m3 Лавуазье (1789) Ломоносов (1756)
Пишем уравнения ХР
Решаем задачи по уравнениям ХР
4 • 1 + 2 • 16 = 4 • 1 + 2 • 16 36 =36
Слайд 343) Объяснение учителем понятий «индекс» и «коэффициент» в химическом уравнении
Сульфат натрия + хлорид бария → хлорид натрия + сульфат бария Азот + кислород → оксид азота (V) Алюминий + … → бромид алюминия (III) … + … → фосфид цинка (II) Расставьте коэффициенты в схемах реакций. В каком уравнении сумма коэффициентов равна 7
1) Индивидуальная работа с дидактическим материалом по отработке умений составлять химические уравнения
Д/З 1) повторить текст параграфа 27 2) выполнить письменно задания №1-3

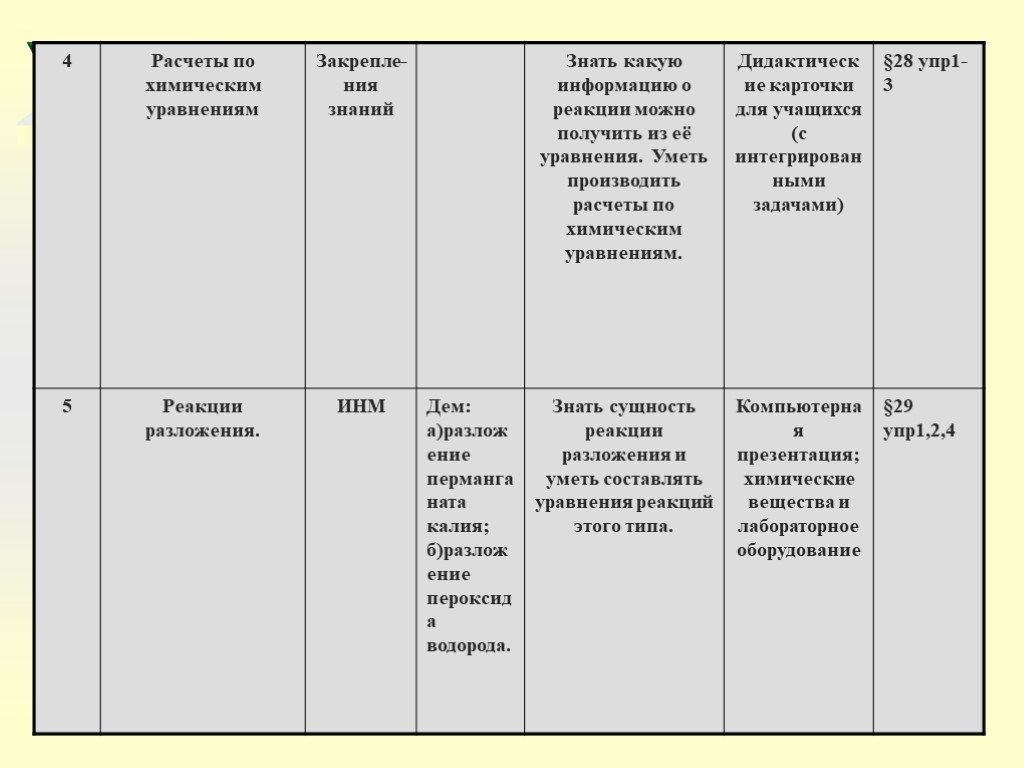
Слайд 35Урок 4: Расчёты по химическим уравнениям
Цель: Научить решать задачи с использованием понятий «количество вещества», «массы и объёма вещества».
Задачи: - Рассмотреть решение задач с вычислением по химическим уравнениям массы и количества вещества по известной массе или количеству вещества . Рассмотреть решение задач на вычисление массы, количества, объёма вещества продукта реакции, если известна масса исходного вещества, содержащая определённую долю примесей.
Методические рекомендации:
Проверка и закрепление ранее полученных знаний: Парная работа со взаимоконтролем по теме «Химические уравнения» в рабочих тетрадях Габриеляна – стр. 91-93
Разбор задач с использованием текста и алгоритма решения задач - чтение текста задачи; - выбор данных; - решение задачи по алгоритму; - запись ответа задачи.
Закрепление материала: Групповая работа по составлению задач.
Д/З Повторить параграф 28 Решить задачи 1-3

Слайд 361. Определённый вид атомов называется химическим элементом. 2. Вещества делятся на простые и сложные 3. Явления, в результате которых изменяются размеры, формы тел или агрегатные состояния называются физическими. 4. Химические – это явления, в результате которых из одних веществ образуются другие. 5. Реакции, идущие с поглощением тепла – называются эндотермические. 6. Экзотермические – это реакции, идущие с выделением тепла.
?
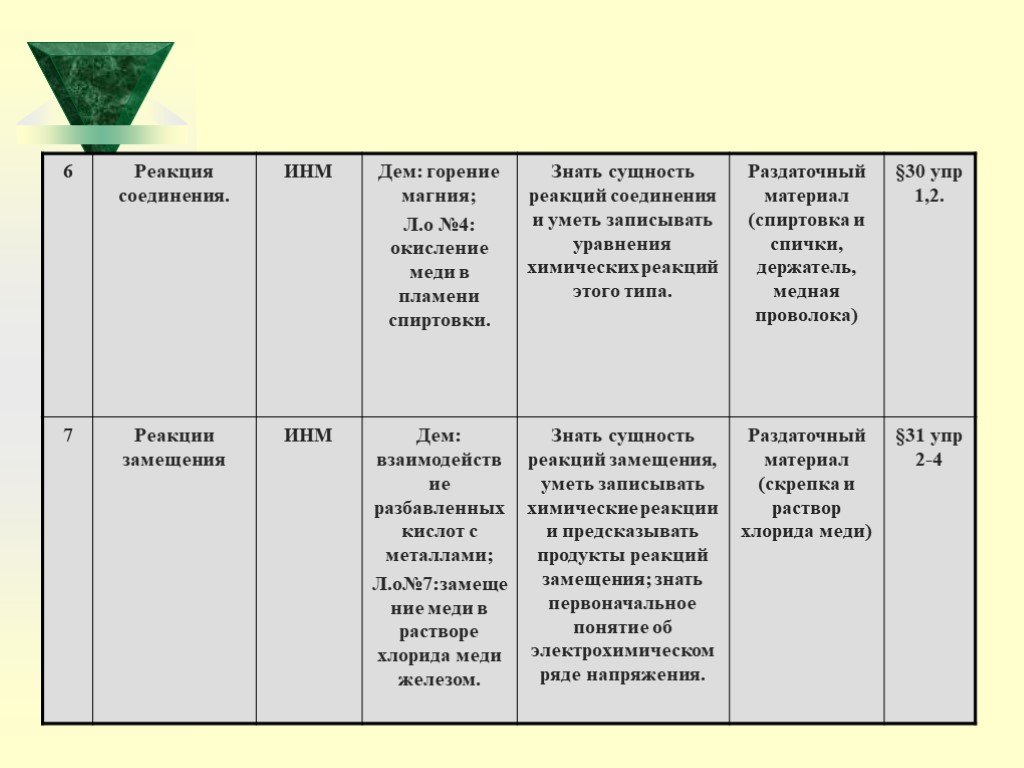
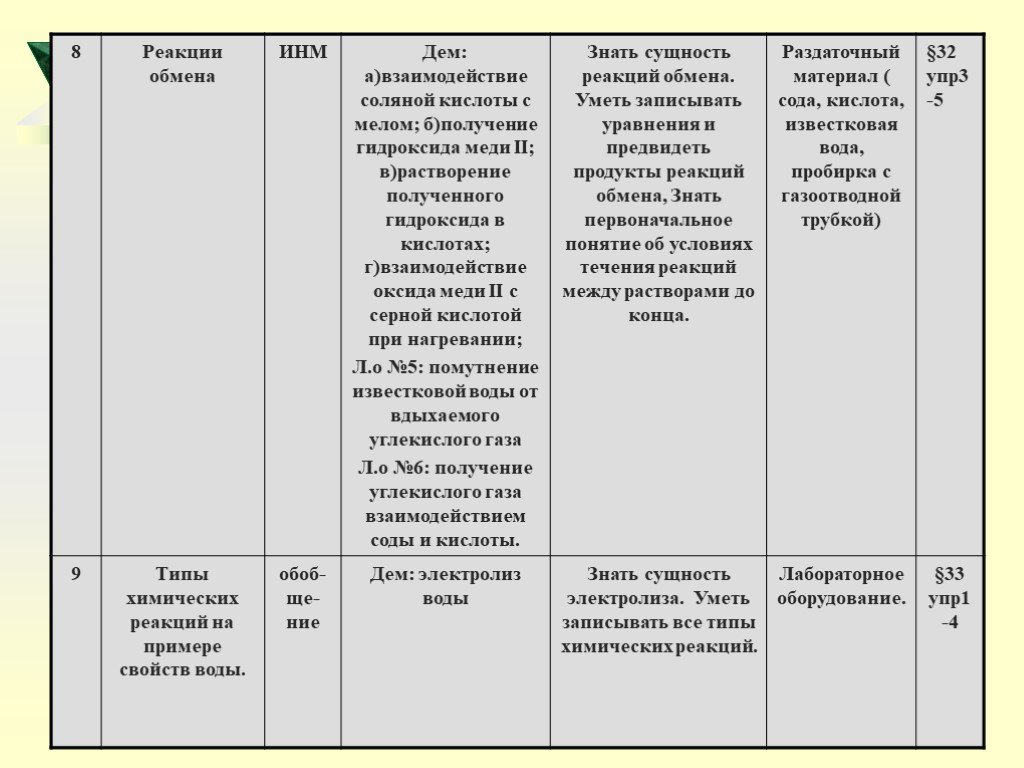
Урок 5-8: Реакции разложения, соединения, замещения обмена
Цель: Показать сущность всех типов реакций,
Задачи: Ознакомить учащихся с классификацией реакций по числу и составу исходных веществ и продуктов реакции. Сформировать умения различать типы химических реакций. Закрепить умения писать химические уравнения.
1. Работа с деформированным текстом в виде компьютерного слайда с последующей проверкой

Слайд 37Реакция, уравнение которой 2СО(г) → СО2(г)+ С(тв) + Q относится к реакциям:
А) соединения, экзотермическим Б) разложения, экзотермическим В) соединения, эндотермическим Г) разложения, эндотермическим
Реакция, уравнение которой N2 + O2 →2NO - Q относится к реакциям:
А) соединения, эндотермическим Б) соединения, экзотермическим В) разложения, эндотермическим Г) разложения, экзотермическим
3. Работа по дидактическим карточкам «Подумай и ответь!» ( дидактические карточки разработаны для 25 вариантов)
2. Самостоятельная работа в рабочих тетрадях Габриеляна (стр. 101-102 № 3, 5, 6) расставление коэффициентов в схемах химических реакций; найти реакции получения кислорода в лаборатории; записать определения скорости, катализатора, ферментов.
1 вариант 2 вариант
4. Просмотр презентаций учащихся по выбранным темам
5. Сообщения и доклады учащихся с использованием дополнительной литературы

Слайд 38Объяснение нового материала:
Объяснение учителем основных понятий изучаемых тем:
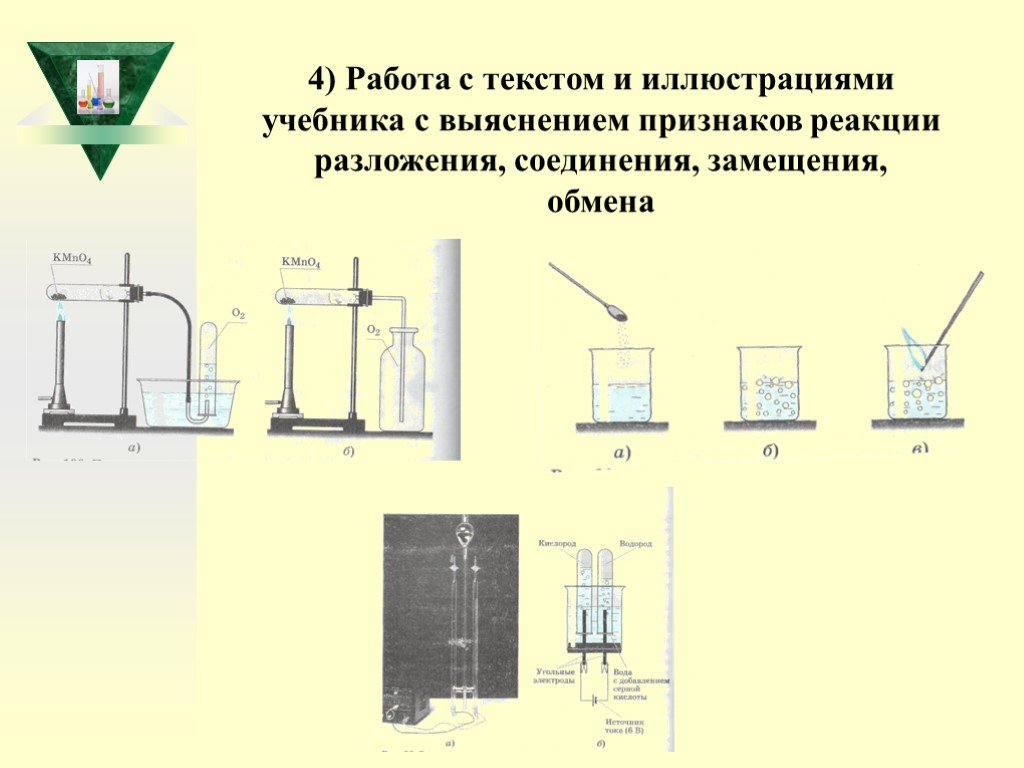
2) Демонстрация опытов учителем: - разложение перманганата калия; - горение магния; - разложение пероксида водорода; - горение фосфора; - получение гидроксида меди (11); - электролиз воды; - растворение полученного гидроксида в кислотах; - взаимодействие оксида меди (11) с серной кислотой при нагревании;
реакция разложения; катализаторы; ферменты; скорость химической реакции
реакция соединения; обратимые и необратимые реакции; каталитические и некаталитические реакции
реакция замещения; ряд активности металлов
реакция обмена; реакции нейтрализации; условия протекания реакций обмена в растворах до конца
Например: 2KMnO4K2MnO4+ MnO2 + O2
Опыт взаимодействие алюминия с бромом

Слайд 393) Выполнение лабораторных опытов с последующим оформлением результатов в виде рисунков и таблиц, формулирование выводов
Алгоритм проведения лабораторных опытов: соблюдение правил по технике безопасности; знакомство с инструкцией по выполнению лабораторной работы; поэтапное планирование выполнения опытов; проведение опытов; оформление результатов опытов в тетрадях.
Темы лабораторных опытов: Окисление меди в пламени спиртовки. Помутнение известковой воды от выдыхаемого углекислого газа. Получение углекислого газа взаимодействием соды и кислоты. Замещение меди в растворе хлорида меди (11) железом.
Zn + 2HCl = ZnCl2 + H2 2Fe +3H2O = Fe2O3 +3H2

Слайд 401. Взаимодействие А1 с НС1: Положите в пробирку кусочек алюминия, прилейте 3-4 мл. соляной кислоты (НС1). Что наблюдаете? Запишите уравнение реакции. 2. Взаимодействие СuS04 и Fе: В химический стакан прилейте раствор сульфата меди (II) (Си804) и опустите кусочек железа (скрепка). Что наблюдаете? Запишите уравнения реакции. 3. Взаимодействие Сu(ОН)2 с Н2SО4: Получите нерастворимое основание Си(ОН)2: в пробирку прилейте сульфат меди (II) (СuS04) и добавьте 2-3 мл. гидроксида натрия (NаОН) образуется осадок - это получилось нерастворимое основание гидроксид меди (II), к осадку прилейте раствор разбавленной серной кислоты (Н2SО4). Что наблюдаете? Запишите уравнение реакции.
ИНСТРУКЦИЯ ПРОВЕДЕНИЯ ЛАБ./ОПЫТОВ 1. Взаимодействие Мg с НС1: Положите в пробирку кусочек магния, прилейте 3-4 мл. соляной кислоты (НС1). Что наблюдаете? Запишите уравнение реакции. 2. Взаимодействие СuS04 и Fе: В химический стакан прилейте раствор сульфата меди (II) (СuS04) и опустите кусочек железа (скрепка). Что наблюдаете? Запишите уравнения реакции. 3. Взаимодействие Сu(ОН)2 с Н2SО4: Получите нерастворимое основание Сu(ОН)2: в пробирку прилейте сульфат меди (II) (СuS04) и добавьте 2-3 мл. гидроксида натрия (NаОН) образуется осадок - это получилось нерастворимое основание гидроксид меди (II), к осадку прилейте раствор разбавленной серной кислоты (Н2SО4). Что наблюдаете? Запишите уравнение реакции.

Слайд 414) Работа с текстом и иллюстрациями учебника с выяснением признаков реакции разложения, соединения, замещения, обмена
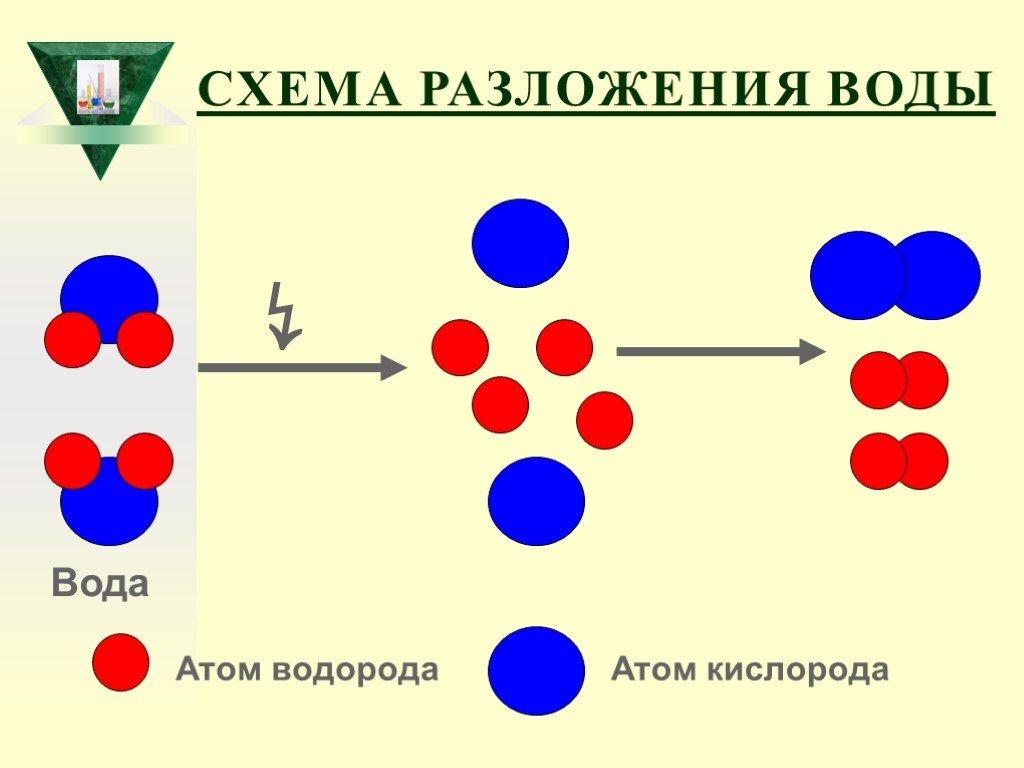
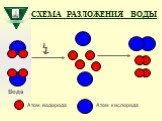
Слайд 42Схема разложения воды
Атом водорода Атом кислорода ↯ Вода
Слайд 431) Поочерёдное заполнение граф сводной таблицы «Типы химических реакций» на основе текста учебника и наблюдений демонстрационных опытов
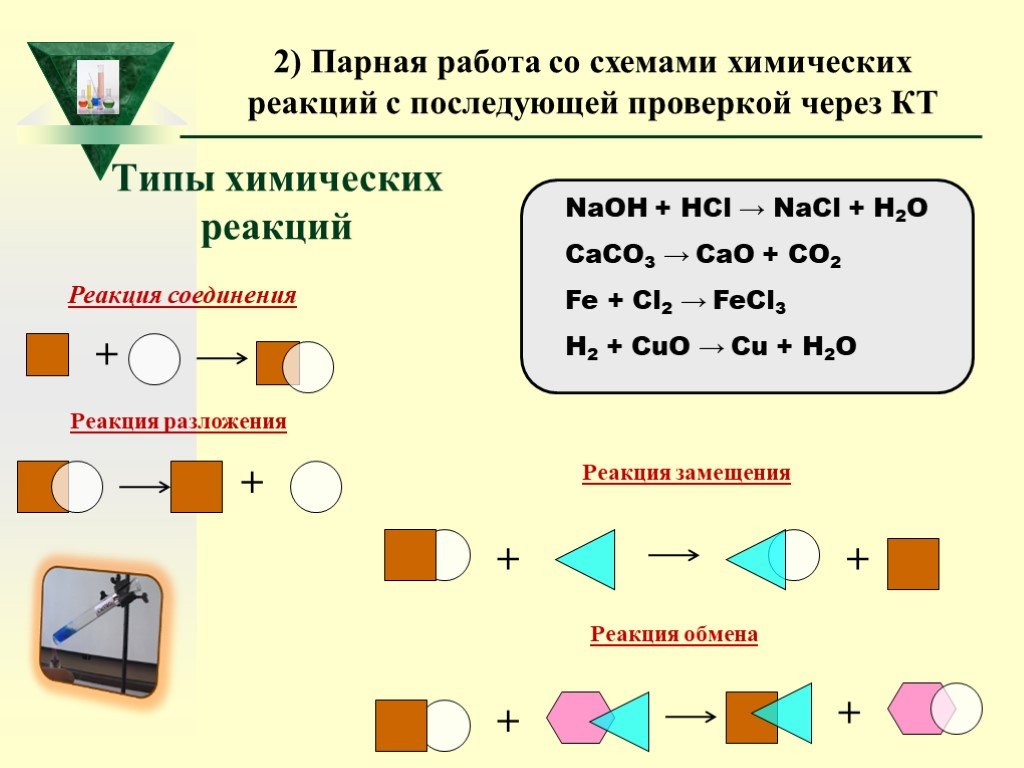
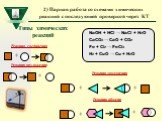
Слайд 44Типы химических реакций
NaOH + HCl → NaCl + H2O CaCO3 → CaO + CO2 Fe + Cl2 → FeCl3 H2 + CuO → Cu + H2O
Реакция соединения
Реакция замещения
+ Реакция обмена
Реакция разложения
2) Парная работа со схемами химических реакций с последующей проверкой через КТ
Слайд 451. Назовите реакции обмена
А) действие на соду кислотой
Б) горение магния
В) прокаливание карбоната кальция Г) растворение цинка в кислоте
2. Метод отстаивания используют для веществ, имеющих:
1. разную растворимость 2. разную температуру кипения
3. разную плотность 4. разное агрегатное состояние
3) Викторина «Кто хочет стать отличником?»
Делительная воронка используется для:
1. выпаривания веществ
2. отделение веществ с разной плотностью
3. для перегонки веществ
4. для кристаллизации
Д/З: изучение текста параграфов выполнение упражнений подготовка сообщений
4) Использование задание познавательного характера

Слайд 46Урок 9: Типы химических реакций на примере свойств воды.
Цель: Рассмотреть типы химических реакций на примере химического вещества воды
Задачи: Совершенствовать знания о роли воды в природе и жизни человека. Проанализировать химические свойства воды, повторив основные типы химических реакций. - Обобщить и систематизировать знания о химических реакциях.
Обобщение и закрепление знаний на основе химических свойств воды
1) Работа в группах с дополнительным и справочным материалом
Справочный материал Значение воды для жизни организмов
Вода - самое распространенное неорганическое соединение в живых организмах нашей планеты. Количество воды в организме зависит от возраста. Эмбрион человека на 97 % состоит из воды, а у новорожденных ее количество составляет уже только 77 % массы. К 50 годам человек немного «усыхает», и вода составляет 60 % от массы его тела. Основная масса воды - 70 % - сосредоточена внутри клеток, 7 % - это кровь и лимфа, а остальная часть омывает клетки снаружи, это вода межтканевая. Зачем столько воды в организме? • Вода входит в состав всех клеток и тканей тела, в ней протекают все биохимические процессы. Клетка без воды - это уже не живая клетка. Из 26 кг воды в твоем теле на внутриклеточную воду приходится 18 кг. • Вода служит основой крови и лимфы. На это расходуется 2 кг воды. Вода является той средой, где совершаются процессы пищеварения. Без воды пища не может ни проходить по желудочно-кишечному тракту, ни усваиваться организмом. На процессы пищеварения и выделения расходуется около 6 кг воды в виде желудочного сока, слюны, мочи, пота и др. Вода вымывает из клеток отработанные продукты обмена веществ и выносит их из организма, как через почки (с мочой), так и через кожу (с потом). Вода в твоем организме выступает и как растворитель веществ, и как переносчик веществ по организму. У нее есть еще одна важная роль - через систему потоотделения она регулирует температуру твоего тела

Слайд 47Справочный материал для групповой работы
Вода – растворитель Из свойств воды особенно важна ее способность растворять вещества. Вода - универсальный растворитель. В ней могут растворяться вещества различной химической природы, образованные ковалентными полярными и ионными связями. В воде могут растворяться твердые, жидкие и газообразные вещества. Но не все они одинаково хорошо растворяются в воде. Вещества бывают хорошо растворимое, малорастворимые и практически нерастворимые. Широко применяются водные растворы твердых веществ. Любая природная вода - раствор. Величина, характеризующая способность веществ растворяться в воде, - это растворимость, которая определяется массой вещества, способной раствориться в 100 г воды при определенной температуре. Растворимость зависит от температуры, но не всегда одинаково. На нее влияет агрегатное состояние вещества. Карточка-инструкция для группы Из предложенного перечня веществ выберите те, с помощью которых можно продемонстрировать постепенность растворения веществ в воде: СаО, SiO2, СаСО3, КМn04, К2Сr2О7, NH4N03.

Слайд 48Зашифрованное слово: тип реакции, в ходе которой одного сложного вещества образуется несколько простых № сложных веществ. Вопросы Реакция взаимодействия веществ с кислородом, которая сопровождается выделением света и тепла. Вещество, в состав которого входит ОН-группа. ...+02->N02. Обязательный элемент в составе оксидов. Вещество, которое состоит из атомов металла и кислотного остатка. ... + S->FeS Тип реакции: 2А1 + 3 СиО -> 3 Си + А1203. Реакция, при которой из двух или нескольких веществ образуется одно сложное. H2S04 - класс веществ. 10. Тип реакции: H2S04 + 2NaOH -> Na2S04 + 2Н20. Ответы: 1. Горение. 2. Основание. 3. Азот. 4. Кислород. 5. Соль. 6. Железо. 7. Замещение. 8. Соединение. 9. Кислота. 10. Обмен.
2) Обобщение и закрепление знаний в ходе заполнения граф кроссворда

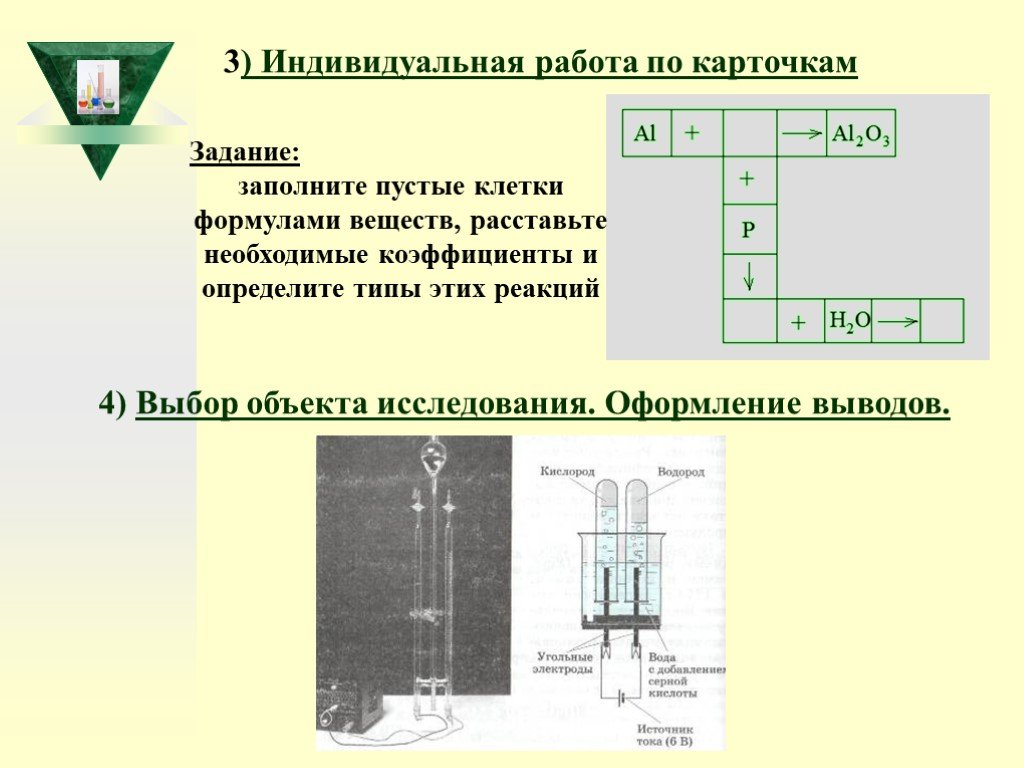
Слайд 49Задание: заполните пустые клетки формулами веществ, расставьте необходимые коэффициенты и определите типы этих реакций
3) Индивидуальная работа по карточкам
4) Выбор объекта исследования. Оформление выводов.
Слайд 50Урок 10: Контрольная работа по теме «Изменения, происходящие с веществами».
Цель: Проконтролировать усвоение знаний учащимися по теме «Изменения, происходящие с веществами»
Задачи: Проверить знания учащихся типов химических реакций. - Выявить умения составлять химические уравнения. - Выявить умения проводить расчёты по химическим уравнениям и решать задачи.

Слайд 51К/р «Изменения, происходящие с веществами» Вариант 1 1. Выпишите предложение, в котором говорится о физическом явлении: а) при прокаливании медная пластинка чернеет; б) при пропускании углекислого газа известковая вода мутнеет; в) при нагревании вода превращается в пар; г) под действием света фотопленка, на которую нанесен бромид серебра, чернеет. Расставьте коэффициенты в схемах химических реакций и укажите тип каждой из них: а) Си + 8 — Си28; б) МпО2 + С — СО + Мn. Лампочка прибора для определения электропроводности веществ загорится при погружении электродов в: а) жидкий азот; б) раствор хлорида калия; в) раствор сахара; г) кристаллический сульфат натрия. Вычислите массу и количество вещества оксида углерода(1V), образовавшегося при полном сгорании 36г угля. Названия только неоднородных смесей записаны в ряду: а) масло, речная вода, раствор поваренной соли; б) сахар, уголь, дождевая вода; в) кровь, молоко, раствор глины; г) керосин, раствор уксусной кислоты, смесь растительного масла с водой. 6. К раствору гидроксида бария по каплям приливают раствор серной кислоты. Электропроводность системы при этом будет: а) вначале возрастать, затем уменьшаться; б) вначале уменьшаться, затем возрастать; в) постепенно возрастать; г) постепенно уменьшаться.

Слайд 52Контрольная работа К/р «Изменения, происходящие с веществами Вариант 2 1. Выпишите предложение, в котором говорится о химическом явлении: а) при пропускании электрического тока вода превращается в два газообразных вещества — кислород и водород; б) при нагревании растворимость сахара в воде повышается; в) при температуре О °С вода превращается в лед; г) при температуре 100 °С вода кипит. 2. Расставьте коэффициенты в схемах химических реакций и укажите тип каждой из них: а) МпO2 + А1 -* А1203 + Мn; б)Р + 02 -» Р205. 3. Лампочка прибора для определения электропроводности веществ не загорится при погружении электродов в: а) дистиллированную воду; б) расплав хлорида кальция; в) соляную кислоту; г) раствор гидроксида натрия. 4. Рассчитайте массу и количество вещества кальция, вступившего в реакцию с 32 г кислорода. 5. Названия только однородных смесей записаны в ряду: а) молоко, природный газ, песок; б) чистый воздух, раствор соли, водопроводная вода; в) нефть, мел, мука; г) смесь мела с водой, кровь, раствор марганцовки. 6. К раствору нитрата серебра по каплям приливают соляную кислоту. Электропроводность системы при этом будет: а) постепенно возрастать; б) постепенно уменьшаться; в) вначале возрастать, затем уменьшаться; г) вначале уменьшаться, затем возрастать.

Слайд 53Тест по теме: «Изменения, происходящие с веществами»
А1)Физическое явление 1.Ржавление железа 2. плавление металла 3.горение природного газа 4.скисание молока А2)Химическое явление 1.плавление льда 2.испарение воды 3.разложение серной кислоты 4.растворение сахара в воде А3)Для выделения поваренной соли из её раствора в воде можно использовать 1.фильтрование 2.отстаивание смеси в воде 3.дистиляцию 4.выпаривание и кристаллизацию А4)Экзотермическая реакция-это реакция, протекающая 1.с выделением газа 2.с образованием осадка 3.с выделением теплоты 4.с поглощением теплоты

Слайд 54А5) Составьте уравнение реакции по схеме: CH4 +O2=CO2 + H2O ответ дайте в виде коэффициентов в уравнении реакции. 1.5 2.6 3.7 4.8 А6) Определите количество вещества гидроксида натрия, необходимое для полной нейтрализации 2 моль серной кислоты 1. 1моль 2. 2моль 3. 3моль 4. 4моль А7)Укажите уравнение реакции разложения 1.Mg(OH)2 = MgO + H2O 2.Mg + 2HCl = MgCl2 + H2 3.Mg + O2 = 2MgO 4.2Mg + CO2 = 2MgO + C А8) Напишите уравнение реакции соединения по схеме: Na2O + H2O =…. Определите сумму коэффициентов этом уравнении 1.4 2.5 3.6 4.7
Слайд 55А9) Металл, который не вытесняет водород из кислот 1.Cu 2.Fe 3.Al 4.Zn А10) В ходе реакции обмена между растворами Na2CO3 и HCl образуется 1.только вода 2.вода и газ 3.осадок 4.только газ А11) Укажите оксид, который взаимодействует с водой 1. оксид меди 2.оксид цинка 3. оксид кремния 4.оксид бария
Слайд 57
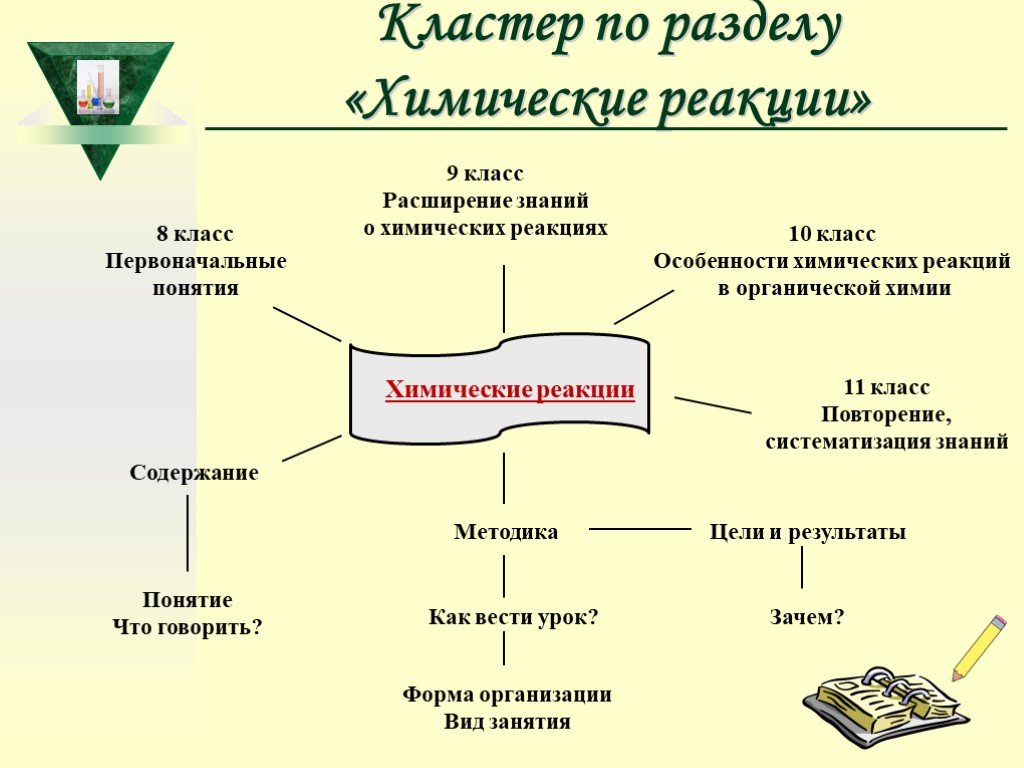
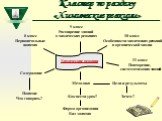
Слайд 58Кластер по разделу «Химические реакции»
Химические реакции
8 класс Первоначальные понятия
9 класс Расширение знаний о химических реакциях
10 класс Особенности химических реакций в органической химии
11 класс Повторение, систематизация знаний
Содержание
Понятие Что говорить?
Методика Как вести урок?
Форма организации Вид занятия
Цели и результаты Зачем?
Слайд 59
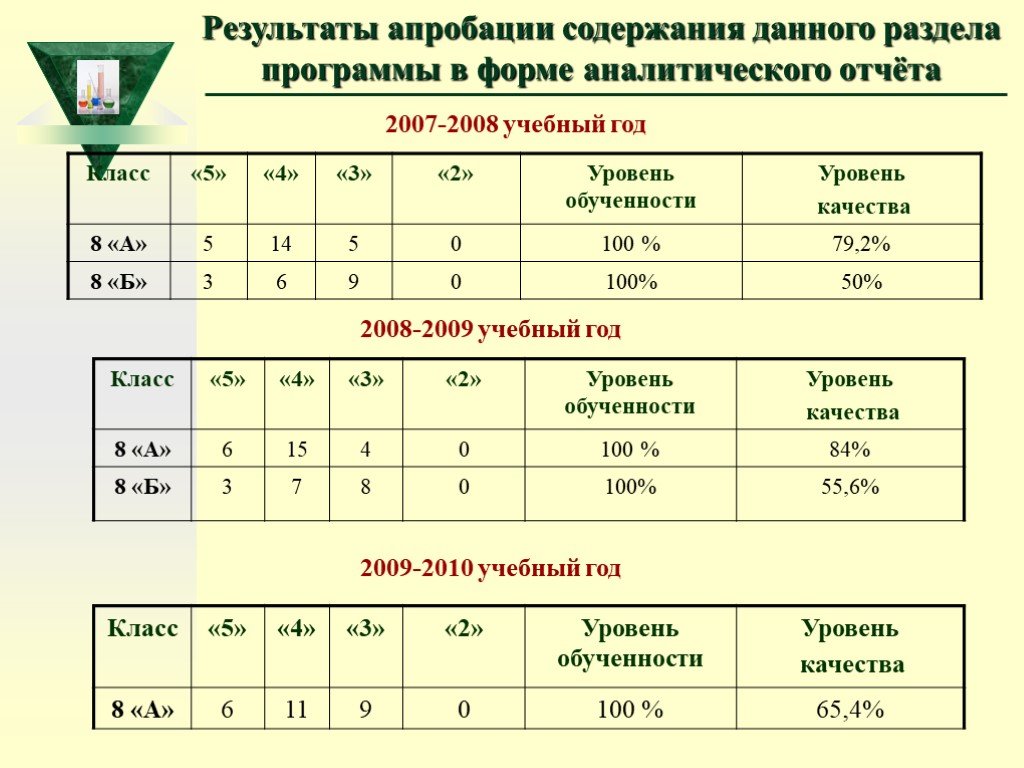
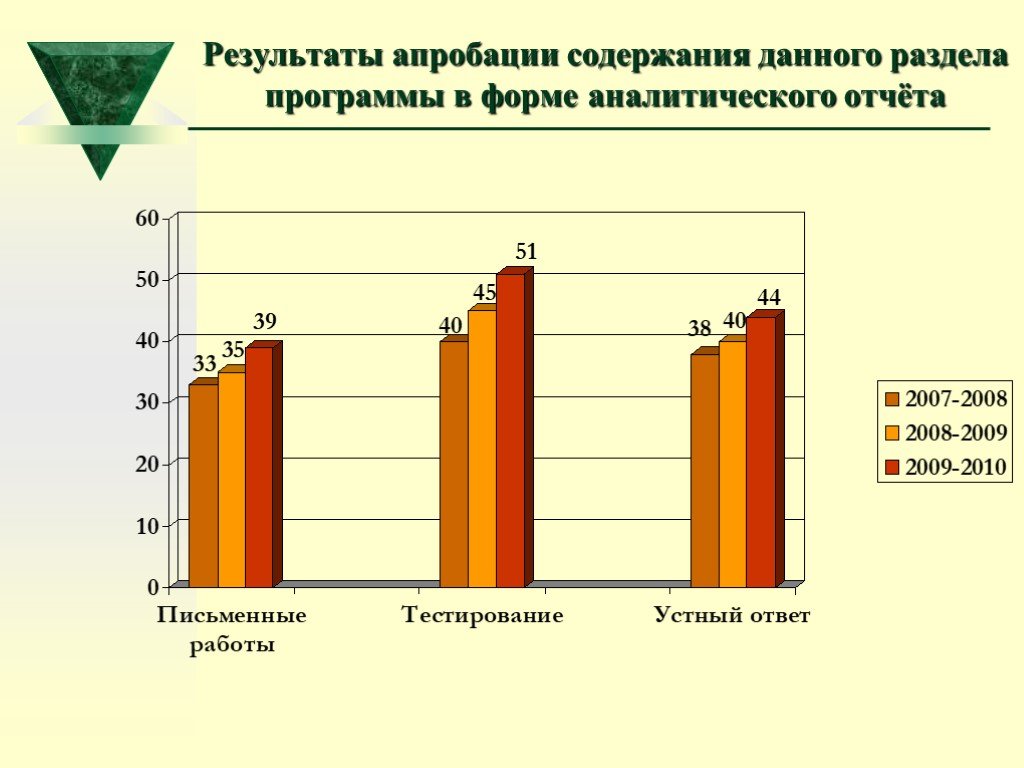
Слайд 63Результаты апробации содержания данного раздела программы в форме аналитического отчёта
2007-2008 учебный год 2008-2009 учебный год 2009-2010 учебный год
Слайд 64
Слайд 65Вывод
Система работы по данному разделу – целенаправленный процесс, в результате которого учащиеся убеждаются в том, что «химическая реакция» является одной из важных форм движения материи, через которую происходят познания целостности картины мира.

Слайд 66Источники информации для учителя:
1) Аверкиева Г.И. Загадки реакций обмена. –М: Химия в школе, 1982 г №2 стр.57 2) Брейгер Л.Н. Химия 11-й класс поурочные планы. –Волгоград: Учитель, 1997 г 3) Габриелян О. С. Химия 8-9/ методическое пособие. –М: Дрофа, 2001 г. 4) Габриелян О. С., Рунов Н. Н. Химический эксперимент в школе. –М: Дрофа, 2000 г. 5) Городова Н.М. Сборник тестовых заданий по химии для 8-9 классов. –М: Наука, 1998 г 6) Денисова В.Г. Мастер- класс учителя химии 8-11 класс. –М: Глобус, 2010 г 7) Кирюшин Д.М. Методы обучения в средней школе. –М: Просвещение, 1991 г. 8) Крицман В.А. Д.И. Менделеев о химических реакциях. –М: Химия в школе, 1984 г №3 С.16 9) Маршанова Г.Л. Сборник задач по органической химии. –М: Издат-школа, 2005 г. 10) Маршанова Г.Л. 500 задач по химии 8-11 классы. –М: Издат-школа, 2000 г 11) Пасечник Б.Н. Развитие самостоятельности и творческих способностей учащихся при изучении химии. –М: Химия в школе 1986 №1 С.55 12) Плетнер Ю.В., Полосин В.С. Практикум по методике обучения химии. –М: Просвещение, 1998 г. 13) Радецкий А.М., Курьянова Т.Н. Дидактический материал по общей химии для 11 класса./ Пособие для учителя. –М: Просвещение, 2001 г 14) Савич Г.З. Формирование понятий о химической реакции. –М: Просвещение, 1991 г. 15) Чертков И.Н. Обучение химии в 10-м классе ( в двух частях). –М: Просвещение, 1992 г 16) Эмануэль Н.М. Химическая кинетика. –М: Знание, 1991 г.

Слайд 67Источники информации для учащихся:
1) Авербух А.Я., Богушевская К.К. Из чего, как и что получается. -Л: Лениздат, 1967 г. 2) Бальян В. Чудесные превращения». –Л: Лениздат, 1979 г. 3) Галичкина О.В. Занимательня химия на уроках 8-11 классов. –Волгоград: Учитель, 2007 г 4) Гладков К.А. Атом от А до Я. –М: Атомиздат, 1966 г 5) Егоркин В.Ф., Кирюшин Д.М., Полосин В.С. Внеклассные занятия по химии. –М: Просвещение, 1965 г. 6) Лукашёв К.И. Атомы и наша планета. –М: Знание, 1995 г. 7) Марголис Л.Я. Волшебная палочка химии. –М: Наука, 1998 г. 8) Минченко Е.Е. Зазнобина Л. С. Химия 8 9) Николаев Л.А. Катализ и катализаторы. –М: Учпедгиз, 1961 г. 10) Паринин В.П., Казакова З.С. Палитра химии –М: Наука, 1985 г. 11) Перельман А.И. Атомы в природе. –М: Наука, 1997 г. 12) Регель Дж. Энергия, Жизнь и Организм, –М: Мир, 1985 г. 13) Розен Б.Я. Тайны невидимого мира. –М: Знание, 1996 г. 14) Шпаусус З. Путешествие в мир химии. –М: Просвещение, 1985 г. 15) Энциклопедия для детей Химия. –М: Аванта, 2000 г.