Презентация "Классификация химических реакций" по химии – проект, доклад
Презентацию на тему "Классификация химических реакций" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 16 слайд(ов).
Слайды презентации
Список похожих презентаций
Классификация химических реакций
Химические реакции - это. процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и строению. Классификация. ...Классификация химических реакций
«Химическое превращение, химическая реакция есть главный предмет химии». Н.Н.Семёнов. Какие явления относятся к (Ф) физическим, а какие к (Х) химическим. ...Классификация химических реакций
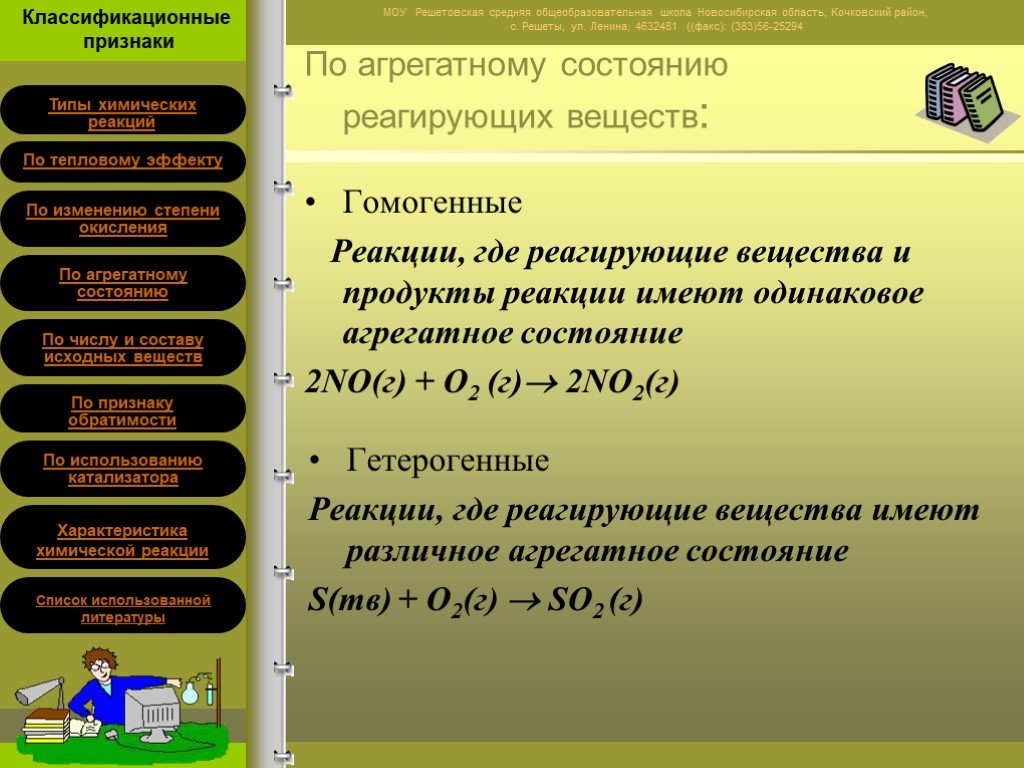
это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению. Химические реакции -. По числу ...Классификация химических реакций
. . . . . . . . . . . . . . . ...Классификация химических реакций в органической и неорганической химии
Цели урока: обобщить представления о химической реакции как о процессе превращения одного или нескольких веществ в другие вещества; рассмотреть классификацию ...Классификация химических реакций, протекающих в организме человека
Изучение общих закономер-ностей реакционной способ-ности биоорганических соединений является осно-вой понимания механизмов их биологического функцио-нирования. ...Классификация химических реакций
это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению. Химические реакции -. По числу ...Классификация химических реакций
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ. РЕАКЦИИ СОЕДИНЕНИЯ. РЕАКЦИИ РАЗЛОЖЕНИЯ. РЕАКЦИИ ЗАМЕЩЕНИЯ. РЕАКЦИИ ОБМЕНА. 1) Водород + кислород вода. Н 2 + О2 Н2О 2. 2) ...Химия. Классификация химических реакций
По числу и составу исходных и образовавшихся веществ:. Реакции разложения Реакции соединения Реакции замещения Реакции обмена. РЕАКЦИЯ РАЗЛОЖЕНИЯ. ...Классификация химических реакций
Химические реакции – процессы в результате которого из одних веществ получаются другие, отличающиеся по составу и строению. І.По числу и составу реагирующих ...Закон сохранения массы веществ. Уравнения химических реакций
Единственный путь, ведущий к знанию, - это деятельность. Цели урока: Обучающие - экспериментально доказать закон сохранения массы веществ. На основе ...Cкорость химических реакций
Определение:. Скорость химической реакции – это изменение количества реагирующего вещества в единицу времени в единице объёма. r – скорость химической ...«Систематизация и обобщение знаний по теме «Типы химических реакций»»
1) Что называют химической реакцией? 2) По каким признакам можно утверждать, что произошла или происходит химическая реакция? 3) Какие условия необходимы ..."Типы химических реакций
ЦЕЛЬ УРОКА:. ПОВТОРИТЬ И ОБОБЩИТЬ ЗНАНИЯ УЧАЩИХСЯ О ХИМИЧЕСКИХ ПРЕВРАЩЕНИЯХ, ПРИЗНАКАХ И ТИПАХ ХИМИЧЕСКИХ РЕАКЦИЙ. ЗАКРЕПИТЬ НАВЫКИ СОСТАВЛЕНИЯ ХИМИЧЕСКИХ ..."Тепловой эффект химических реакций
Явления природы Физические Химические. Химические явления – химические реакции. Химическая реакция – процесс превращения одних веществ в другие. 2Н2 ...Биогенная классификация химических элементов
бром железо натрий. Элементы необходимые организму для построения и жизнедеятельности клеток и органов, называют биогенными элементами. Введение в ...В мире химических реакций
Классификация химических реакций по числу и составу реагирующих веществ реакции. « …Мы отнюдь не властвуем над природой, все наше господство состоит ...Кинетика химических реакций.Химическое равновесие
NaOH + HCl = NaCl + H2O Na+ + OH ─ + H+ + Cl─ = Na+ + Cl─ + H2O. Секунды и доли секунд. + _. MgO(к) + H2O = Mg(OH)2 (к) при 25оС - 5 ÷ 6 месяцев (медленно) ...Обратимость химических реакций
Обратимые и необратимые реакции. Необратимыми называют химические реакции, протекающие только в одном направлении. Обратимыми называют реакции, протекающие ...Химические реакции. Составление уравнений химических реакций
Цели и ожидаемые результаты. Повторить понятия как простые и сложные вещества, составление химической формулы вещества, химические реакции. Научиться ...Конспекты
Классификация химических реакций
Открытый урок по химии в 11 классе по теме:. «Классификация химических реакций». Учитель МКОУ СОШ с.п. Кара-Суу Жабоева Раиса Муратовна. Задачи ...Классификация химических реакций
Айдарханова Алма Набиоллаевна. . Конспект урока по химии на тему:"Классификация химических реакций". 10 класс. ...Классификация химических реакций
Муниципальное бюджетное общеобразовательное учреждение. «Средняя общеобразовательная школа №10». г.Зимы Иркутской области. ...Классификация химических реакций
Тема урока: «Классификация химических реакций». . Дата проведения: ____________________. Тип урока: Урок закрепления знаний и изучения новой ...Классификация химических реакций
Тема урока: « Классификация химических реакций», 8 класс. Цель:. познакомить обучающихся с классификацией химических реакций по признаку количества ...Классификация химических реакций и закономерности их протекания
Практическая работа №2. . «Решение экспериментально-теоретических задач по теме «Классификация химических реакций и закономерности их протекания»». ...Классификация химических реакций
Урок химии для 11 класса на тему «Классификация химических реакций». . Цель. :. систематизировать знания учащихся о подходах к классификации химических ...Физические и химические явления. Признаки химических реакций
Урок. : химия. Дата. :. Учитель. : Алимбаева А.К. . Класс. : 8. Тема урока. : Физические и химические явления. Признаки химических реакций. . ...Явления физические и химические. Признаки химических реакций
Итоговая работа. Явления физические и химические. Признаки химических реакций. . . Цель:. . 1. Сформировать представление учащихся о физических ...Факторы, влияющие на скорость химических реакций
Калиничева Екатерина Антоновна –. учитель химии высшей квалификационной категории КГУ «Средняя школа №5» г. Петропавловск,. Северо-Казахстанская ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:9 ноября 2018
Категория:Химия
Содержит:16 слайд(ов)
Поделись с друзьями:
Скачать презентацию