Презентация "Сера и ее соединения" по химии – проект, доклад
Презентацию на тему "Сера и ее соединения" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 21 слайд(ов).
Слайды презентации
Список похожих презентаций
Сера и ее свойства
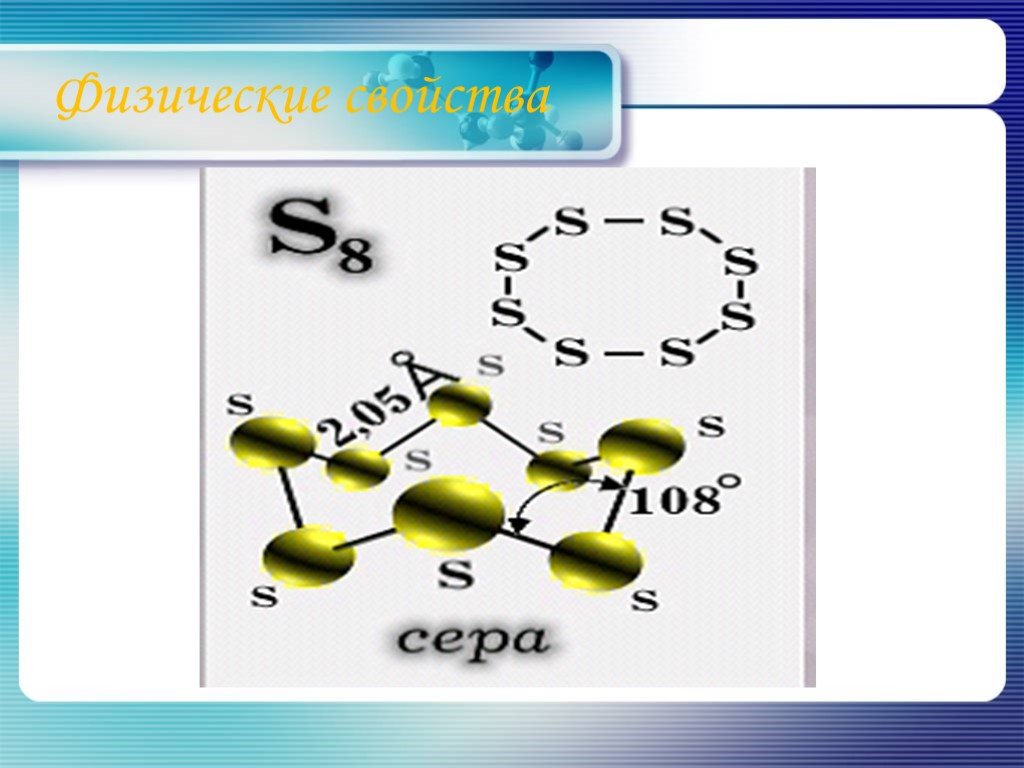
Химический мой знак – S, А 32 есть атомный мой вес. Я кристаллическое вещество, Горю я очень хорошо. Вхожу в состав серной кислоты, Известны соли ...Сера и её соединения
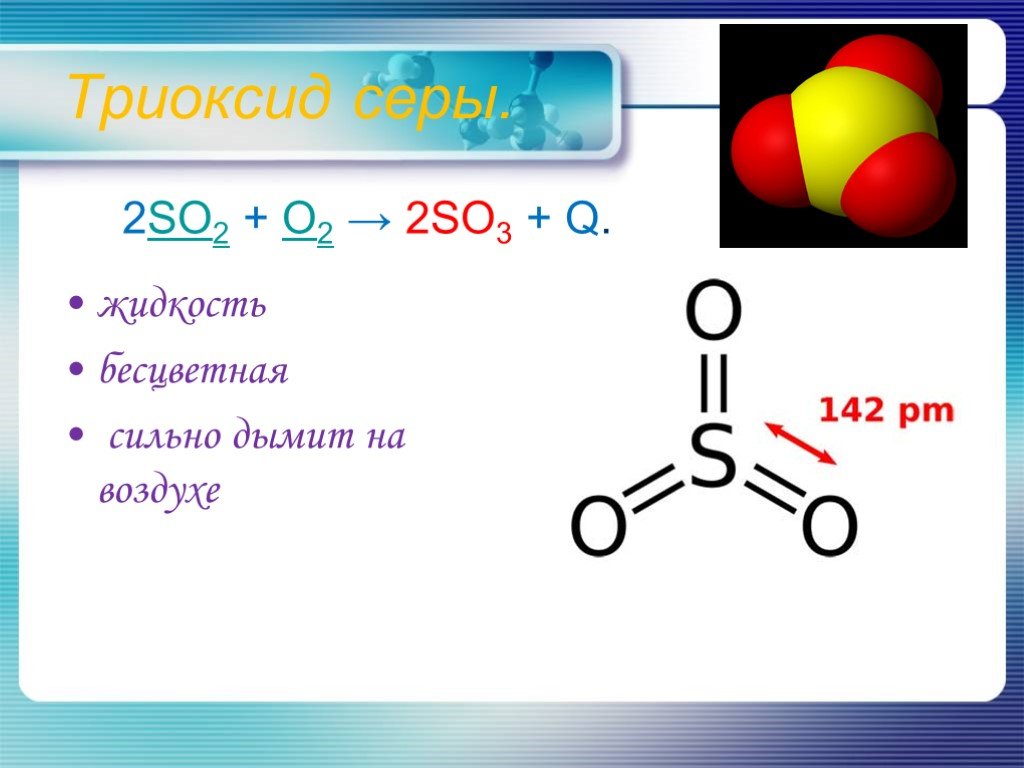
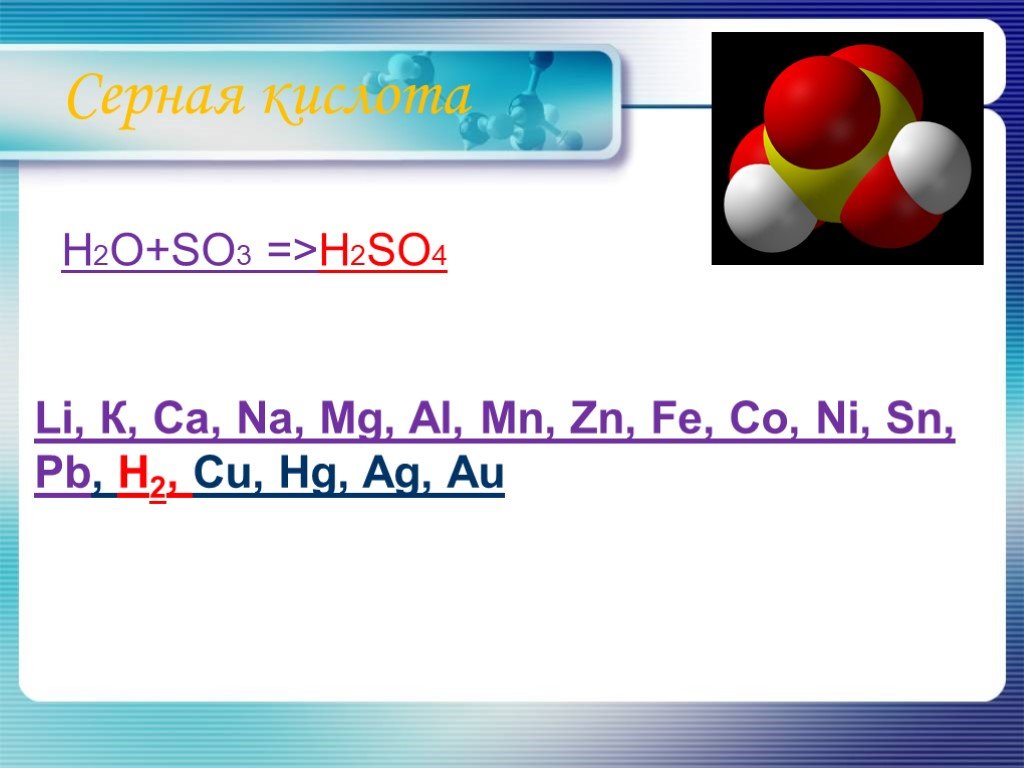
Валентные состояния атома серы S. Валентность II, ст. окисления -2. 3s 3p 3d. Валентность IV, Ст. окисления +4. Валентность VI, Ст. окисления +6. ...Основные соединения серы
Почему геохимик А.Е.Ферсман назвал серу «двигателем химической промышленности»? Цели урока:. Рассмотреть свойства важнейших соединений серы – сероводорода ...Раздел химии. Вода и ее свойство
Тема 2.1. Раздел химии. Вода и ее свойство. Вопрос 1. Введение в химию. Теоретические основы химии. В зависимости от того, какие вещества изучает ...Неметаллы. Кислородные соединения неметаллов
Кислоты. Высшим оксидам неметаллов соответствуют следующие кислоты. . Кислородосодержащие кислоты являются гидроксидами кислотных оксидов. По основности ...Нефть и способы ее переработки
Нефть – это сложная смесь жидких углеводородов, в которых растворены газообразные и другие вещества. И чтобы перечислить все продукты, получаемые ...Кремний и его соединения
Нахождение в природе. SiO2 кремнезём (песок). Al2O3∙ 2SiO2∙2H2O каолинит (глина). По распространенности занимает второе место после кислорода (26%). ...Металлическая связь и ее свойства
Это связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке СХЕМА ...Сера химия
Сера принадлежит к числу веществ, известных человечеству испокон веков. Ещё древние греки и римляне нашли ей разнообразное практическое применение. ...Азотная кислота и ее соли
План изучения азотной кислоты. 1.Состав . 2.Строение. 3.Физические свойства. 4.Химические свойства. 5.Получение и применение. Состав и строение азотной ...Алюминий и его соединения
Учителя химии: Гершановская Евгения Владимировна ГБОУ СОШ № 880 Город Москва Попова Светлана Анатольевна ГБОУ СОШ № 1465 Город Москва. СОДЕРЖАНИЕ. ...Бинарные соединения
Классификация сложных веществ. Бинарные соединения – это вещества, состоящие из двух разных атомов. Как составить формулу бинарного соединения. Знать ...Алюминий и его соединения
Стартовое задание. Выполнение задания А оценивается одним баллом. Выполнение задания В оценивается 2 баллами. Выполнение задания С оценивается 3 баллами. ...Алюминий и его соединения
Положение в Периодической системе. Алюминий располагается в 3 периоде, в главной подгруппе 3 группы. Порядковый номер элемента – 13 Относительная ...Азотная кислота и ее соли
Это вещество было описано арабским химиком в VIII веке Джабиром ибн Хайяном (Гебер) в его труде «Ямщик мудрости», а с ХV века это вещество добывалось ...Сера
Цель:. Определить положение серы в периодической системе химических элементов Д.И. Менделеева; Рассмотреть строение атома серы, физические и химические ...Азот и его соединения
Содержание. Открытие Происхождение названия Круговорот азота в природе Азот в природе Получение Свойства Соединения азота Применение. Открытие. В ...Бинарные соединения
ОПРЕДЕЛЕНИЕ. Бинарные соединения – это соединения, состоящие из двух химических элементов. H2O, NH3, K2S, P2O5, CaC2. Бинарные соединения - хлориды. ...Азотная кислота и ее свойства
Сегодня на уроке мы должны:. записать молекулярную и структурную формулы азотной кислоты; изучить химические свойства азотной кислоты в свете ОВР; ...Углерод и его соединения
Урок ведёт Шаркова Г. М. Присутствуют учащиеся 9 «а» класса. Цель Урока. • Повторить, систематизировать и расширить знания учащихся по данной теме ...Конспекты
Сера и ее соединения. Аллотропия серы. Сероводород. Оксиды серы
Тема: Сера и ее соединения. Аллотропия серы. Сероводород. Оксиды серы (. IV, VI. ). . Цели урока:. рассмотреть вещество «сера», аллотропию серы, ...Медь и ее соединения
Тема урока: Медь и ее соединения. . Цели урока. : расширить знания учащихся о металлах на примере переходного металла меди, рассмотреть состав и ...Сера и её соединения
Конспект урока с использованием ЭОР. Тема:. Сера и её соединения. Класс: 9. Цель:. изучить строение, свойства серы и его соединений. Задачи:. ...Углекислый газ, угольная кислота и ее соли
Дата_____________ Класс_______________. Тема:. . Углекислый газ, угольная кислота и ее соли. . Цели урока:. знать состав, строение, свойства ...Азотосодержащие органические соединения
4. . . Урок разработала Серебрянская Нелля Александровна,. учитель химии МОУ «Образцовская СОШ». Фроловского муниципального района. Волгоградской ...Соль и ее свойства
Муниципальное бюджетное дошкольное образовательное учреждение. д/с № 53 "Сказка". г. Озерска Челябинской области. Конспект урока на ...Оксид фосфора(V). Ортофосфорная кислота и ее соли. Минеральные удобрения
Дата_____________ Класс_______________. Тема:. . Оксид фосфора(V). Ортофосфорная кислота и ее соли. Минеральные удобрения. Цели урока:. знать ...Сера
МОУ 155 г.Самара Н.А. Ситникова. План - конспект урока химии в 9 классе. Тема: Сера. Цель:. формирование системы знаний о сере как о простом ...Азотная кислота и ее соли. Окислительные свойства азотной кислоты
Урок 21. Азотная кислота и ее соли. Окислительные свойства азотной кислоты. Цели урока:. 1. Охарактеризовать азотную кислоту по следующей схеме: ...Кремний и его соединения
Конспект урока химии «Кремний и его соединения». Приветствую тебя, мой юный исследователь! Предлагаю тебе сегодня обратиться самым настоящим пиратом. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:15 февраля 2019
Категория:Химия
Содержит:21 слайд(ов)
Поделись с друзьями:
Скачать презентацию