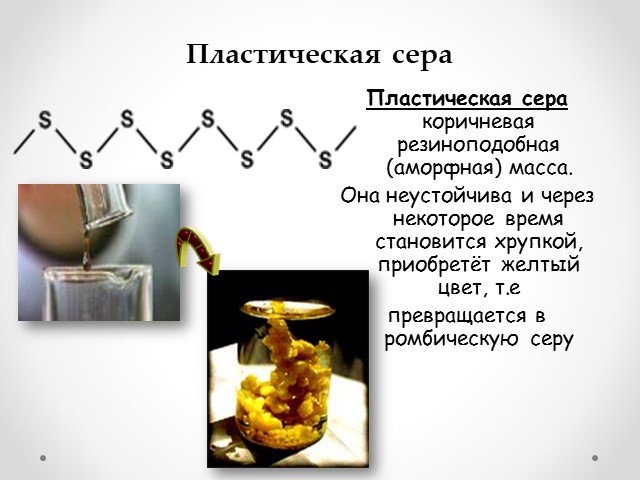
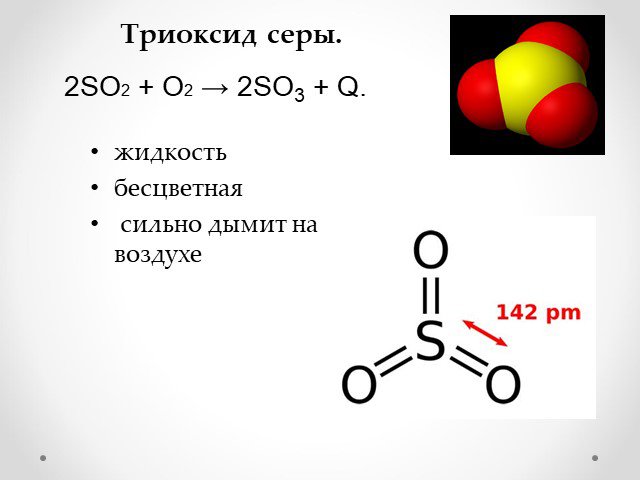
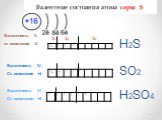
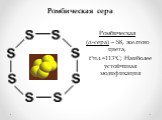
Презентация "Сера и её соединения" по химии – проект, доклад
Презентацию на тему "Сера и её соединения" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 18 слайд(ов).
Слайды презентации
Список похожих презентаций
Сера и ее соединения
Сера и ее соединения. Цель работы: Изучение физических и химических свойства серы и ее соединений. Выявление отрицательного воздействия на окружающую ...Поли- и гетерофункциональные соединения, участвующие в процессах жизнидеятельности
Особенности химического поведения полифункциональных соединений. 1. Кислотно-основные свойства полифункциональных соединений. Антифриз. Кислотные ...Органические соединения железа
Почему наш век можно назвать железным веком? Элементы и атомы, В менделеевский взятые круг, Сделали химию самой богатой И самой творческой из наук. ...Неметаллы. Кислородные соединения неметаллов
Кислоты. Высшим оксидам неметаллов соответствуют следующие кислоты. . Кислородосодержащие кислоты являются гидроксидами кислотных оксидов. По основности ...Марганец и его соединения
История открытия. 1774 г. шведский химик К. Шееле Ю. Ганн «манганум» (от немецкого Manganerz — марганцевая руда). Шееле Карл Вильгельм. Карл Вильгельм ...Коррозия металлов и её виды
Коррозия - это процесс самопроизвольного разрушения металлов и сплавов под влиянием факторов внешней среды. Закладка эксперимента. Лабораторный опыт ...Углерод и его соединения
Урок ведёт Шаркова Г. М. Присутствуют учащиеся 9 «а» класса. Цель Урока. • Повторить, систематизировать и расширить знания учащихся по данной теме ...Алюминий и его соединения
Учителя химии: Гершановская Евгения Владимировна ГБОУ СОШ № 880 Город Москва Попова Светлана Анатольевна ГБОУ СОШ № 1465 Город Москва. СОДЕРЖАНИЕ. ...Бинарные соединения
Классификация сложных веществ. Бинарные соединения – это вещества, состоящие из двух разных атомов. Как составить формулу бинарного соединения. Знать ...Алюминий и его соединения
Положение в Периодической системе. Алюминий располагается в 3 периоде, в главной подгруппе 3 группы. Порядковый номер элемента – 13 Относительная ...Алюминий и его соединения
Стартовое задание. Выполнение задания А оценивается одним баллом. Выполнение задания В оценивается 2 баллами. Выполнение задания С оценивается 3 баллами. ...Азотная кислота и её соли
Познакомиться с азотной кислотами, её солями- нитратами, их физическими и химическими свойствами ; Экспериментально изучить свойства азотной кислоты ...Азотная кислота и её соли
Вспомните! Какие степени окисления проявляет азот в своих оксидах? Какие окислы азота вы знаете? Расскажите о N2O, NO, NO2? Какое из этих соединений ...Азотная кислота и её свойства
Индивидуальная работа. Осуществите превращения 1 вариант: N2 → NO→NO2 2 вариант: N2→NH3→(NH4)SO4 3 вариант: NH3→N2→K3N. HNO. Содержание. Структурная ...Северная кислота и её свойства
Признаки характеристики кислоты. по содержанию атомов кислорода в молекуле по основности по растворимости по степени электролитической диссоциации ...Бинарные соединения
ОПРЕДЕЛЕНИЕ. Бинарные соединения – это соединения, состоящие из двух химических элементов. H2O, NH3, K2S, P2O5, CaC2. Бинарные соединения - хлориды. ...Сера
Цель урока. Дать характеристику серы на атомарном, молекулярном и макроуровне. План урока. Сера в природе Атомы серы Аллотропия серы Физические свойства ...Бинарные соединения
17.09.2018. Бинарные соединения: определение. Многообразие природных бинарных соединений. Вода Хлорид натрия Углекислый газ. Бинарные вещества состоят ...Серная кислота и её свойства
Единственный путь, ведущий к знанию, - это деятельность. Б. Шоу. Птицы еще в яйце изучают географию. Как пролететь из Европы в Африку, как из Америки ...Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения
SiO2 , H2O , CO2 , AI2O3 , Fe2O3 , CO. Всесильная стихия природы-вода во все времена, во все периоды истории покоряла ум и воображение людей. Человек ...Конспекты
Сера и её соединения
Конспект урока с использованием ЭОР. Тема:. Сера и её соединения. Класс: 9. Цель:. изучить строение, свойства серы и его соединений. Задачи:. ...Сера, её физические и химические свойства
Конспект урока химии на тему «Сера, её физические и химические свойства» 9 клас. Цели урока:. 1. дать общую характеристику серы, рассмотреть аллотропные ...Сера и ее соединения. Аллотропия серы. Сероводород. Оксиды серы
Тема: Сера и ее соединения. Аллотропия серы. Сероводород. Оксиды серы (. IV, VI. ). . Цели урока:. рассмотреть вещество «сера», аллотропию серы, ...Кремний и его соединения
Конспект урока химии «Кремний и его соединения». Приветствую тебя, мой юный исследователь! Предлагаю тебе сегодня обратиться самым настоящим пиратом. ...Химический состав клеток. Неорганические соединения клетки
Урок на тему. «Химический состав клеток. Неорганические соединения клетки». Цели урока:. Расширение и углубление знаний учащихся о роли металлов ...Комплексные соединения
РАЗРАБОТКА УРОКА ПО ХИМИИ С ИСПОЛЬЗОВАНИЕМ КОМПЬЮТЕРНЫХ ТЕХНОЛОГИЙ. Тема: Комплексные соединения. Задачи урока. : повторить виды химической ...Алюминий и его соединения
А.К. 11 класс. 1 вариант. 1. По формуле 1S. 2. 2S. 2. 2P. 6. 3S. 2. 3P. 6. 4S. 2. 3d. 10. 4P. 2. укажите местоположение элемента в периодической ...Алюминий и его соединения
Урок по теме "Алюминий и его соединения". Цели урока:. Общеобразовательные:. через систему познавательных задач расширить и углубить знания ...Общая характеристика неметаллов. Элементы V А группы. Важнейщие соединения азота. Фосфор и его соединения
План учебного занятия № 14. Дата Предмет. химия. группа. Ф.И.О. преподавателя: Кайырбекова И.А. . І. Тема занятия:. Общая характеристика неметаллов. ...Сера
Подготовила студентка Суркова Екатерина. Алгоэвристическая программа для самостоятельного изучения. . учащимися темы «Сера». Сегодня тебе представляется ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:17 мая 2016
Категория:Химия
Содержит:18 слайд(ов)
Поделись с друзьями:
Скачать презентацию