Презентация "Серная кислота и её свойства" по химии – проект, доклад
Презентацию на тему "Серная кислота и её свойства" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 25 слайд(ов).
Слайды презентации
Список похожих презентаций
Азотная кислота и её свойства
Индивидуальная работа. Осуществите превращения 1 вариант: N2 → NO→NO2 2 вариант: N2→NH3→(NH4)SO4 3 вариант: NH3→N2→K3N. HNO. Содержание. Структурная ...Концентрированная серная кислота
«Ни одна наука не нуждается в эксперименте в такой степени, как химия. Ее основные законы, теории и выводы опираются на факты. Поэтому постоянный ...Вода и её свойства
А почему именно вода? Вода - удивительное химическое соединение, изучаемое не только химиками, но и физиками. Вода - не исключительно самая распространенная, ...Азотная кислота и ее свойства
Сегодня на уроке мы должны:. записать молекулярную и структурную формулы азотной кислоты; изучить химические свойства азотной кислоты в свете ОВР; ...Азотная кислота и её соли
Вспомните! Какие степени окисления проявляет азот в своих оксидах? Какие окислы азота вы знаете? Расскажите о N2O, NO, NO2? Какое из этих соединений ...Азотная кислота и её соли
Познакомиться с азотной кислотами, её солями- нитратами, их физическими и химическими свойствами ; Экспериментально изучить свойства азотной кислоты ...Многоликая уксусная кислота
Цели: - расширить кругозор учащихся о веществе, с которым они часто имеют дело в повседневной жизни; - рассмотреть взаимное влияние атомов в молекуле ...Металлы, свойства металлов
Металлы – химические элементы , образующие в свободном состоянии простые вещества с металлической связью. М.В. Ломоносов - металлы «светлое тело, ...Азотная кислота
Разминка:. А1. Степень окисления азота в азотной кислоте 1) +4 2) +5 3) +2 4) +3. Подготовка к Е Г Э. А 2. По физическим свойствам азот и аммиак 1) ...Кислоты, их классификация и свойства
images.yandex.ru. Дайте характеристику оксидам. Металла(неметалла) Солеобразующий (несолеобразующий) Кислотный (основный). MgO CO SiO2 CO2 N2O5 Li2O. ...Азот и его свойства
История открытия азота:. В 1772 г. Англичанин Д. Резерфорд установил, что воздух, оставшийся под колоколом, где жила несколько дней мышь, освобожденный ...Понятие об углеводах. Моносахариды. Химические свойства глюкозы
Классификация углеводов. Углеводы Cn(H2O)m Моносахариды Дисахариды Полисахариды. Моносахариды – углеводы, не подвергающиеся гидролизу. триозы тетрозы ...Оцтова кислота
Найвідоміша карбонова кислота. Оцтова або етанова кислота— органічна речовина з формулою CH3COOH. Слабка, насичена одноосновна карбонова кислота. ...Азотная кислота и ее соли
План изучения азотной кислоты. 1.Состав . 2.Строение. 3.Физические свойства. 4.Химические свойства. 5.Получение и применение. Состав и строение азотной ...азотная кислота
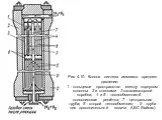
Рисунок 1.2 – Четырехполочная колонна синтеза аммиака мощностью 1360 т/сут 1 – люк для выгрузки катализатора; 2 – центральная труба; 3 – корпус катализа-торной ...Азотная кислота
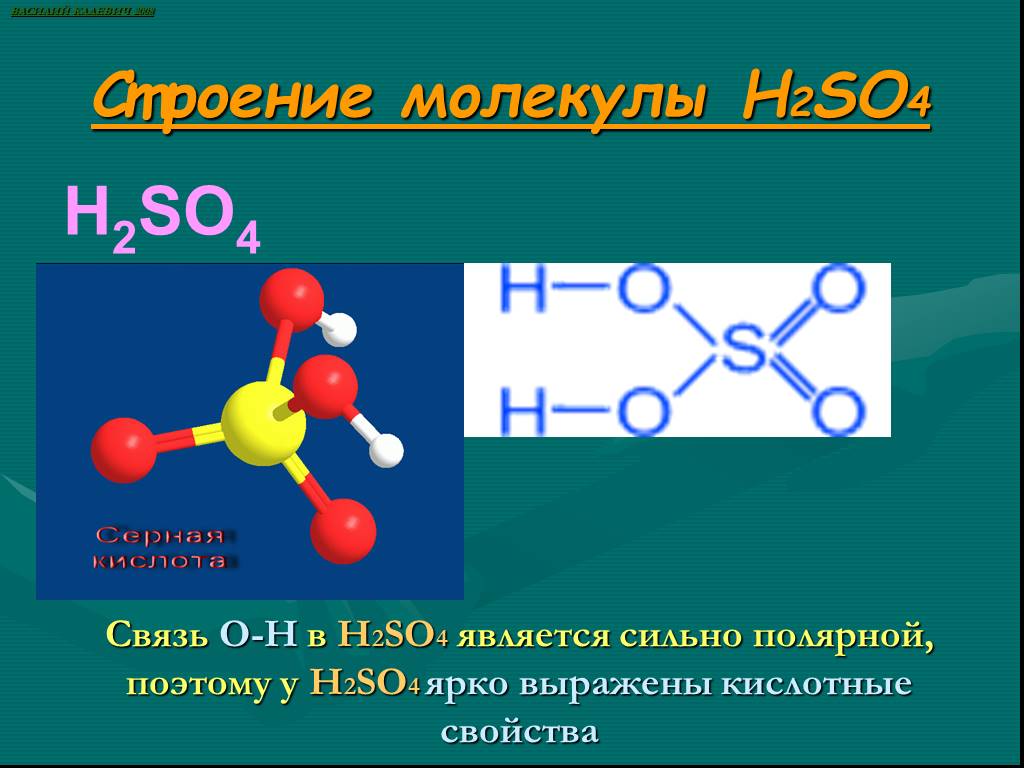
«Азотная кислота».Тема урока:. I. Строение молекулы.
Электронная формула :O : H :O: N : :O.
Структурная формула O // H ─ O ─ N \\ O.
Молекулярная ...
Азотная кислота
НЕМНОГО ИСТОРИИ. Монах-алхимик Бонавентура в 1270 году в поисках универсального растворителя «алкагеста» решил нагреть смесь железного купороса с ...Окислительно-восстановительные свойства соединений хрома в различных средах
Цель урока:. Сформировать понятие о зависимости свойств соединений хрома от степени окисления элемента через организацию исследовательской деятельности ...Оксиды: их свойства и применение
Цели урока:. Блок-схема « Способы получения и химические свойства оксидов». . Получение оксидов. 1 способ: окисление металлов где CuO – оксид меди ...Азотная кислота и ее соли
Это вещество было описано арабским химиком в VIII веке Джабиром ибн Хайяном (Гебер) в его труде «Ямщик мудрости», а с ХV века это вещество добывалось ...Конспекты
Оксид серы (VI). Серная кислота и её соли
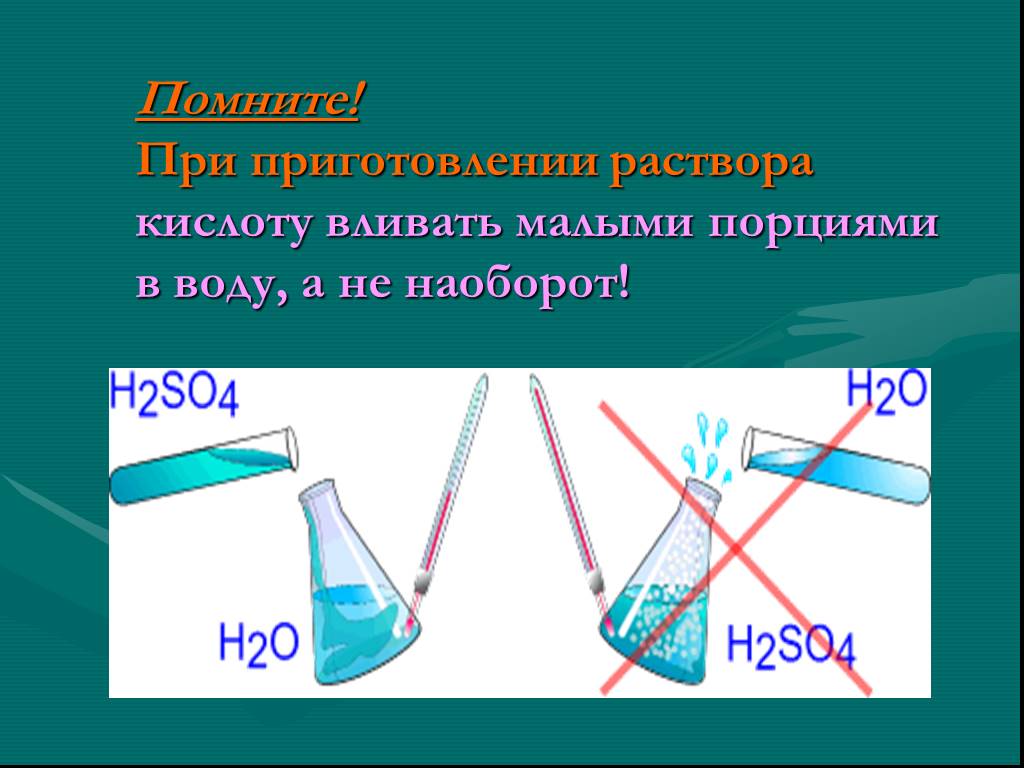
Дата_____________ Класс_______________. Тема: Оксид серы (VI). Серная кислота и её соли. Цели урока:. познакомить учащихся со свойствами серной ...Оксид серы (VI). Серная кислота
муниципальное бюджетное общеобразовательное учреждение. средняя общеобразовательная школа № 44 города Кропоткин. . муниципального образования ...Азотная кислота строение, свойстваи применение
Открытый урок по химии в 9 классе по теме:. . . « Азотная кислота строение, свойстваи применение». Учитель МКОУ СОШ с.п. Кара-Суу Жабоева Раиса ...Азотная кислота и ее соли. Окислительные свойства азотной кислоты
Урок 21. Азотная кислота и ее соли. Окислительные свойства азотной кислоты. Цели урока:. 1. Охарактеризовать азотную кислоту по следующей схеме: ...Азотная кислота: состав молекулы, физические и хими- ческие свойства
Урок по химии разработан к учебнику И. И. Новошинского, Н. С. Новошинской. Технология критического мышления. Тема урока:. «Азотная кислота: состав ...Азотная кислота и ее свойства, получение и применение. Соли азотной кислоты
Тема: «Азотная кислота и ее свойства, получение и применение. Соли азотной кислоты» (урок – исследование). Цели урока. Образовательная:. ...Угольная кислота и её соли
Технологическая карта урока. «Угольная кислота и её соли» в соответствии с ФГОС ООО. Исполнитель: Подгорнова Галина Александровна,. . учитель ...Оксид серы (VI), серная кислота
МКОУ «СОШ а.Жако». Разработка урока по химии в 9 классе на тему:. Оксид серы (VI. ), серная кислота. Учитель ...Серная кислота и ее соли
Тема: Серная кислота и ее соли. Цель урока:. Продолжить изучать соединения серы на примере серной кислоты и ее солей. Изучить свойства серной кислоты. ...Угольная кислота и её соли
Урок химии в 9-м классе по теме "Угольная кислота и её соли". Тип урока:. изучение и первичное закрепление новых знаний. Цели. :. Образовательная. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:31 января 2019
Категория:Химия
Содержит:25 слайд(ов)
Поделись с друзьями:
Скачать презентацию