Презентация "Азотная кислота" (9 класс) по химии – проект, доклад
Презентацию на тему "Азотная кислота" (9 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 14 слайд(ов).
Слайды презентации
Список похожих презентаций
Азотная кислота и её соли
Познакомиться с азотной кислотами, её солями- нитратами, их физическими и химическими свойствами ; Экспериментально изучить свойства азотной кислоты ...Азотная кислота и ее соли
План изучения азотной кислоты. 1.Состав . 2.Строение. 3.Физические свойства. 4.Химические свойства. 5.Получение и применение. Состав и строение азотной ...Азотная кислота и ее соли
Это вещество было описано арабским химиком в VIII веке Джабиром ибн Хайяном (Гебер) в его труде «Ямщик мудрости», а с ХV века это вещество добывалось ...Азотная кислота и её свойства
Индивидуальная работа. Осуществите превращения 1 вариант: N2 → NO→NO2 2 вариант: N2→NH3→(NH4)SO4 3 вариант: NH3→N2→K3N. HNO. Содержание. Структурная ...Азотная кислота и её соли
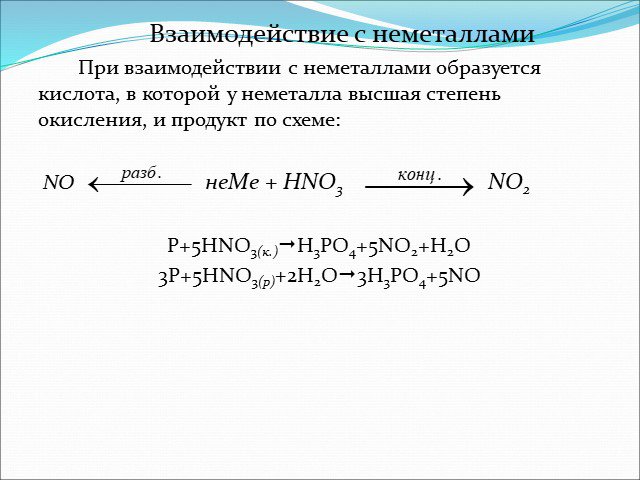
Вспомните! Какие степени окисления проявляет азот в своих оксидах? Какие окислы азота вы знаете? Расскажите о N2O, NO, NO2? Какое из этих соединений ...Азотная кислота и ее свойства
Сегодня на уроке мы должны:. записать молекулярную и структурную формулы азотной кислоты; изучить химические свойства азотной кислоты в свете ОВР; ...Азотная кислота
«Азотная кислота».Тема урока:. I. Строение молекулы.
Электронная формула :O : H :O: N : :O.
Структурная формула O // H ─ O ─ N \\ O.
Молекулярная ...
Азотная кислота
Разминка:. А1. Степень окисления азота в азотной кислоте 1) +4 2) +5 3) +2 4) +3. Подготовка к Е Г Э. А 2. По физическим свойствам азот и аммиак 1) ...Азотная кислота основные понятия
Физические и физико-химические свойства. Молекула имеет плоскую структуру (длины связей в нм): азот в азотной кислоте четырёхвалентен, степень окисления ...Азотная кислота по химии
Тема: «Азотная кислота» Цель урока: Рассмотреть свойства азотной кислоты и области ее применения. План урока: 1. Проверка Д/З (письменная работа); ...Азотная кислота
HNO3. Состав. Строение. Свойства. H O N —. степень окисления азота. валентность азота. +5 IV химическая связь. ковалентная полярная. Азотная кислота ...азотная кислота
Рисунок 1.2 – Четырехполочная колонна синтеза аммиака мощностью 1360 т/сут 1 – люк для выгрузки катализатора; 2 – центральная труба; 3 – корпус катализа-торной ...Хлороводород. Соляная кислота
Хлороводород HCl. HCl – это бесцветный газ с резким неприятным запахом, тяжелее воздуха. Докажем это: М (HCl)= 1+35,5=36,5 г/моль М (воздуха)= 29 ...Уксусная кислота
Уксусная кислота. Уксусная кислота (метанкарбоновая, этановая кислота) CH3COOH — бесцветная жидкость с резким запахом и кислым вкусом. Температура ...Фосфорная кислота и ее свойства
Тема урока:. Фосфорная кислота и ее свойства. Сегодня на уроке мы должны:. Образовательные: Изучить физические и химические свойства фосфорной кислоты ...Сульфатна кислота
Фізичні властивості. Сульфатна кислота - безбарвна оліїста рідина без запаху, майже удвічі важча за воду, необмежено розчиняється у воді, тобто може ...Угольная кислота и её соли
Выберите из предложенных утверждений только те, которые справедливы для: 1вариант – алмаза, 2 вариант - графита. Прозрачный, бесцветный Очень твердый ...Соляная кислота и её соли
« Просто знать - ещё не всё, знания нужно уметь использовать». Гёте. видео. Получение соляной кислоты:. 1.В промышленности получают сжиганием водорода ...Серная кислота, свойства серной кислоты
Состав. Кислоты - это сложные вещества, в молекулах которых содержат атомы водорода и кислотный остаток H-R, где R-кислотный остаток При электролитической ...Серная кислота и её свойства
Единственный путь, ведущий к знанию, - это деятельность. Б. Шоу. Птицы еще в яйце изучают географию. Как пролететь из Европы в Африку, как из Америки ...Конспекты
Азотная кислота и ее свойства, получение и применение. Соли азотной кислоты
Тема: «Азотная кислота и ее свойства, получение и применение. Соли азотной кислоты» (урок – исследование). Цели урока. Образовательная:. ...Азотная кислота. Строение молекулы и получение
Дата_____________ Класс_______________. Тема:. . Азотная кислота. Строение молекулы и получение. Цели урока:. знать строение, свойства и применение ...Азотная кислота: состав молекулы, физические и хими- ческие свойства
Урок по химии разработан к учебнику И. И. Новошинского, Н. С. Новошинской. Технология критического мышления. Тема урока:. «Азотная кислота: состав ...Азотная кислота строение, свойстваи применение
Открытый урок по химии в 9 классе по теме:. . . « Азотная кислота строение, свойстваи применение». Учитель МКОУ СОШ с.п. Кара-Суу Жабоева Раиса ...Азотная кислота и ее соли. Окислительные свойства азотной кислоты
Урок 21. Азотная кислота и ее соли. Окислительные свойства азотной кислоты. Цели урока:. 1. Охарактеризовать азотную кислоту по следующей схеме: ...Азотная кислота
Автор: Трегуб Алеся Васильевна, учитель химии МБОУ СОШ №2 г. Вилючинска. Цель урока:. продолжить формирование у учащихся понятия «кислота» на примере ...Серная кислота
Казенное общеобразовательное учреждение. «Вечерняя (сменная) общеобразовательная школа 1». г. Омска. Конспект урока по химии. в 9 классе. ...Угольная кислота и её соли
Технологическая карта урока. «Угольная кислота и её соли» в соответствии с ФГОС ООО. Исполнитель: Подгорнова Галина Александровна,. . учитель ...Угольная кислота и её соли
Урок химии в 9-м классе по теме "Угольная кислота и её соли". Тип урока:. изучение и первичное закрепление новых знаний. Цели. :. Образовательная. ...Угольная кислота и ее соли
Открытый урок по химии в 9 классе по теме:. . . « Угольная кислота и ее соли». Учитель МКОУ СОШ с.п. Кара-Суу Жабоева Раиса Муратовна. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:25 апреля 2015
Категория:Химия
Классы:
Содержит:14 слайд(ов)
Поделись с друзьями:
Скачать презентацию