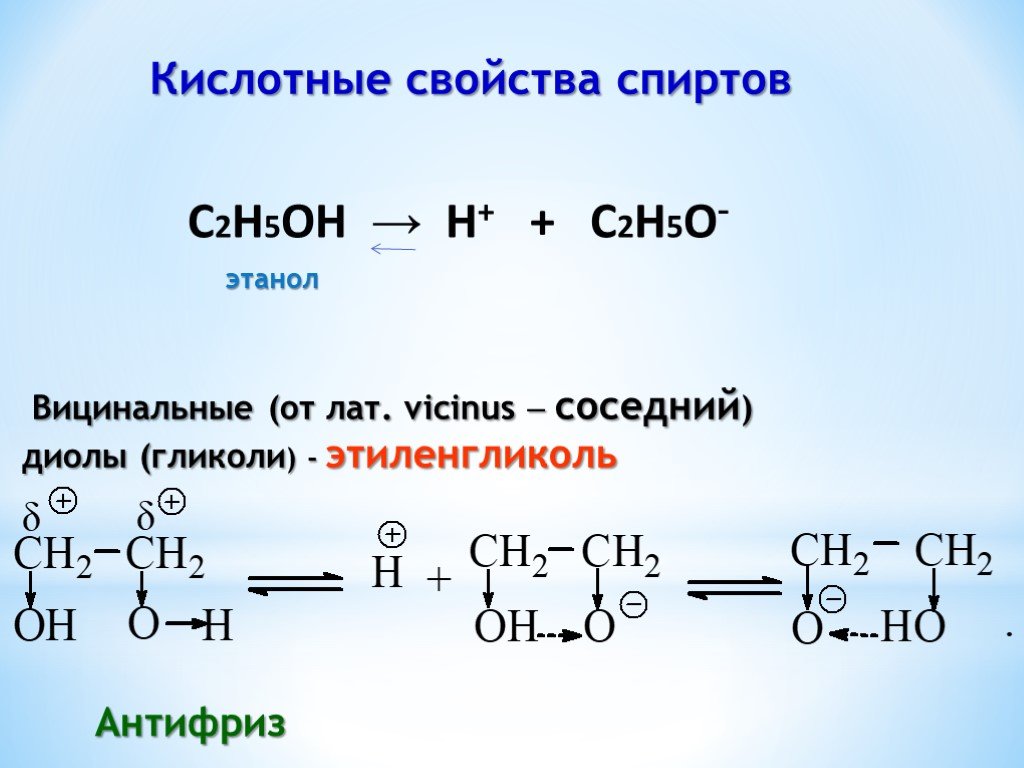
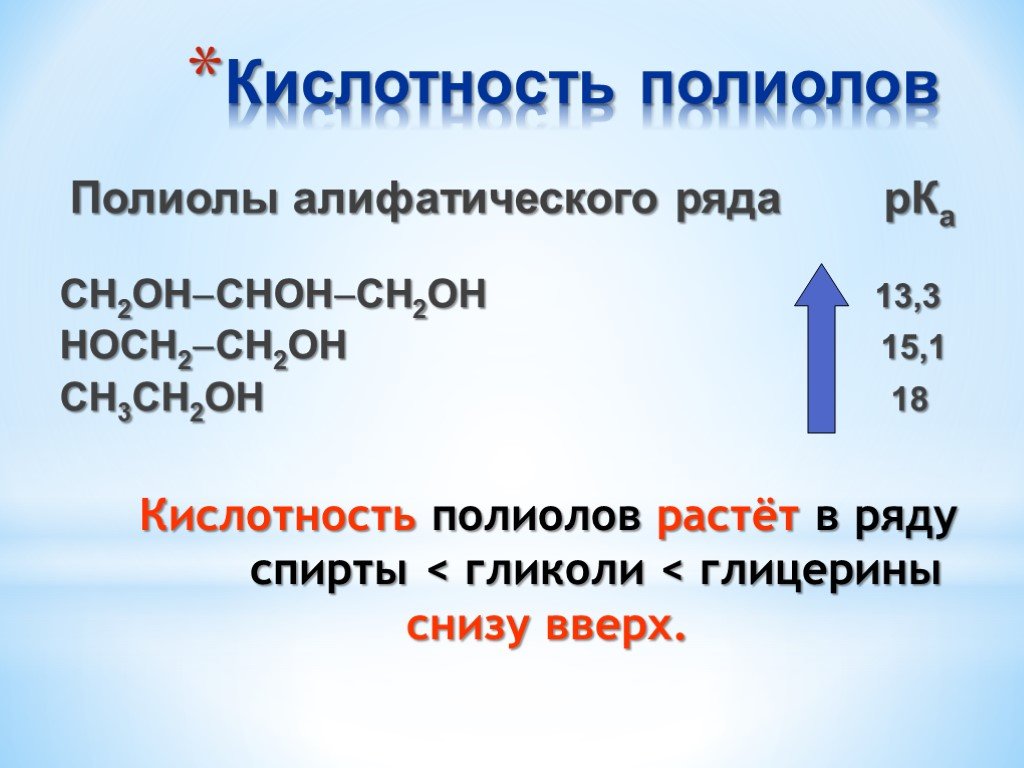
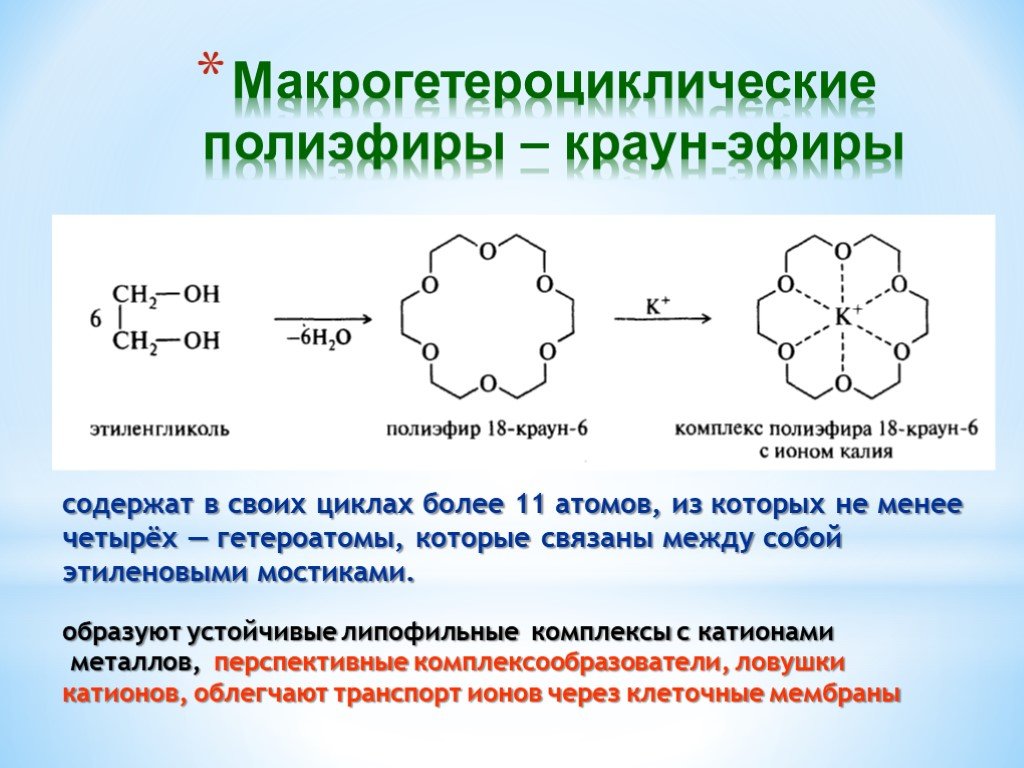
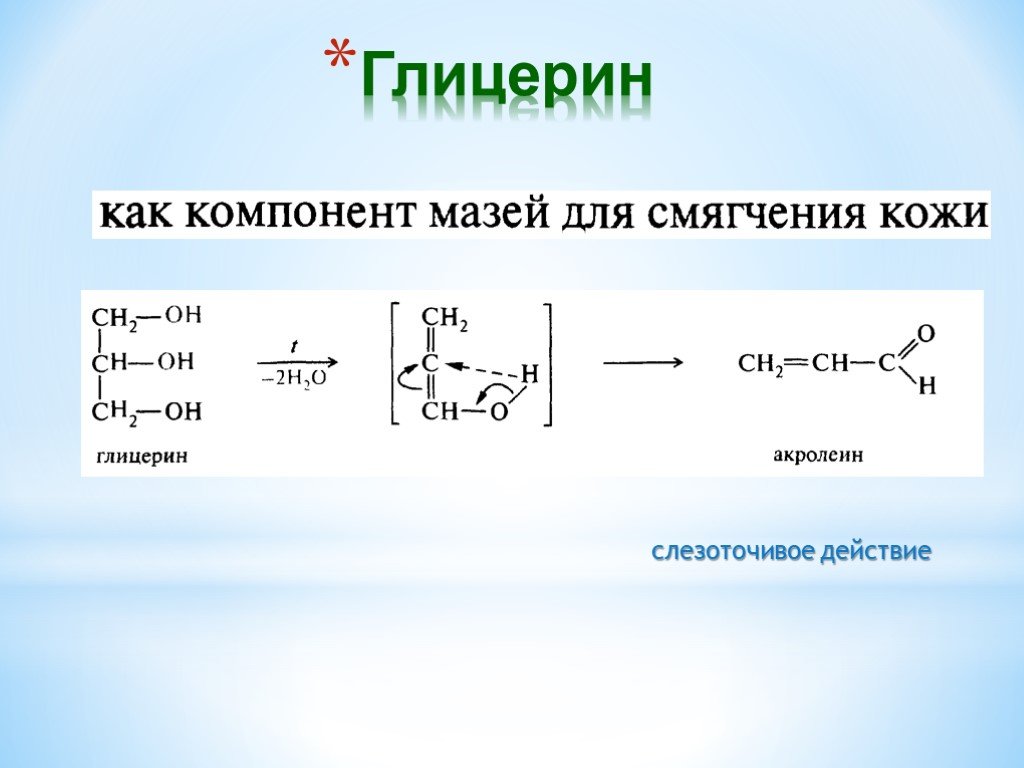
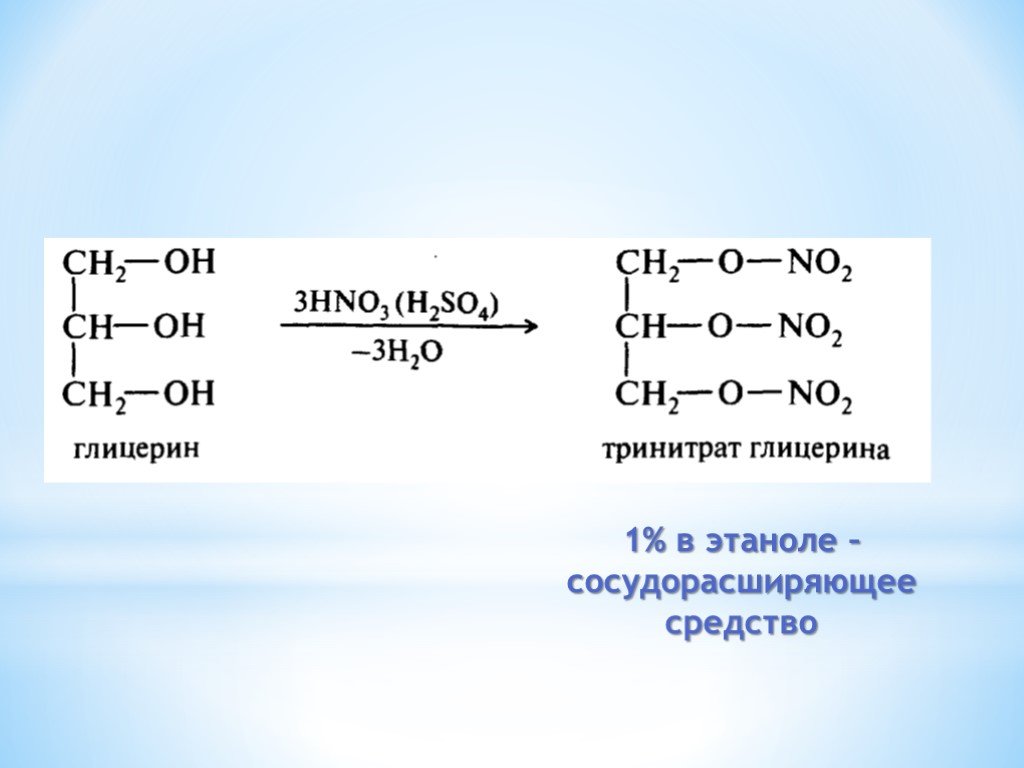
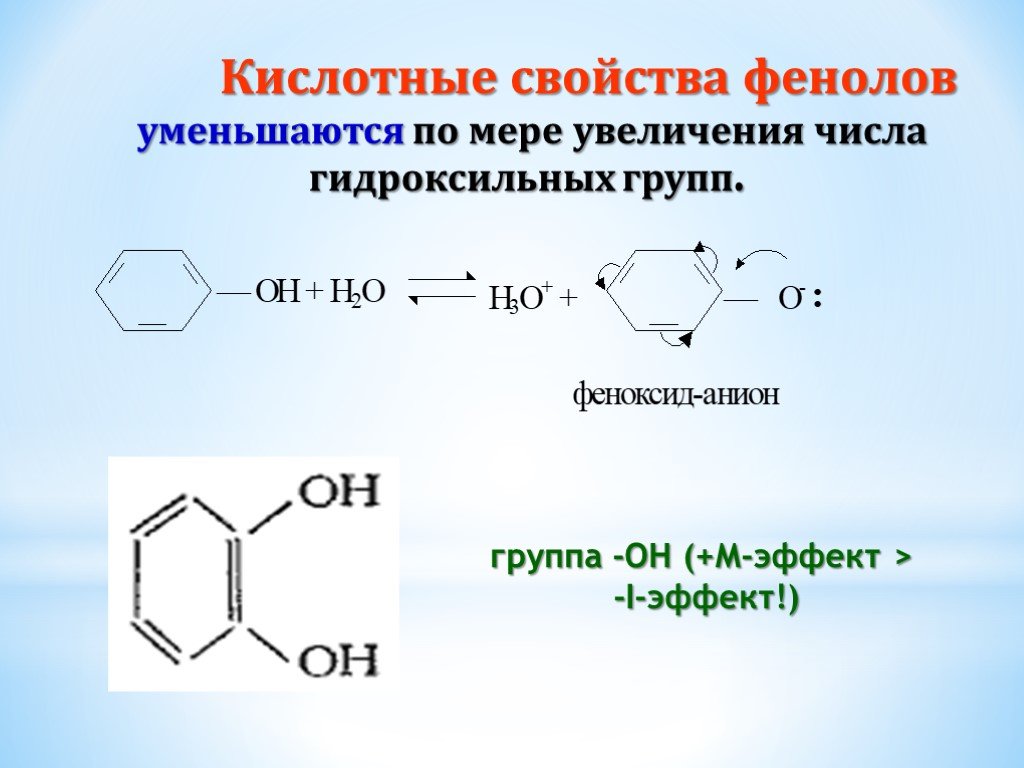
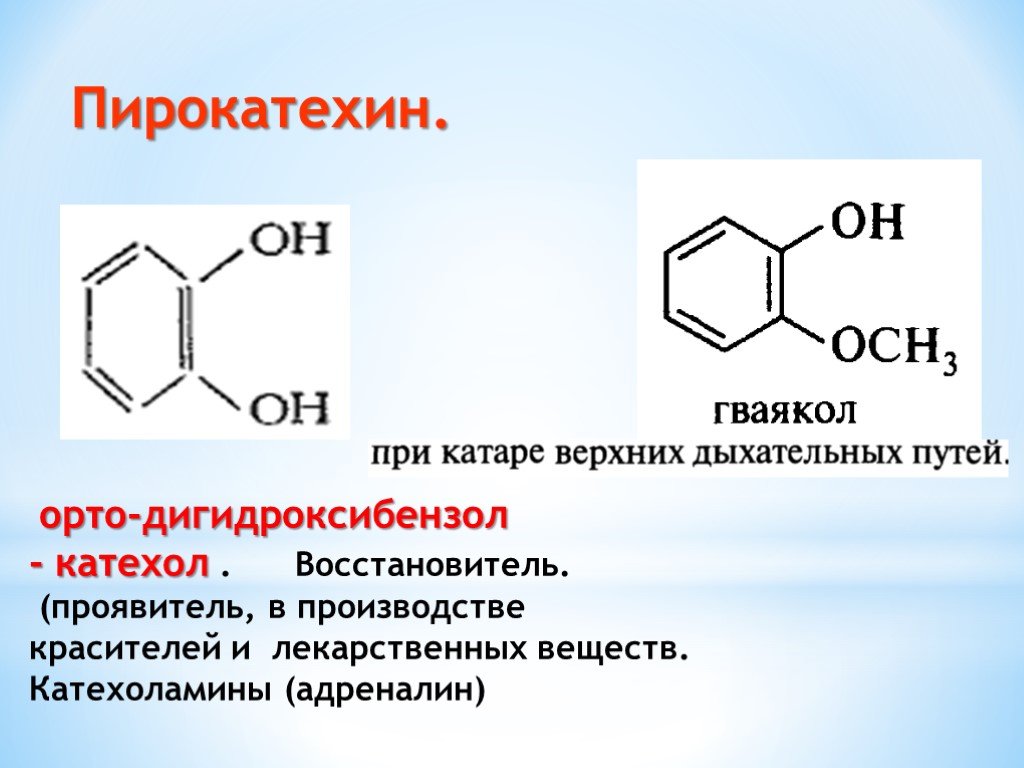
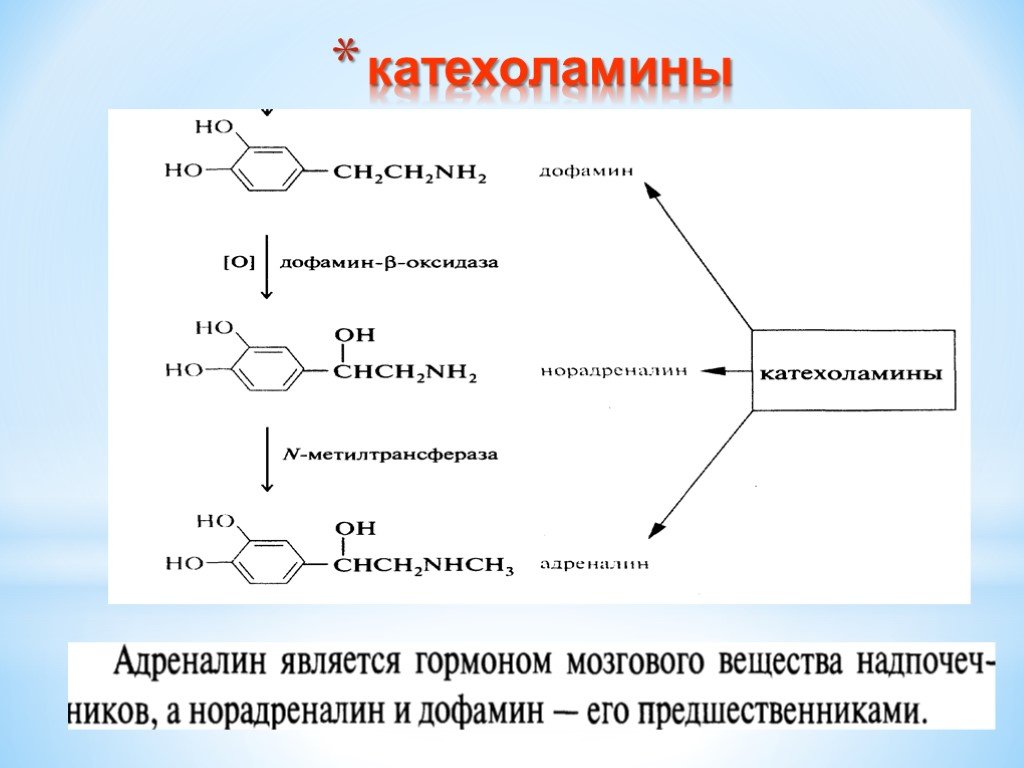
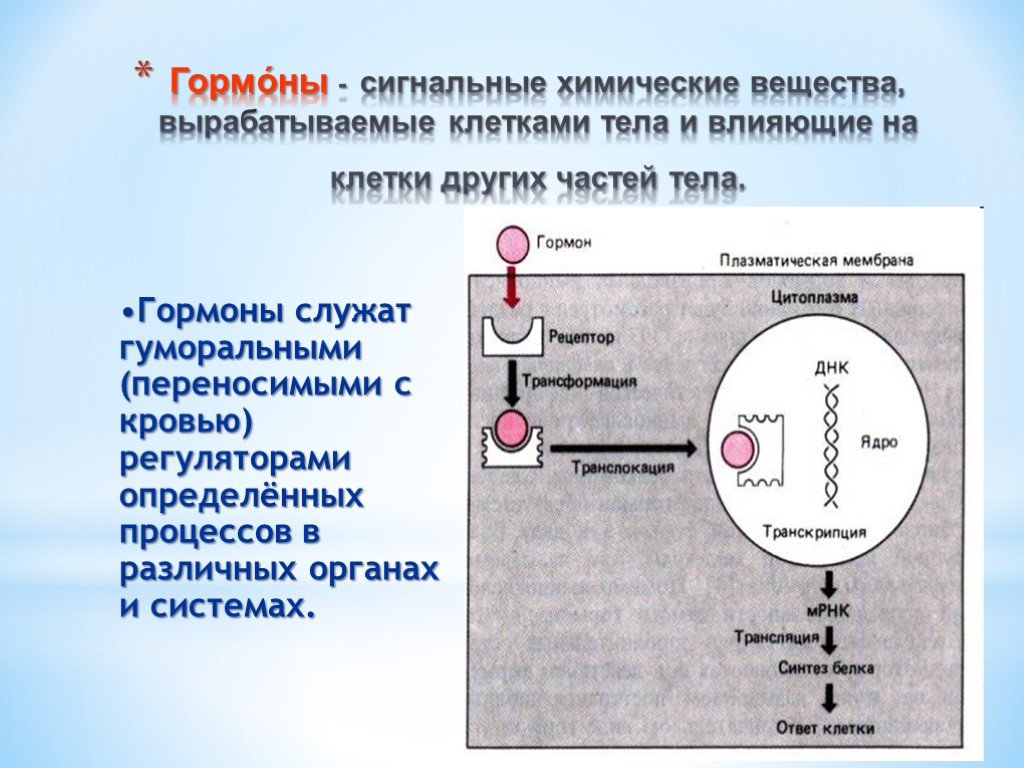
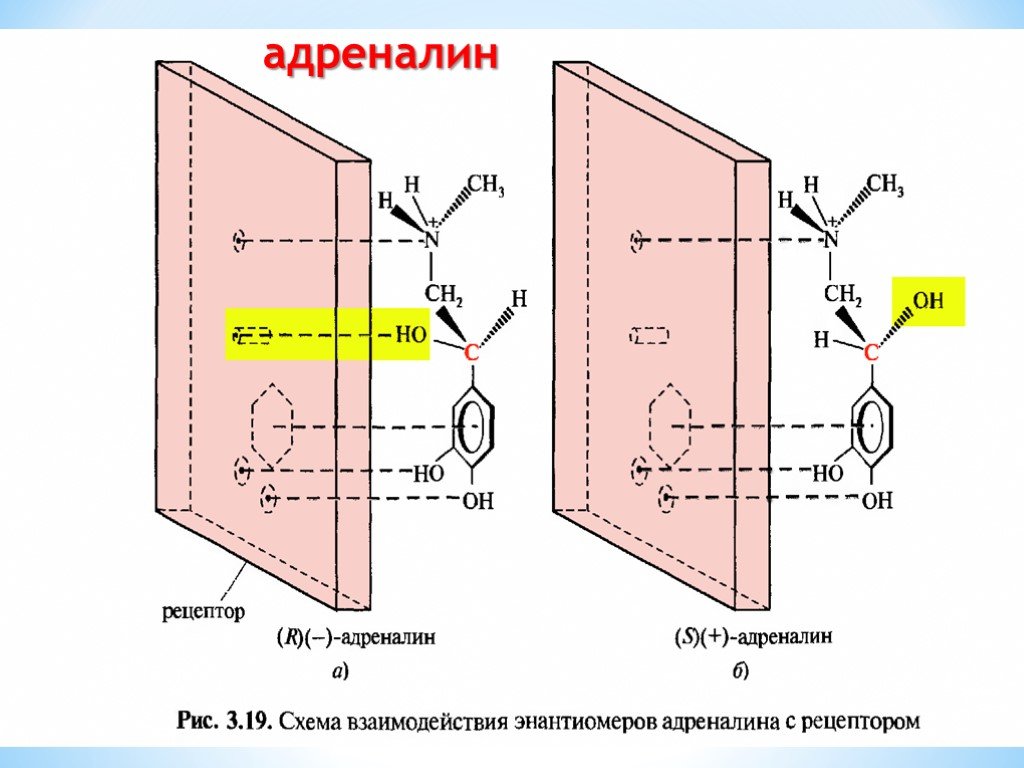
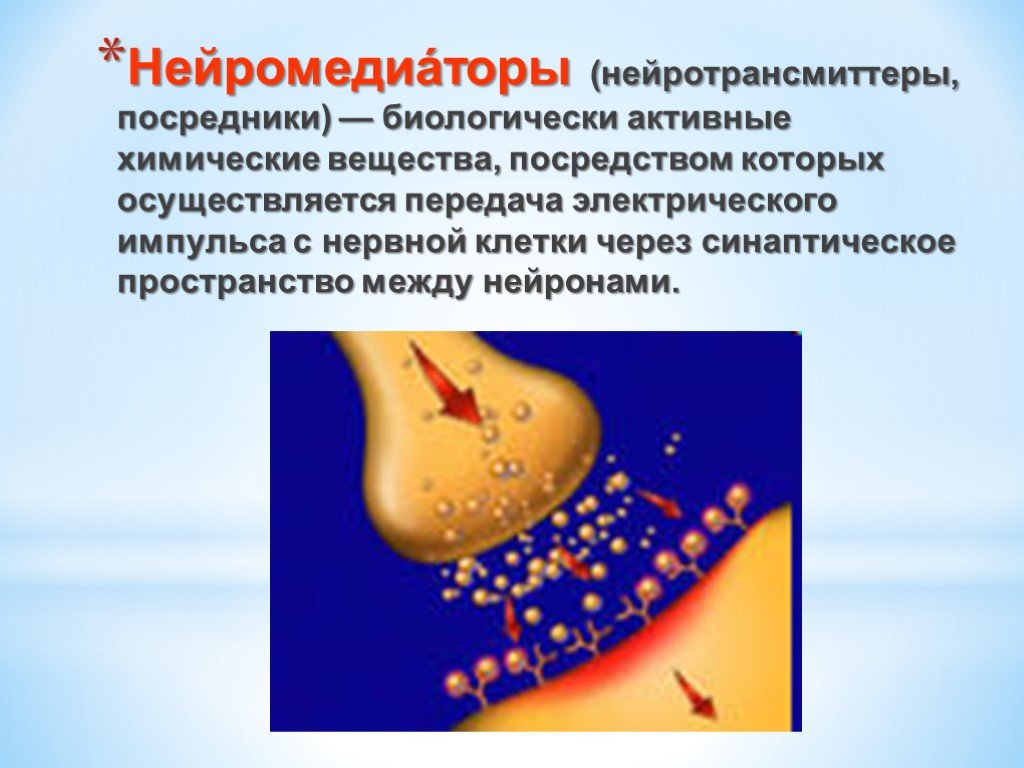
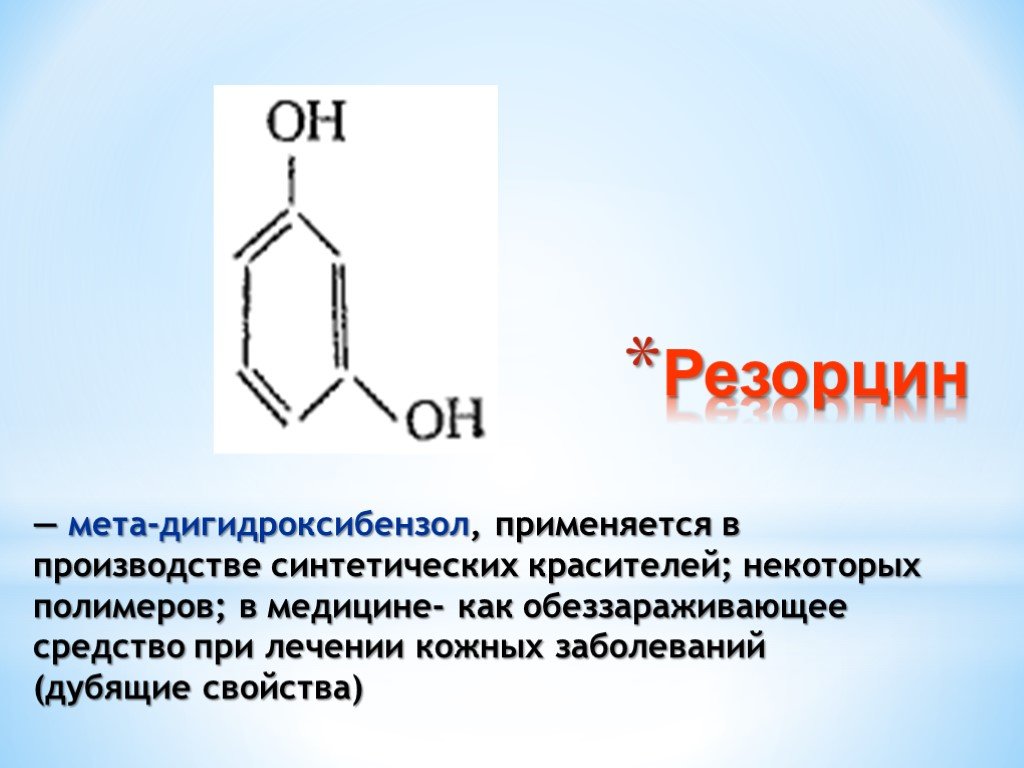
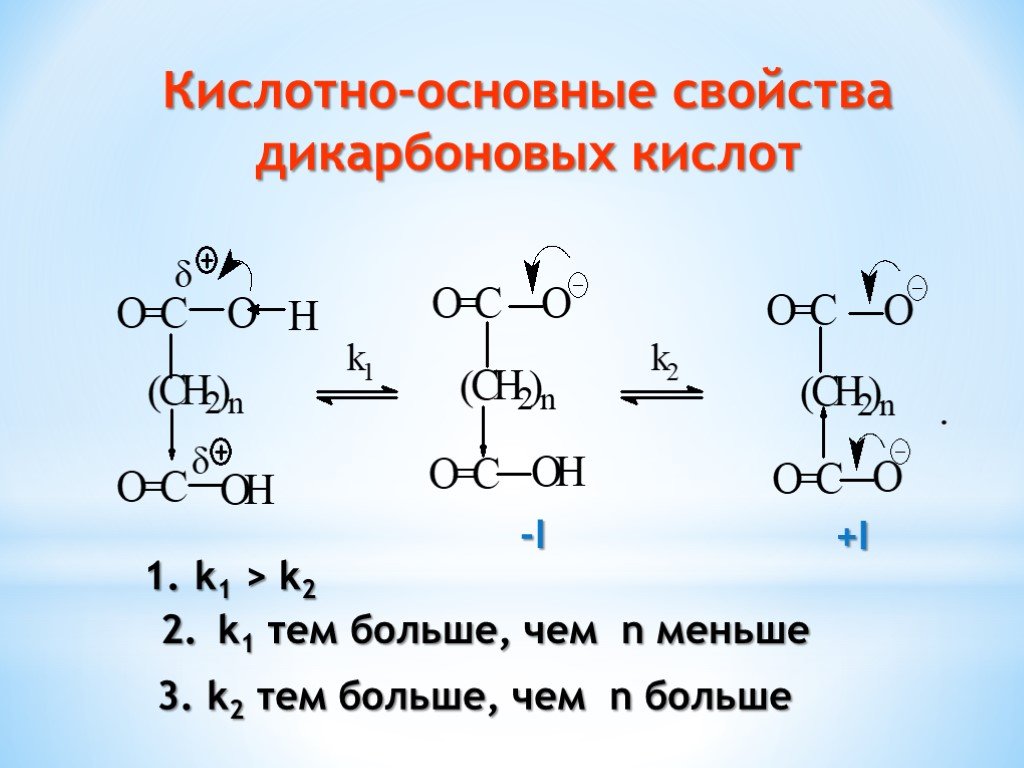
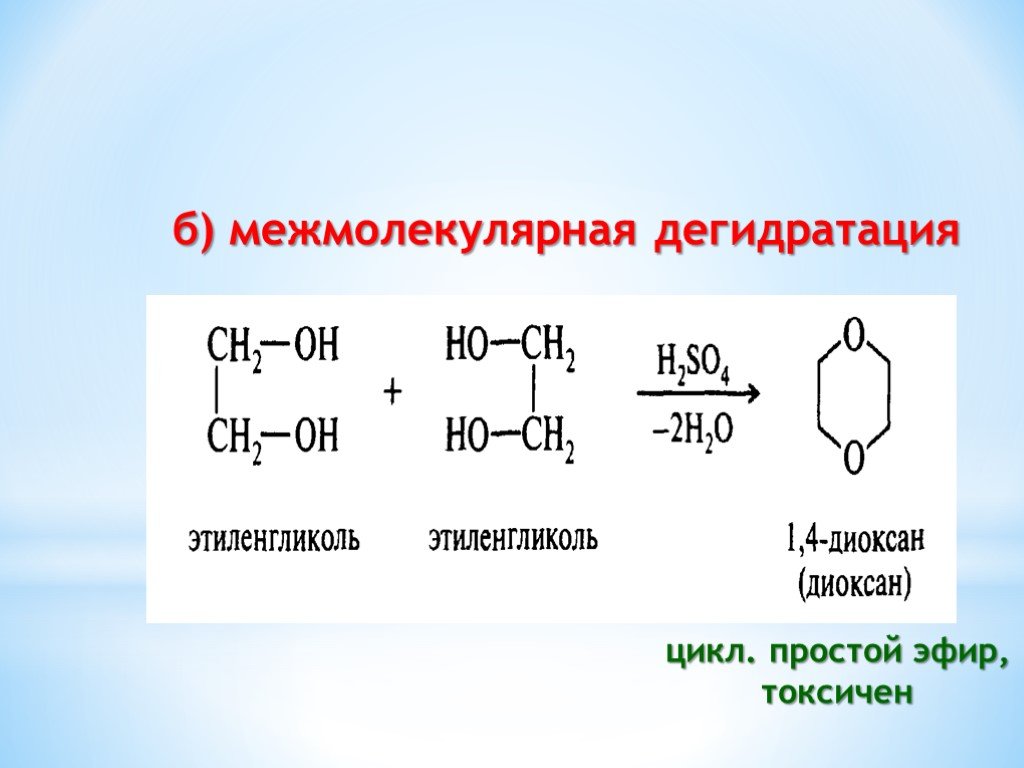
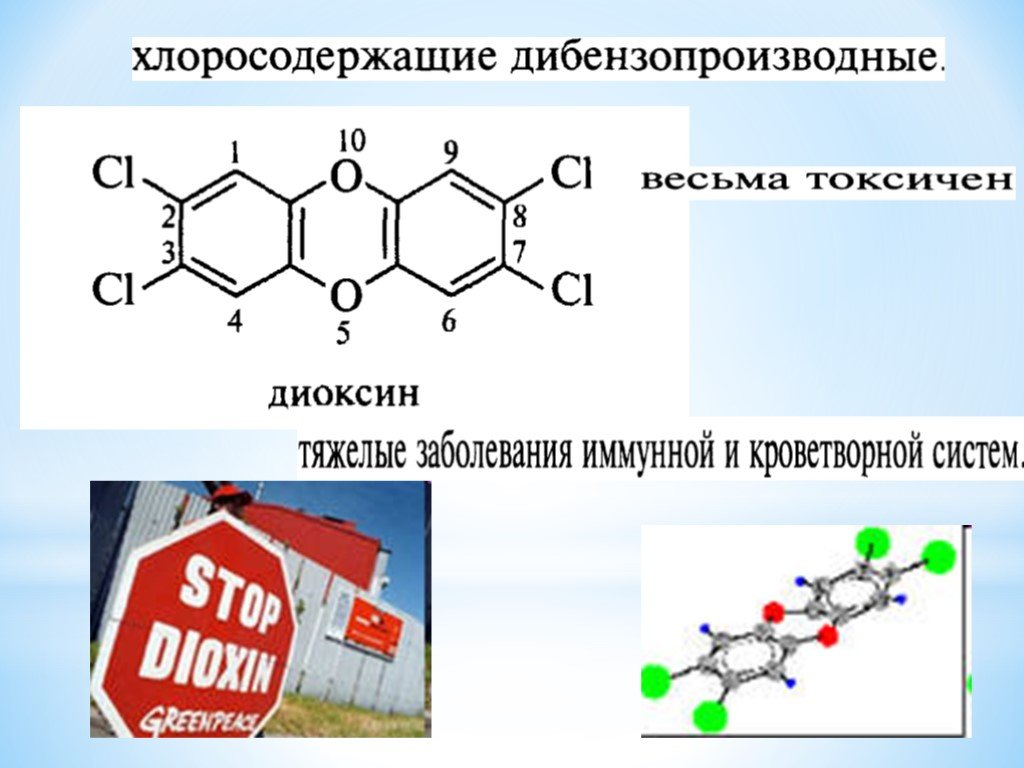
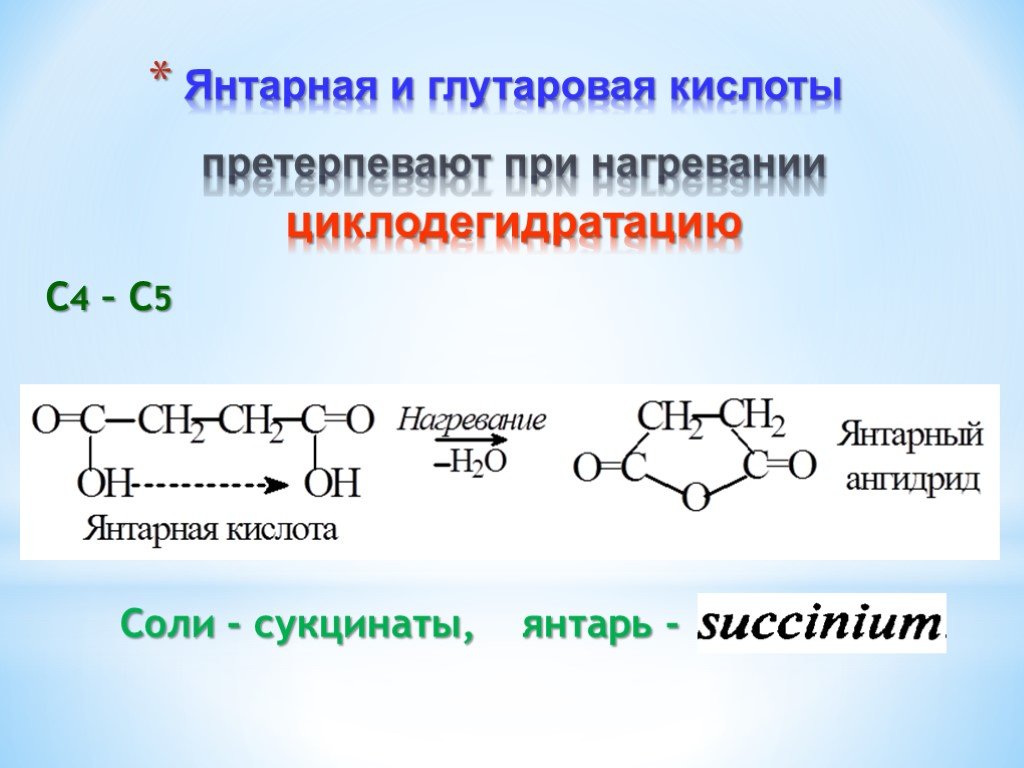
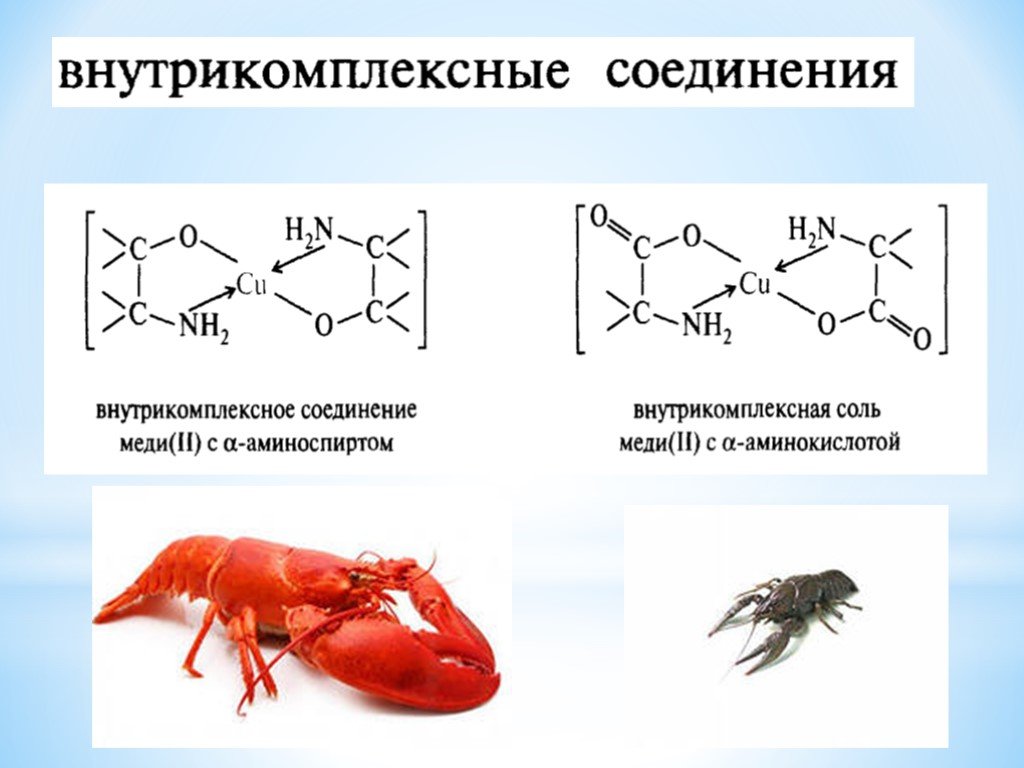
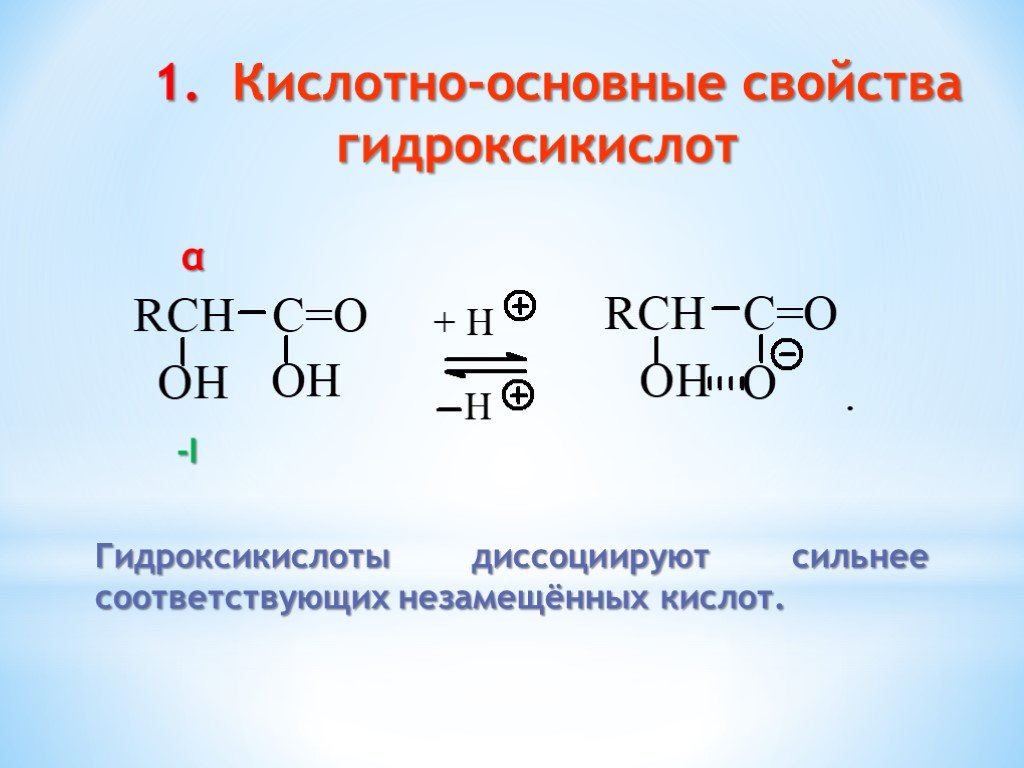
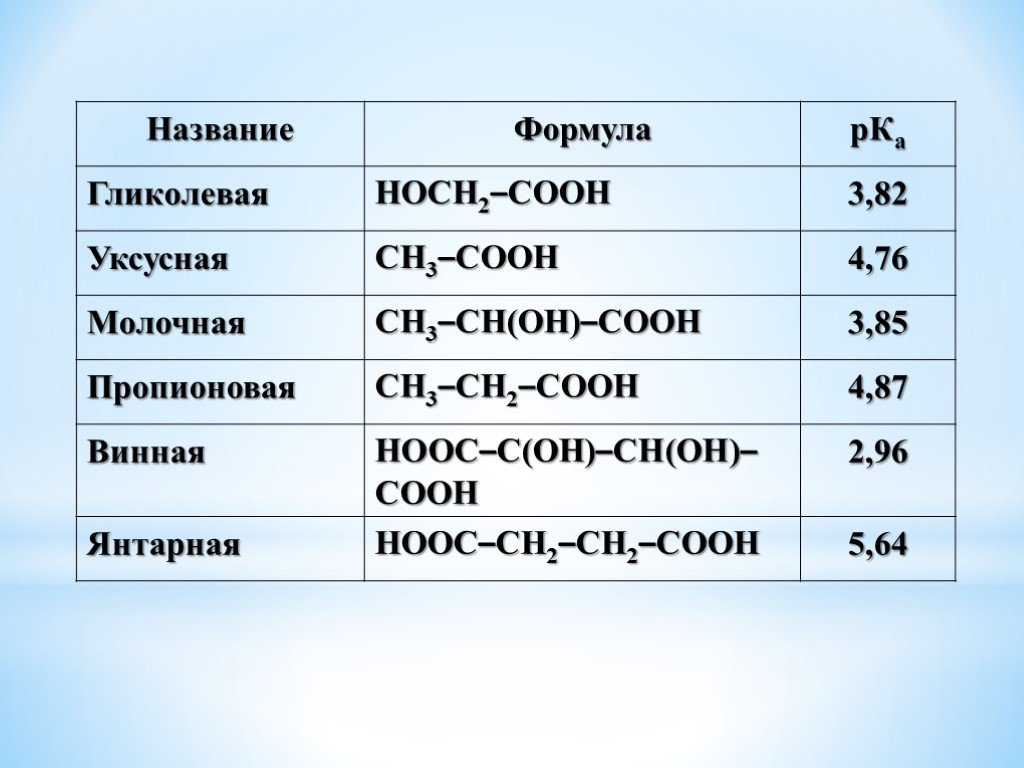
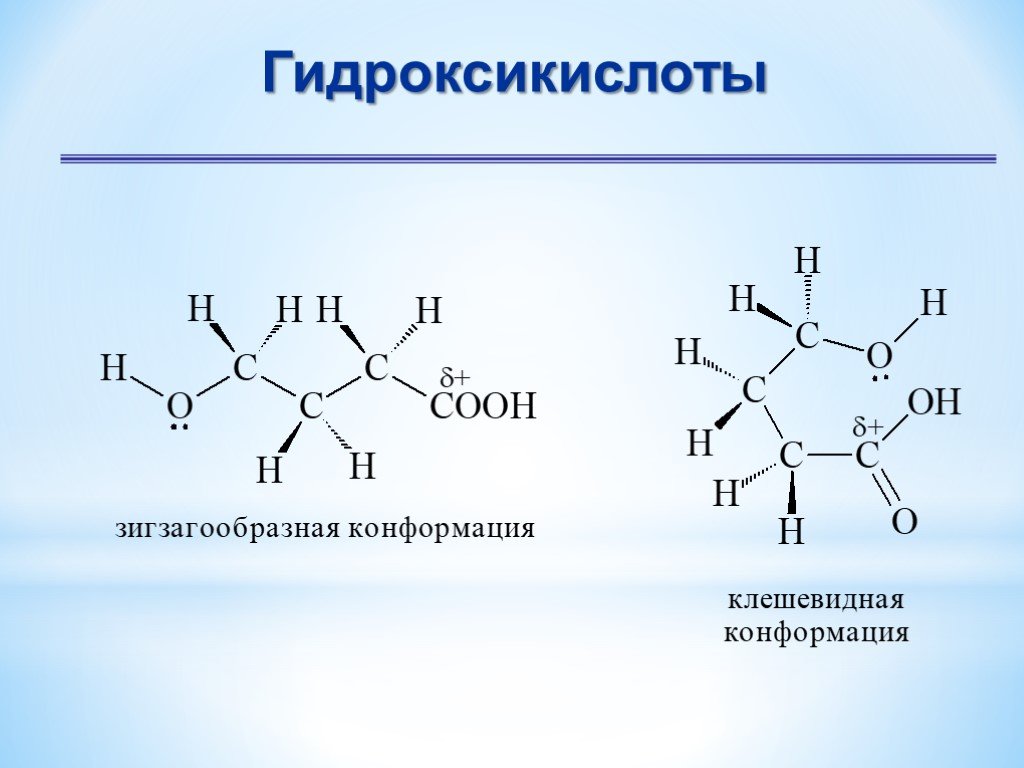
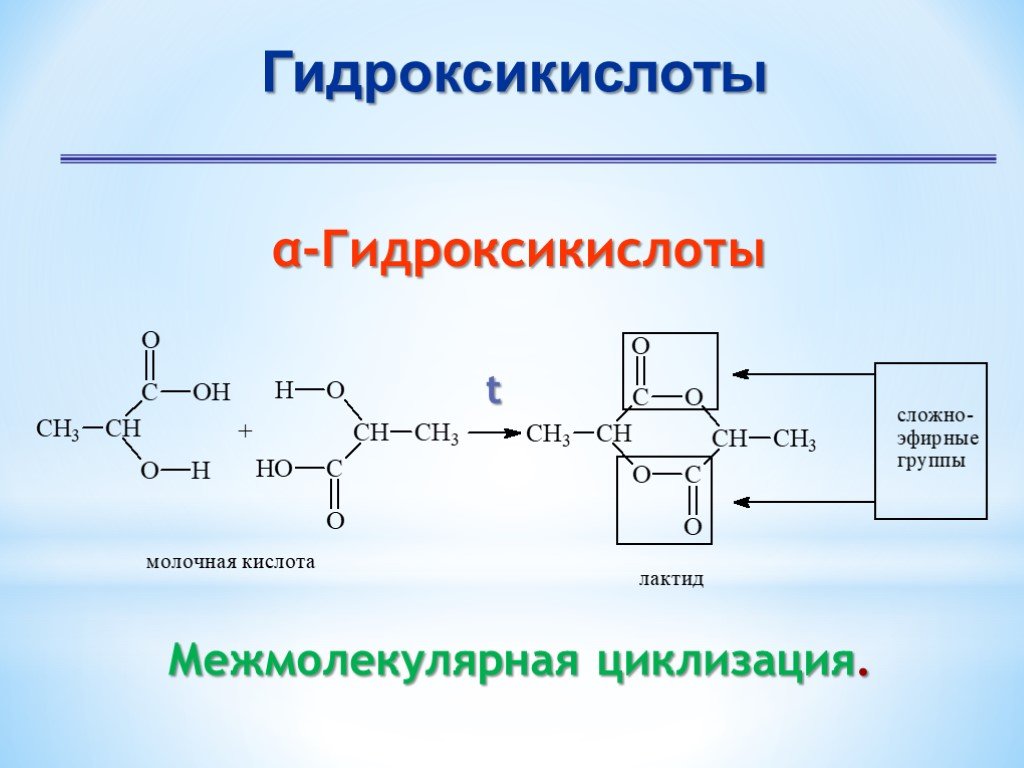
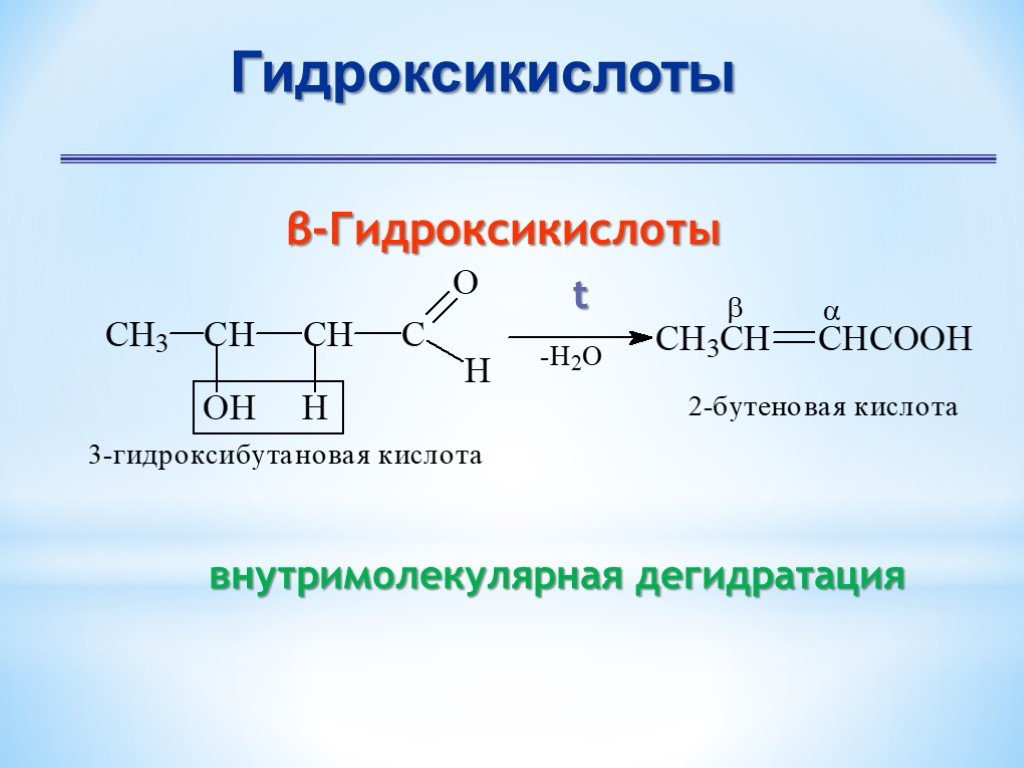
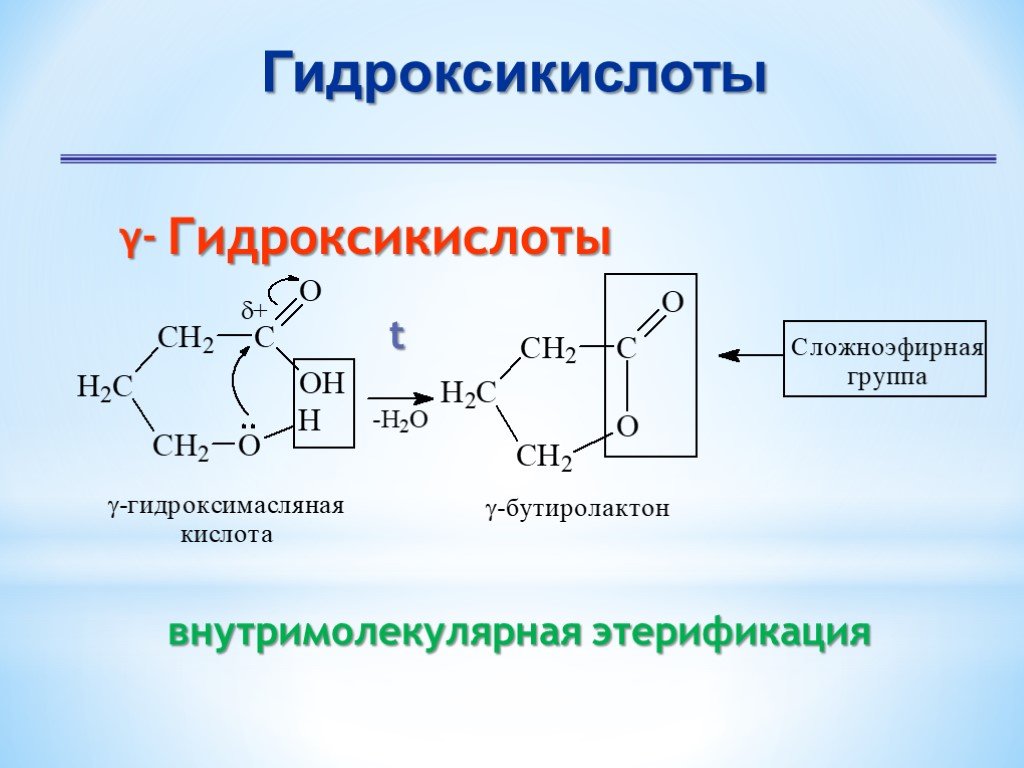
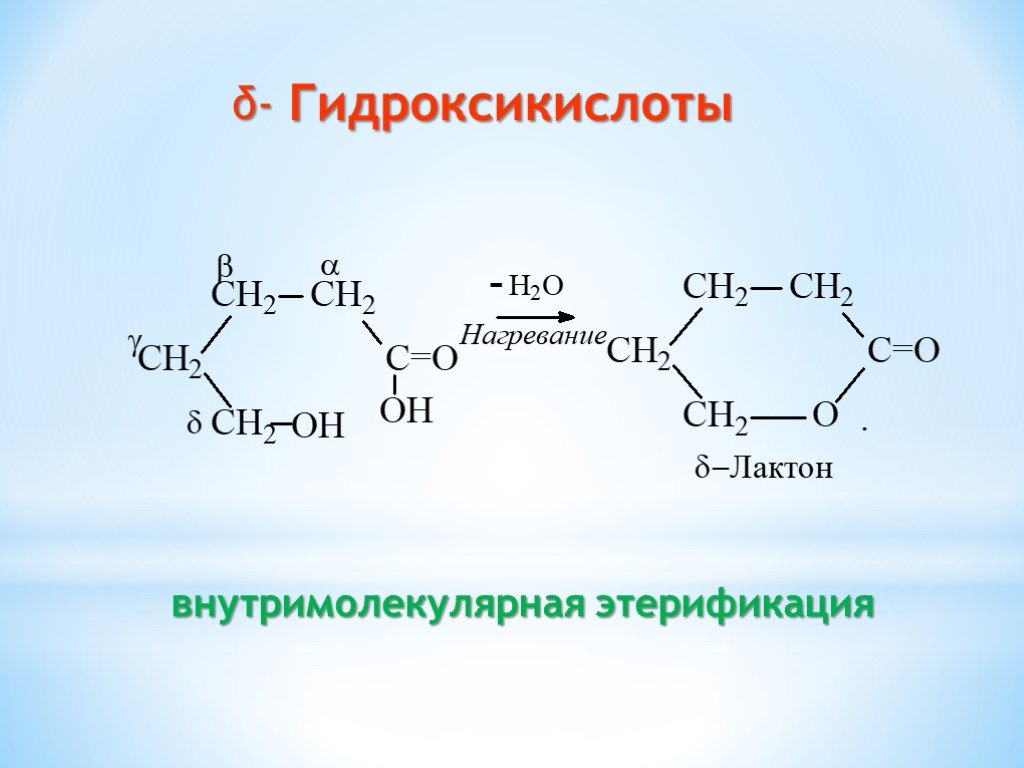
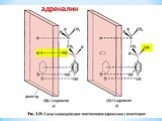
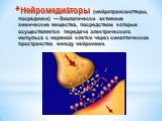
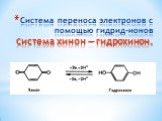
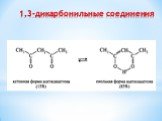
Презентация "Поли- и гетерофункциональные соединения, участвующие в процессах жизнидеятельности" по химии – проект, доклад
Презентацию на тему "Поли- и гетерофункциональные соединения, участвующие в процессах жизнидеятельности" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 50 слайд(ов).
Слайды презентации
Список похожих презентаций
Синтетические высокомолекулярные соединения и полимеры на их основе
Сегодня на уроке…. Общая характеристика синтетических высокомолекулярных соединений(ВМС). Полимеры. Происхождение полимеров. Способ получения полимеров. ...Ферменты как биологически активные соединения
Ферменты (энзимы) – это органические катализаторы белковой природы, которые ускоряют реакции, необходимые для функционирования живых организмов. Типы ...Природные соединения кремния
«Минерал есть химическое соединение химических элементов, образовавшихся естественным путем, без вмешательства человека. Это своего рода здание, построенное ...Металлы и их соединения
Определите металл. 1. Этот металл легче свинца в 5 раз, а золота – в 20 раз. Стержень этого металла пишет по бумаге. 2. «Зелёное золото» содержит ...Неорганические соединения - формулы и реакции
Цели урока. В игровой форме обобщить и закрепить знания о химических свойствах основных классов неорганических соединений и их взаимопревращениях. ...Комплексные соединения
Координационная теория А.Вернера. В 1893 г. швейцарским химиком-неоргаником Альфредом Вернером (1866–1919) была сформулирована теория, позволившая ...Кремний и его соединения
Короткова Фаина Алексеевна, учитель химии и биологии МБОУ Летуновской СОШ. Контактная информация: - e-mail: korotkova_faina@mail.ru - тел. +7 903 ...Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения
SiO2 , H2O , CO2 , AI2O3 , Fe2O3 , CO. Всесильная стихия природы-вода во все времена, во все периоды истории покоряла ум и воображение людей. Человек ...Важнейшие представители бинарных соединений – оксиды и летучие водородные соединения
Н2О - вода. СО2 углекислый газ. СУХОЙ ЛЁД. NH3 аммиак. HCL хлороводород. Бесцветный газ. Тяжелее воздуха. Хорошо растворяется в воде. Раствор хлороводорода ...Бинарные соединения
ОПРЕДЕЛЕНИЕ. Бинарные соединения – это соединения, состоящие из двух химических элементов. H2O, NH3, K2S, P2O5, CaC2. Бинарные соединения - хлориды. ...Бинарные соединения
17.09.2018. Бинарные соединения: определение. Многообразие природных бинарных соединений. Вода Хлорид натрия Углекислый газ. Бинарные вещества состоят ...Бинарные соединения
Классификация сложных веществ. Бинарные соединения – это вещества, состоящие из двух разных атомов. Как составить формулу бинарного соединения. Знать ...Алюминий и его соединения
Учителя химии: Гершановская Евгения Владимировна ГБОУ СОШ № 880 Город Москва Попова Светлана Анатольевна ГБОУ СОШ № 1465 Город Москва. СОДЕРЖАНИЕ. ...Алюминий и его соединения
Стартовое задание. Выполнение задания А оценивается одним баллом. Выполнение задания В оценивается 2 баллами. Выполнение задания С оценивается 3 баллами. ...Фосфор и его соединения и их свойства
Аллотропные модификации фосфора. Чёрный фосфор Красный фосфор Белый фосфор. Химические свойства фосфора. Горение фосфора. Оксиды фосфора. Взаимодействие ...Важнейшие соединения серы
Сероводород выделяется в результате вулканической деятельности, при гниении белков животных и растений, при работе производств химической, текстильной, ...Алюминий и его соединения
Положение в Периодической системе. Алюминий располагается в 3 периоде, в главной подгруппе 3 группы. Порядковый номер элемента – 13 Относительная ...Важнейшие соединения серы
Сероводород выделяется в результате вулканической деятельности, при гниении белков животных и растений, при работе производств химической, текстильной, ...Комплексные соединения палладия в промышленных каталитических системах
Катализ. Производство аммиака, серной и азотной кислот. Гидрогенизация жиров, превращение бензола в циклогексан и др. Комплексные соединения палладия. ...Водородные соединения неметаллов
метан аммиак вода сероводород кислоты. Метан. Газ без цвета и запаха, малорастворим в воде, легче воздуха, горит бледным синеватым пламенем. Смесь ...Конспекты
Азотсодержащие органические соединения и их нахождение в живой природе
Рекомендации по изучению темы. «Азотсодержащие органические соединения и их нахождение в живой природе». . . 1. . Амины. . Понятие об ...Кислородсодержащие органические соединения и их природные источники
ПЛАН-КОНСПЕКТ УРОКА. «Химические свойства спиртов». . ФИО (полностью). . Хочуева Фатима Заурбековна. . . . Место работы. . ...Углерод и его соединения
Автор: . Абакумова Любовь Игоревна. Место работы, должность: . МБОУ СОШ №55 г. Воронеж. Учитель химии. Регион: . Город Воронеж. Стаж ...Фосфор и его соединения
Урок по химии в 9 классе на тему: «Фосфор и его соединения». Цель урока:. Познакомить учащихся с историей открытия фосфора, его аллотропными ...Общая характеристика неметаллов. Элементы V А группы. Важнейщие соединения азота. Фосфор и его соединения
План учебного занятия № 14. Дата Предмет. химия. группа. Ф.И.О. преподавателя: Кайырбекова И.А. . І. Тема занятия:. Общая характеристика неметаллов. ...Сера и её соединения
Конспект урока с использованием ЭОР. Тема:. Сера и её соединения. Класс: 9. Цель:. изучить строение, свойства серы и его соединений. Задачи:. ...Бинарные соединения
. . Зачёт по теме. :. . «Бинарные соединения». . . . Бинарные соединения-вещества,. . образованные атомами двух химических элементов. ...Кремний и его соединения
Конспект урока химии «Кремний и его соединения». Приветствую тебя, мой юный исследователь! Предлагаю тебе сегодня обратиться самым настоящим пиратом. ...Алюминий и его соединения
КГУ "Общеобразовательная школа-лицей при ПГК им. М. Жумабаева". Урок химии. Тема:. Алюминий и его соединения. 9 ...Амфотерные соединения
Лукьянова Татьяна Александровна. . МБОУ СОШ №46. . Учитель химии. . . Муниципальное бюджетное общеобразовательное ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:8 ноября 2018
Категория:Химия
Содержит:50 слайд(ов)
Поделись с друзьями:
Скачать презентацию