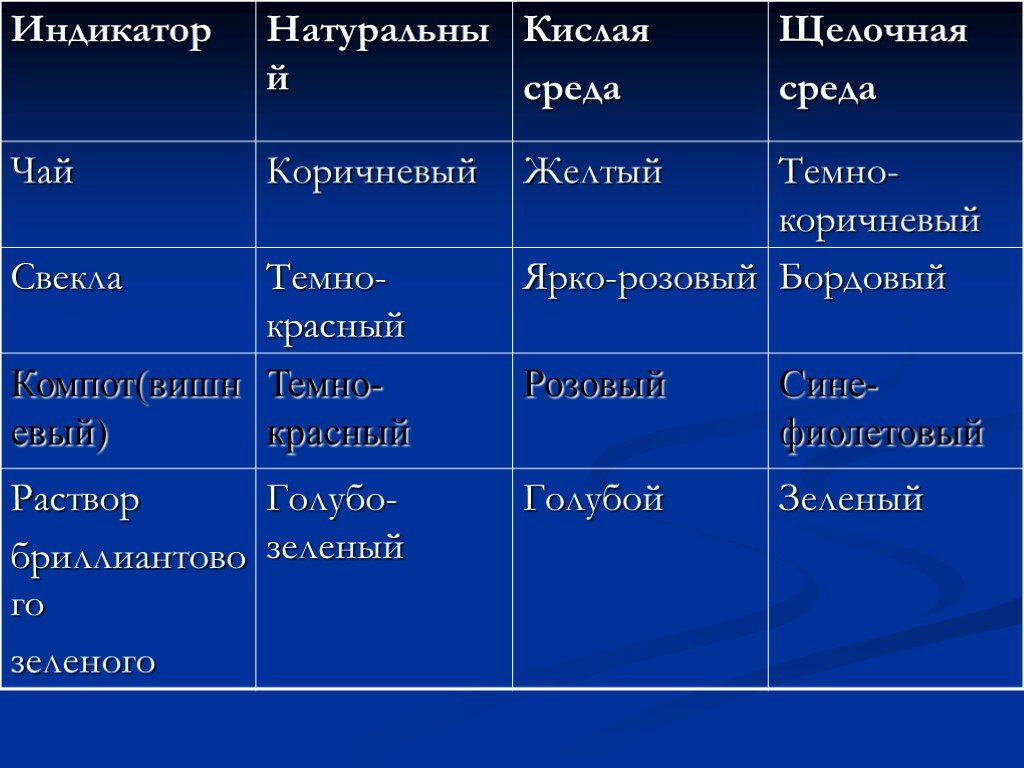
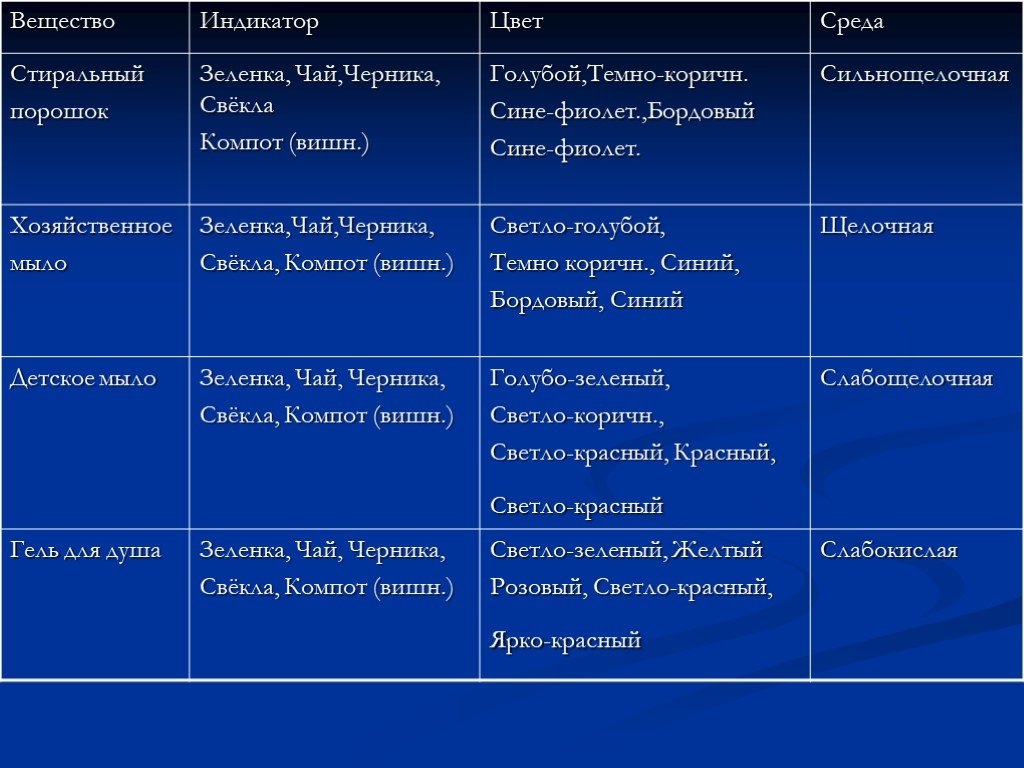
Презентация "Получение и применение индикаторов" по химии – проект, доклад
Презентацию на тему "Получение и применение индикаторов" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 18 слайд(ов).
Слайды презентации
Список похожих презентаций
Альдегиды, свойства, получение, применение
Цели урока.Продолжить знакомить учащихся с кислородсодержащими органическими соединениями на примере альдегидов. Познакомить учащихся с применением ...
Получение радиоактивных изотопов и их применение
Определение. Изото́пы (от др.-греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидности атомов (и ядер) какого-либо химического элемента, ...Получение галогенов. Биологическое значение и применение галогенов
Давайте вспомним . . . Положение галогенов в таблице Менделеева Что вы можете сказать о физических свойствах галогенов А) Агрегатное состояние Б) ...Стекло. История открытия, получение, применение
История. Самое древнее производство Эпохи фараонов. Мастерство египетских стеклоделов достигло совершенства. Древний Египет оставил нам многочисленные ...Химические свойства бензола. Получение, применение
1. Дегидрирование циклоалканов. 2. Дегидроциклизация (ароматизация алканов): 3. Получение бензола тримеризацией ацетилена. 4. Сплавление солей ароматических ...Коферменты. Промышленное получение и применение ферментов
Коферменты – органические природные соединения небелковой природы, необходимые для осуществления каталитического действия ферментов. Коферменты вместе ...Соли: свойства, получение, применение
4. Что такое кислоты? 1. Какие классы веществ вы знаете? 2. Что такое оксиды? 3. Что такое основания? 5. Что такое основные оксиды, (кислотные оксиды)? ...Альдегиды получение, применение, физические и химические свойства
Парфюмерная продукция. Верхние ноты: бергамота, нероли, лимона Средние ноты: ландыша, ириса, жасмина Базовые ноты: мускуса, ванили, сандалового дерева. ...Аммиак состав, строение, свойства, применение
Аммиак может быть обязан своим названием оазису бога Аммона в Северной Африке, находящемуся на перекрестке караванных путей. В очень жарком климате ...Получение радиоактивных изотопов
Элементы, не существующие в природе. С помощью ядерных реакций можно получить изотопы всех химических элементов. Были получены трансурановые элементы: ...Получение натрия сульфата
Поскольку сульфат натрия - это соль, образованная сильным основанием NaOH и сильной кислотой H2SO4, ее раствор имеет показатель рН, близкий к нейтральному. ...Получение каучука
Каучук – это высокомолекулярное соединение, полимер. Каучук бывает двух видов: натуральный и синтетический. Мономер (элементарное звено) натурального ...Получение и свойства водорода
Как вы думаете , где используется водород? Каково практическое значение водорода? Где можно использовать знания по данной теме? Каковы цели урока? ...Получение и свойства алканов
ПОЛУЧЕНИЕ АЛКАНОВ:. ФРАКЦИОННАЯ ПЕРЕГОНКА НЕФТИ Нефть поступает в ректификационные колонны на атмосферную перегонку (перегонку при атмосферном давлении), ...Биологическое значение и применение галогенов
Получение галогенов. В промышленности фтор и хлор электролизом расплавов и растворов. 2NaCl расплав →2Na +Cl2↑ 2 NaCl + 2H2O → H2 + Cl2 +2NaOH В лаборатории: ...Ферменты-свойства и применение
СОДЕРЖАНИЕ:. ПОНЯТИЕ О ФЕРМЕНТАХ КРАТКАЯ ИСТОРИЯ РАЗВИТИЯ УЧЕНИЯ О ФЕРМЕНТАХ ХИМИЧЕСКАЯ ИСТОРИЯ ФЕРМЕНТОВ ОСНОВНЫЕ СВОЙСТВА ФЕРЕНТОВ СТРОЕНИЕ ФЕРМЕНТОВ ...Кислород. Получение кислорода и его физические свойства
Цель. сформировать понятия кислород как атом и молекула; изучить физические и химические свойства кислорода, нахождение его в природе; рассмотреть ...Карбоновые кислоты в природе, химические свойства, применение
План конференции:. 1. «мозговой штурм» 2. Блицопрос 3.Презентация (часть1): номенклатура, строение, классификация 4. Пресс-конференция 5. Презентация ...Исследование свойств и применение в медицине алкалоидов. Извлечение алкалоидов из травы белены черной
«Все есть яд, ничто не лишено ядовитости, одна лишь доза делает яд незаметным» Парацельс. Термин «алкалоид» - «похожий на щелочь» был предложен в ...Графит-добыча и применение
Графи́т (от др.-греч. γράφω — пишу) — минерал из класса самородных элементов, одна из аллотропных модификаций углерода. Структура слоистая. Слои кристаллической ...Конспекты
Аммиак. Физические и химические свойства аммиака, получение, применение
Дата_____________ Класс_______________. Тема:. . Аммиак. Физические и химические свойства аммиака, получение, применение. Цели урока:. знать ...Аммиак. Строение молекулы. Физические и химические свойства. Получение, применение
ПЛАН-КОНСПЕКТ УРОКА Аммиак. Строение молекулы. Физические и химические свойства. Получение, применение. ФИО:. Исмаилова Венера Владимировна. ...Аммиак. Физические и химические свойства. Получение, применение
Конспект урока по химии. Учитель: Сапрыкина Людмила Анатольевна. Предмет: химия класс: 9. Тема урока: «. Аммиак. Физические и химические свойства. ...Альдегиды. Их строение, свойства, получение, применение
Мультимедийный урок по теме: "Альдегиды. Их строение, свойства, получение, применение". . Цели:. 1.Организовать деятельность учащихся по восприятию, ...Кислород: химический элемент и простое вещество. Свойства, получение и применение кислорода
Тема. :. Кислород: химический элемент и простое вещество. Свойства, получение и применение кислорода. Цель: Развитие исследовательских способностей ...Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот, физические и химические свойства, получение и применение
Дата_____________ Класс_______________. Тема:. . Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот, ...Получение и применение предельных одноатомных спиртов
Урок по теме:. 10 класс. «Получение и применение. . предельных одноатомных спиртов». Хабибярова А.А., учитель химии. Цель урока:. п. ознакомить ...Кислород и Озон: значение, получение, физические и химические свойства, применение
Тема урока: « Кислород и Озон: значение, получение, физические и химические свойства, применение.». Цель: использование идей модуля «Обучение критически ...Кислород: строение, свойства, получение и применение
Подготовил: Капитаненко В. П. Учитель химии. МБОУ «Беляевская СОШ». Урок по теме: «Кислород: строение, свойства, получение и применение». ...Жиры, их состав и свойства. Биологическая роль жиров. Получение и применение жиров
Тема:. Жиры, их состав и свойства. Биологическая роль жиров. Получение и применение жиров. Цель:. Формировать знания учащихся о составе жиров, ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:31 декабря 2018
Категория:Химия
Содержит:18 слайд(ов)
Поделись с друзьями:
Скачать презентацию