Презентация "Аммиак состав, строение, свойства, применение" по химии – проект, доклад
Презентацию на тему "Аммиак состав, строение, свойства, применение" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 25 слайд(ов).
Слайды презентации
Список похожих презентаций
Аммиак: состав, строение, свойства, применение
История названия. Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному ...Нефть, состав и свойства. Переработка нефти. Нефтепродукты, их применение.
Залежи нефти находятся в недрах Земли на разной глубине, где нефть заполняет свободное пространство между некоторыми породами. Сегодня нефть является ...Жиры: строение и свойства
Природные жиры. Жиры или триглицериды– природные соединения , представляющие собой сложные эфиры трехатомного спирта глицерина и высших карбоновых ...Карбоновые кислоты в природе, химические свойства, применение
План конференции:. 1. «мозговой штурм» 2. Блицопрос 3.Презентация (часть1): номенклатура, строение, классификация 4. Пресс-конференция 5. Презентация ...Оксиды: их свойства и применение
Цели урока:. Блок-схема « Способы получения и химические свойства оксидов». . Получение оксидов. 1 способ: окисление металлов где CuO – оксид меди ...Жиры, их строение и свойства
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов.Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...
Алкены. Строение. Изомерия. Химические свойства
Элементный анализ этилена показывает, что в его состав входят примерно 87,5% углерода и 14,3% водорода. Плотность этилена по отношению к водороду ...Глюкоза, строение и свойства
Вопросы. 1. Какие соединения называются углеводами? 2. Назовите общую формулу углеводов. 3. По какому признаку классифицируют углеводы? 4. Охарактеризуйте ...Нуклеиновые кислоты-свойства и строение
Нуклеиновые кислоты, строение и свойства Нуклеиновые кислоты представляют собой высокомолекулярные линейные гетерополимеры с молекулярной массой от ...Белки.Строение и свойства
Цели урока. Образовательная – познакомить учащихся с основными химическими свойствами белков на основе проведения опытов и компьютерной презентации; ...Металы. Общая характеристика металлов. Физические свойства и применение металлов
Цели урока: повторить и обобщить сведения о металлической химической связи и кристаллической металлической решетке. Изучить общие физические свойства ...Альдегиды, свойства, получение, применение
Цели урока.Продолжить знакомить учащихся с кислородсодержащими органическими соединениями на примере альдегидов. Познакомить учащихся с применением ...
Алканы: состав, строение, изомерия, номенклатура, получение
В конце января 1848 г. Англия была буквально потрясена трагическим известием из города Ньюкастла. Пятнадцатилетняя девочка Ханна Гринер загадочно ...Белки. Строение и свойства
Белки. Белки – это высокомолекулярные органические соединения, состоящие из остатков аминокислот представляющие собой биополимер, состоящий из мономеров, ...Аминокислоты и белки: строение и свойства
Аминокислоты. Соединение, которое содержит одновременно и кислотную функциональную группу, и аминогруппу, является аминокислотой. . . . Незаменимые ...Алюминий, его Свойства и применение
Al 13. Алюминий (лат. Aluminium). 3 8 2 26,9815 3s2 3p1. Был впервые получен датским физиком Х.К. Эрстедом в 1825 г. Название этого элемента происходит ...Альдегиды получение, применение, физические и химические свойства
Парфюмерная продукция. Верхние ноты: бергамота, нероли, лимона Средние ноты: ландыша, ириса, жасмина Базовые ноты: мускуса, ванили, сандалового дерева. ...Нефть. Свойства, состав, переработка
Любая попытка дать характеристику такому многогранному дару природы, как нефть, никогда не может быть исчерпывающей. О нефти писали и будут писать. ...Различные свойства воды и значение воды в живой и неживой природе
Вода! У тебя нет ни вкуса, ни цвета, ни запаха, тебя невозможно описать, тобою наслаждаются, не ведая, что ты такое. Нельзя сказать, что ты необходима ...Аммиак
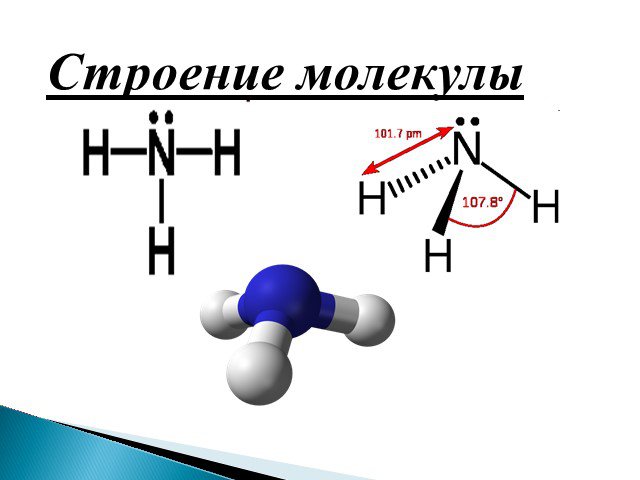
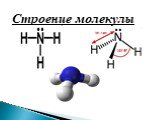
Строение молекулы. Водородная связь. Водородная связь – это химическая связь между атомами водорода одной молекулы и атомами очень электроотрицательных ...Конспекты
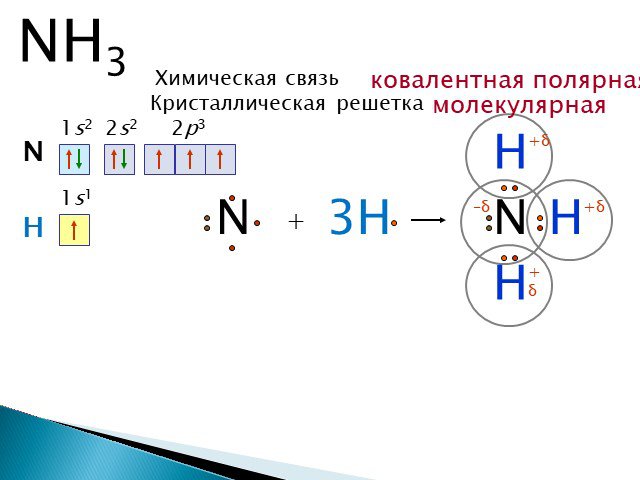
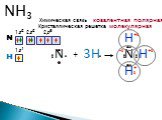
Аммиак. Строение молекулы. Физические и химические свойства. Получение, применение
ПЛАН-КОНСПЕКТ УРОКА Аммиак. Строение молекулы. Физические и химические свойства. Получение, применение. ФИО:. Исмаилова Венера Владимировна. ...Насыщенные одноатомные спирты: состав, строение, свойства, получение
Урок химии в 11 классе. Тема урока. . Насыщенные одноатомные спирты: состав, строение, свойства, получение. Тип урока. : изучение нового материала. ...Кислород: строение, свойства, получение и применение
Подготовил: Капитаненко В. П. Учитель химии. МБОУ «Беляевская СОШ». Урок по теме: «Кислород: строение, свойства, получение и применение». ...Азотная кислота строение, свойстваи применение
Открытый урок по химии в 9 классе по теме:. . . « Азотная кислота строение, свойстваи применение». Учитель МКОУ СОШ с.п. Кара-Суу Жабоева Раиса ...Вода в природе. Состав, свойства и применение воды
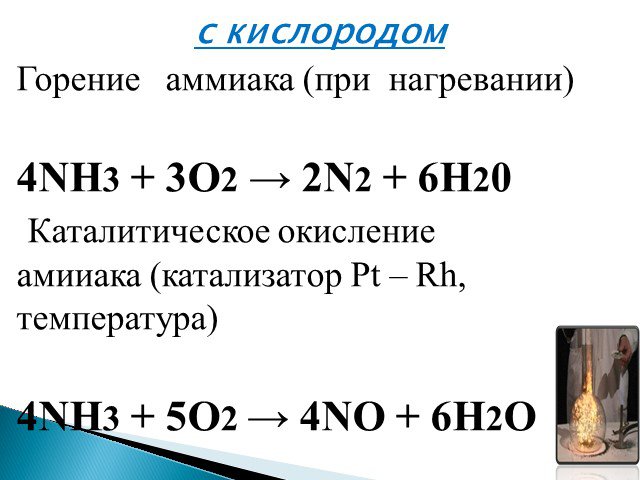
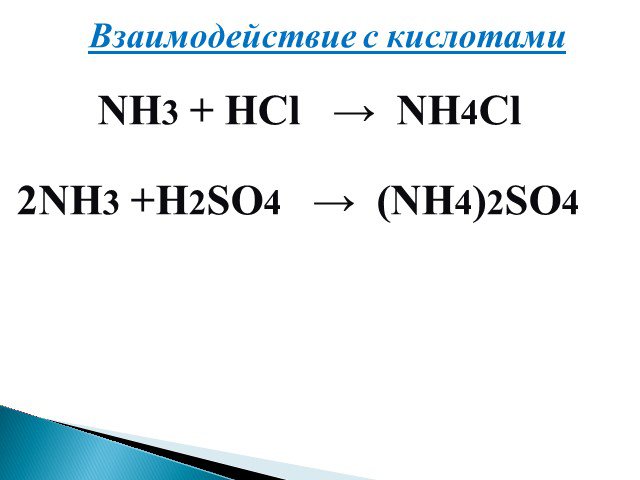
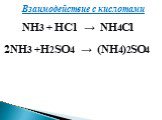
Дата:. 26.02. 15 г. Предмет:. химия, 8 класс. Тема: Вода в природе. Состав, свойства и применение воды. ЦЕЛЬ:. . Сформировать знания о распространении ...Аммиак. Физические и химические свойства аммиака, получение, применение
Дата_____________ Класс_______________. Тема:. . Аммиак. Физические и химические свойства аммиака, получение, применение. Цели урока:. знать ...Глюкоза, классификация углеводов, строение, свойства, получение, применение, биологическая роль
Министерство общего и профессионального образования. Ростовской области. ГБОУ НПО РО ПУ № 61. имени Героя Советского Союза Вернигоренко И.Г. ...Карбоновые кислоты: состав, строение, номенклатура, изомерия, физические свойства
Урок химии в 10 классе. Тема: Карбоновые кислоты: состав, строение, номенклатура, изомерия, физические свойства. . . Тип урока:. урок ознакомления ...Жиры, их состав и свойства. Биологическая роль жиров. Получение и применение жиров
Тема:. Жиры, их состав и свойства. Биологическая роль жиров. Получение и применение жиров. Цель:. Формировать знания учащихся о составе жиров, ...Аммиак. Физические и химические свойства. Получение, применение
Конспект урока по химии. Учитель: Сапрыкина Людмила Анатольевна. Предмет: химия класс: 9. Тема урока: «. Аммиак. Физические и химические свойства. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:15 января 2016
Категория:Химия
Содержит:25 слайд(ов)
Поделись с друзьями:
Скачать презентацию